Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамические основы металлотермии урана
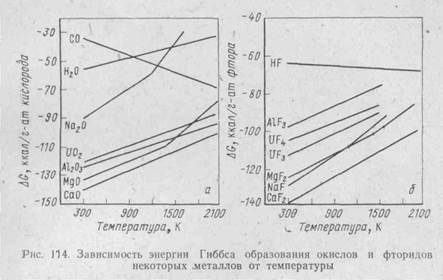
Разберем общие принципы восстановительных металлотермических процессов применительно к металлургии урана, выражаемых в общем виде реакцией UX + R ® RX + U + Q где Х — кислород или галоген; R — металл - восстановитель (К, Nа, Са, Мg, Al); RХ—шлак; Q —тепловой эффект реакции. Так как процессы протекают в сторону уменьшения энергии Гиббса DG, то в качестве восстановителей можно использовать только такие металлы, образование окислов или галогенидов которых сопровождается уменьшением энергии Гиббса по сравнению с реакциями образования аналогичных соединений урана. Изменения DGoT реакций образования окислов в зависимости от температуры показаны на рис. 114, а.
Из диаграммы следует, что для восстановления урана из его окислов возможно применение Са, Мg, Al, но не Н2 или Nа. Однако алюминий с ураном образует сплавы, что исключает его использование. В принципе при очень высоких температурах можно применять С, однако он образует с ураном карбиды. Диаграмма для фторидов (см. рис. 114, б) показывает, что в принципе возможно восстановление тетрафторида урана с использованием Са, Мg и Nа. Но натрий очень опасен в обращении, кроме того, его температура кипения (880° С) намного ниже температуры плавления урана (1130° С), что создает дополнительные трудности при практическом осуществлении процесса. Аналогичны диаграммы и для хлоридов, однако тетрахлорид урана менее стоек, легко окисляется, гидролизуется, поглощает влагу из воздуха, очень летуч (Tкип=790° С), т.е. менее удобен для практических целей. Таким образом, с учетом физико-химических свойств соединений в качестве исходных продуктов выбирают окислы или фториды урана, а в качестве восстановителей — кальций или магний. К сказанному следует добавить, что кальций и магний нерастворимы в уране, их окислы и фториды — термически очень стойкие вещества, вследствие чего их можно использовать как огнеупорные материалы для аппаратов восстановительной плавки. Реакции: UO2 + 2Ca ® U + 2CaO; UO2 + 2Mg ® U + 2MgO; UF4 + 2Ca ® U + 2CaF2; UF4 + 2Mg ® U + 2MgF2 относятся к типу металлотермических. Вспомним в этой связи реакцию алюмотермии, открытую Н. Н. Бекетовым еще в 1859 г.: 2Fe3O4 + 3Al ® 4Al2O3 +9Fe + 795ккал. «термит» Смесь порошкообразных окиси железа и алюминия — так называемый термит применяют, в частности, для сварки рельсов. Тщательно перемешанная смесь поджигается запалом в одной точке, и почти мгновенно начинается ослепительно-яркий процесс с развиваемой температурой свыше 3500° С, идущий по цепной химической реакции.
Следовательно, для успешного осуществления металлотермического восстановления чрезвычайно важное значение имеет наличие в каждой точке шихты реагирующих веществ в стехиометрических соотношениях, что можно обеспечить сочетанием совершенного перемешивания и тонкой дисперсности исходных материалов. Реакция инициируется возбуждением с помощью электрозапала, химического запала (смесь магния с селитрой) или нагревом аппарата с его содержимым в печи. Реакция протекает быстро и практически адиабатически (футеровкаиз нетеплопроводного материала). Аналогичные реакции металлотермического восстановления применяются и для получения металлического урана. Все промышленное производство металлического урана можно разделить на два типа способов. 1. Восстановление окислов урана кальцием или магнием. В этом случае выделяющегося тепла достаточно только для расплавления одного урана. Шлак остается в твердом состоянии. В этих условиях уран получают в виде порошка — зерен сферической формы вроде мелкой дроби, чтобы отделить шлак от урана, его приходится удалять растворением в слабой кислоте. 2. Восстановление тетрафторида урана магнием или кальцием. При этом выделяющегося тепла хватает, чтобы расплавить и металл, и шлак. Полученные две жидкие фазы достаточно хорошо отделяются друг от друга, что позволяет после охлаждения и затвердевания урана получить его в виде компактного слитка.
|
|||||
|
Последнее изменение этой страницы: 2019-04-27; просмотров: 456; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.244.216 (0.006 с.) |