
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электроліз розплавів і водних розчинів
ЕЛЕКТРОЛІТІВ ОСНОВНІ ПОНЯТТЯ ТА ВИЗНАЧЕННЯ
Для газоподібних речовин об’єднаний закон Фарадея можна записати у вигляді:
де V – об’єм газу, що виділяється на катоді або аноді, л;
ПРИКЛАДИ ВИКОНАННЯ ЗАВДАНЬ Приклад 1. Процеси при електролізі розплаву електролітів. Скласти рівняння катодного і анодного процесів, які відбуваються при електролізі розплаву суміші Cu(NO3)2 і KOH з графітовими електродами. Відповідь. У розплаві електроліти дисоціюють на іони:
На катоді (-) відновлюється найбільш активний окисник з найбільшим значенням електродного потенціалу. У даному випадку можливе відновлення як іонів міді
так і іонів калію
Оскільки На аноді (+) окиснюється найбільш активний відновник з найменшим значенням електродного потенціалу. У даному випадку можливе окиснення як іонів
Приклад 2. Процеси при електролізі водного розчину електроліта з інертними електродами. Скласти рівняння катодного і анодного процесів, які відбуваються при електролізі водного розчину солі Na2SO4 з інертними електродами. Відповідь. У водному розчині відбуваються процеси дисоціації:
На катоді можуть відновлюватися іони Na+:
і молекули води
Оскільки На аноді, відповідно до послідовності розрядження аніонів на інертному аноді (
Приклад 3. Процеси при електролізі водного розчину електроліту з розчинним анодом. Скласти рівняння електродних процесів при електролізі розчину FeCl2 з мідним анодом. Відповідь. У розчині відбуваються процеси дисоціації:
На катоді можливі процеси відновлення:
Оскільки стандартні електродні потенціали цих систем близькі, то на катоді одночасно відновлюються і іони Феруму(II) і молекули води. На аноді окиснюється матеріал електрода – мідь, бо стандартний потенціал процесу
є найменшим порівняно зі стандартними потенціалами процесів окиснення
Приклад 4. Розрахунки на підставі об’єднаного закону Фарадея. Електроліз розчину CuCl2 проводили силою струму 5А протягом 10 годин. Скласти рівняння катодного і анодного процесів, які відбуваються на інертних електродах. Розрахувати масу солі, що розклалася, масу речовини, яка виділилась на катоді, і об’єм газу, що виділився на аноді. Розв’язання. У водному розчині купрум(II) хлориду відбуваються процеси дисоціації:
На катоді відновлюються іони Cu2+, оскільки -0,41В. На аноді окиснюються іони Cl– відповідно до послідовності розрядження аніонів: ( Отже, на електродах ідуть процеси:
Для розрахунку мас речовин, що розкладаються та виділяються при електролізі використовуємо об’єднаний закон Фарадея:
Молярна маса еквівалента CuCl2:
Маса CuСl2, що розклалася під час електролізу:
Молярна маса еквівалента Купрум(II) і маса міді, що виділилась на катоді, дорівнюють:
Об’єм газу, який виділяється при електролізі, розраховується відповідно до закону Фарадея за формулою
Молярний об’єм еквівалента хлору:
Об’єм хлору, що виділився на аноді:
КОНТРОЛЬНІ ЗАВДАННЯ 561. Скласти рівняння катодного і анодного процесів, які відбуваються при електролізі розплаву суміші солей KCl та AgNO3 з інертним анодом. Яка маса срібла виділиться при проходженні струму силою 5А протягом двох годин?
Відповідь: 40,3 г.
562. Скласти рівняння процесів, які відбуваються при електролізі розчину СuCl2 з мідним анодом. На скільки зменшиться маса анода через 3 години при проходженні струму силою 4А? Відповідь: на 14,2 г.
563. На підставі рівнянь процесів, які відбуваються при електролізі розплаву NaCl, визначити масу металу, що виділяється на катоді, та об’єм газу, який виділяється на інертному аноді, при проходженні через електролізер 100 кКл електрики. Відповідь: 23,8 г, 11,6 л.
564. Електроліз розчину Відповідь: 21,9 г, 6 г. 565. Визначити силу струму, необхідну для отримання 50 г металічного магнію, при електролізі розплаву магній хлориду протягом 10 годин. Скласти рівняння процесів на інертних електродах. Відповідь: 11,2 А.
566. Скласти рівняння процесів, які відбуваються на графітових електродах при проходженні струму силою 5А через водний розчин PbCl2. Протягом якого часу маса катоду збільшиться на 30 г? Відповідь: 1 год 33 хв.
567. Яка сила струму потрібна для зменшення на 20 г маси цинкового аноду при електролізі розчину ZnSO4 протягом 1 години? Скласти рівняння електродних процесів. Відповідь: 16,4А.
568. При пропусканні електричного струму силою 6А через розчин солі двовалентного металу протягом 4 годин на катоді виділилось 28,45 г металу. Розрахувати молярну масу цього металу. Який це метал? Відповідь: 63,5 г/моль.
569. Електроліз розчину SnCl2 проходив при силі струму 4А. Скласти рівняння катодного і анодного процесів та розрахувати масу солі, що разклалася за 2 години. Відповідь: 28,3 г.
570. Скласти рівняння катодного і анодного процесів, які відбуваються при пропусканні електричного струму силою 10А через розплав NaOH. Розрахувати масу речовин, які виділилися на графітових електродах через 2,5 години. Відповідь: 21,45 г, 7,5 г.
571. Скласти рівняння електродних процесів при електролізі розплаву FeCl2. Визначити молярну масу еквівалента Феруму, якщо за 3 години на катоді виділилось 25 г металу при силі струму 8А. Відповідь: 27,9 г/моль е.
572. Розрахувати масу і об’єм газу, що виділився на інертному аноді при проходженні через розчин Cr2(SO4)3 14500 Кл електрики. Скласти рівняння анодного і катодного процесів. Відповідь: 1,2 г, 0,8 л.
573. На скільки зменшиться маса нікелевого анода, якщо через розчин солей Na2S і KІ пропустити електричний струм силою 8А протягом 10 годин? Скласти рівняння катодного і анодного процесів. Відповідь: 87,6 г.
574. При електролізі розплаву солі Феруму на катоді виділилось 3,6 г металу. Визначити молярну масу еквівалента Феруму, якщо електроліз тривав 1 годину при силі струму 5,2А. Відповідь: 18,6 г/моль е.
575. Визначити час, потрібний для виділення 2 кг металічного кальцію на вугільних електродах електролізом розплаву Са(ОН)2 при силі струму 2500А. Скласти рівняння катодного і анодного процесів. Відповідь: 1 год 4 хв. 20 с.
576. Скласти рівняння катодного і анодного процесів на вугільних електродах при електролізі розчину К2SO4. Яка маса води розклалася за 2 год 15 хв при силі струму 8А?
Відповідь: 6,04г.
577. Визначити час, потрібний для розкладу 0,5 кг Cu(NO3)2 при електролізі розчину цієї солі електричним струмом силою 16А. Скласти рівняння електродних процесів на графітових електродах. Відповідь: 8 год 56 хв.
578. Електроліз розплаву NiCl2 проводили при силі струму 10А протягом 4 год 25 хв. Скласти рівняння процесів, які відбуваються на інертних електродах, та розрахувати маси речовин, які виділяються на катоді та аноді. Відповідь: 48,4 г, 58,5 г. 579. При електролізі розчину CuSO4 протягом 10 годин маса мідного аноду зменшилась на 100 г. Скласти рівняння електродних процесів та розрахувати силу витраченого електричного струму. Відповідь: 8,4А.
580. Скласти рівняння катодного і анодного процесів, які відбуваються при електролізі розчину солей NaІ і AgClO4. На скільки зросте маса катоду через 8 годин при силі електричного струму 6А? Відповідь: на 193,4 г.
ТВЕРДІСТЬ ВОДИ
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 1234; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.140.151 (0.028 с.) |
 або
або  ,
де
,
де  - маса окисненої або відновленої речовини, г;
- маса окисненої або відновленої речовини, г;
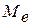 - молярна маса еквівалента речовини, г/моль е;
Q – кількість електрики, Кл;
- молярна маса еквівалента речовини, г/моль е;
Q – кількість електрики, Кл;
 - сила струму, А;
- сила струму, А;
 - час, с;
- час, с;
 - стала Фарадея, Кл/моль е.
- стала Фарадея, Кл/моль е.
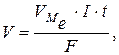
 - молярний об’єм еквівалента окисненої або відновленої газоподібної речовини, л/моль е.
- молярний об’єм еквівалента окисненої або відновленої газоподібної речовини, л/моль е.
 ,
, .
. , то на катоді виділяється мідь.
, то на катоді виділяється мідь. , так і іонів
, так і іонів 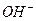 . Згідно послідовності розрядження аніонів на інертному аноді (
. Згідно послідовності розрядження аніонів на інертному аноді ( , аніони оксигеновмісних кислот) в даному випадку мають розряджатися іони
, аніони оксигеновмісних кислот) в даному випадку мають розряджатися іони 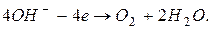



 , то в першу чергу відновлюються молекули води з виділенням водню.
, то в першу чергу відновлюються молекули води з виділенням водню. , аніони оксигеновмісних кислот), розряджаються молекули води з утворенням кисню:
, аніони оксигеновмісних кислот), розряджаються молекули води з утворенням кисню:


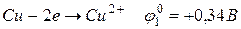
 та
та  .
.
 , а стандартний потенціал відновлення молекули води значно менший і дорівнює
, а стандартний потенціал відновлення молекули води значно менший і дорівнює аніони оксигеновмісних кислот).
аніони оксигеновмісних кислот).

 .
.


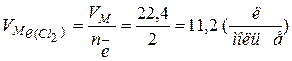 .
. .
. проводили при силі струму 4А протягом 5 годин. Скласти електронні рівняння процесів, які відбуваються на інертних електродах, та визначити маси речовин, які виділились на катоді та аноді.
проводили при силі струму 4А протягом 5 годин. Скласти електронні рівняння процесів, які відбуваються на інертних електродах, та визначити маси речовин, які виділились на катоді та аноді.


