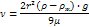Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хим состав и строение молек воды.Стр 1 из 8Следующая ⇒
Хим состав и строение молек воды. В 1783 году был открыт состав воды физиком Лавуазье.(Н2О);1805г. – открыто строение воды. Электронные облака молекул воды распол в форме неправил тетраэдра. Атом кислорода оказыва при этом в центре, а два атома водорода – в противоположных углах одной из граней куба. Угол между ними составляет 1040 31¢. Два из восьми электронов расп около ядра, два др связаны с атомами водорода, а две неподеленные пары электронов образ ветви, расп в противоположном направл по отн к электронным облакам водородов.Вода – 2Н 16О(99,75);Изотопы воды –2Н 17О (0,04% в природе); 3Н 18О(0,2% в природе).Если электроны движ в одном направлении – это пара-вода. Если электроны движ в разных направл – это орто-вода.Если бы молекулы воды не имели отрицат заряженных ветвей электронного облака и дипольных моментов, они не могли бы взаимодействовать друг с другом. Водородные взаимодействия. Водор связи – связи, которые образ между полож заряженными атомами водорода одной молекулы и отриц заряж атомами другой молекулы. (кислород, азот, фтор, фосфор). Возникн водородной связи объясняется св-вом атома водорода взаимод с сильно электроотрицательным элементом(с кислородом др молек воды). Такая особенн водородн атома обусловл тем, что, отдавая свой единственный электрон на образов ковалентной связи с кислородом, он остается в виде ядра очень малого размера, почти лишенного электронной оболочки. Поэтому он не испыт отталкивания от электронной оболочки кислорода другой молекулы воды, а, наоборот, притягивается ею и может вступить с нею во взаимод. Наиб устойчивость у удвоенных молекул (Н2О)2, образование кот сопровождается возникн 2-х водородных связей. Согласно методу электронных орбиталей водородная связь образ за счет дисперсионных сил, ковалентной связи и электростатического взаимод. Агрегатные состояния воды. 1.Жидкая вода: – в воде сущ элем упорядоченности, между кот расположены отдельные молек воды;– хаотичное распол молекул 2.Лед(00 С) – кристаллическая стр-ра, нет упорядоченного строения. При образ кристаллич стр-ры между молекулами воды образ пустоты с размером больше молекулы воды. Плотность льда ниже плотности воды, вода при замерзании расширяется.Модификации льда(14шт.):– Если вода замерзает при повыш давлении, образ лед повышенной плотности, плотнее жидкой воды.– Горячая вода замерзает быстрее холодно – эффект Мкемба.
3. Газообр сост. Для перевода воды из жидкого в газообр сост необходимо преодолеть силы межмолекул взаимод. Работа испарения – работа по преодолению межмолекул взаимод, характериз теплотой испарения. У воды по сравнению с другими жидкостями максим теплота испарения и максим теплота плавления. Аномалии воды - большая тепл-ть -увеличение объема при замерзании -большое повер-ое натяжение воды -легче всего охлаждается и нагревается в «темрер-ой яме» 37 С -сильно поглащает газч и легко их отдает Химические свойства воды. 1. Разложение 2. Универсальный растворитель 3. Катализатор во многих процессах 4. реагент и продукт многих хим.реакций Сущ 4 типа важн химич реакций, в кот участвует вода. 1 тип: Кислотно-основная реакция.
2 тип: Окислит-восстан реакции. С водой реагируют все металлы до алюминия включительно.
3 тип: Гидратация – способность воды сольватировать как катионы, так и анионы
4 тип: Гидролиз(реакция обмена веществ с водой).
Вода способн образов клотраты.
6. Физико-химич св-ва растворов неэлектролитов и электролитов. Первый закон Рауля Электролиты-вещ-ва способные распадаться на ионы при плавлении или растворении. Относит-е понижение давления пара расвор-ля над раств-ом = мольной доле раств-го вещества
где Р0 – давл над чистым растворителем, Р – давл растворителя над раствором, n – химич количество растворённого вещества, N – химическое количество растворителя Второй закон Рауля: увелич t кипения (Тк) и умен t замерзания (Тз) тем болmше, чем больше конц-ия растворённого в-ва:
где Е – эбуллиоскопическая пост, Ст – молярная концентрация где К – криоскопическая постоянная
Уравнение Вант-Гоффа:
где Росм – осмотич давл (кПа), С – молярная концентр раст-ра (моль/л), R – универсальная газовая постоянная (8,31), Т – температура (К)
Уравнен, характериз общие св-ва ра-ров неэлектролитов, можно использ для растворов электролитов, если ввести в них поправочный коэфф.
где i – изотонический коэфф
где Произведение растворимости Произв растворимости – количественный показатель степени нерастворимости солей и гидроксидов.
Если произведение концентрации ионов (ПК) будет меньше ПР, то раствор ненасыщенный и осадка нет. Если ПК больше ПР, то выпадает осадок и раствор перенасыщен. Если то раствор насыщен. Диссоциация воды. Вода является слабым электролитом. Диссоц воды - разлож воды на составляющие хим элементы,. Диссоциация воды явл эндотермической реакцией, т.е. идущей с поглощением теплоты из окруж среды.
При Ионное произведение воды Кw [Н2О] = [Н+] [ОН-] = 10-14 при 25°С – ионное произведение воды рН= -lg [H+] рОН= -lg [ОH-] рОН= 14 – рН [H+] = [ОH-], то рН=7 – среда нейтральная [H+] > [ОH-], то рН<7 – кислая среда Буферные р-ры и их свойства Буферные р-ры-это р-ры, рН которых ост-ся постояннвм при прибавлении небльшого кол-ва к-ты или щелочи. Св-ва буферных р-ов. 1.рН не зависит от разбавления..2. Конц-ия водор ионов буф р-ов мала изменяется от прибавления кислот и оснований.Но при добавл кислоты и основания следует помнить, что кол-во их не должно прев половины конц-ции соли или кислоты, образующих буфер. В противном случае емкость буфера будет превышена и рН может измениться. Буферные смеси играют большую роль в процессах, протекающих в живых организмах и в неживой природе. Буферная емкость- это кол-во моль к-ты или щелочи, которая необходима прибавить к 1л буф-го р-ра, чтобы изменить рН на 1. Гидролиз солей Гидролизом наз обменное разложение веществ с водой. Сущность гидролиза состоит в том, что катионы или анионы солей связсоответственно водородный или гидроксильный ионы воды с образ-ем малодиссоциирующих или труднораст продуктов. В этом процессе происх накапливание свободных ионов гидроксила или водорода Гидролизу подвержены соли слаб кислот и слаб оснований, слабых кислот и сильных оснований, сильных кислот и слабых оснований. Соли, образованные силь кислотой и силь основанием, гидролизу не подвергаются.Гидролиз протекает медленно, и равновесие устанавливаем через нек время. Этим объясняется изменение во времен рН растворов гидролитически расщепляемых солей. При гидролизе солей, образованн слаб основанием и сильн кислотой, константа гидролиза равна ионному произвед воды, деленному на константу диссоциации слабого основания: Кгидр = Кв/Кд,осн При гидролизе солей, образслабым основанием и слабой кислотой, константа гидролиза равна ионному произвед воды, деленному на произвед констант диссоциации основания и кислоты: Кгидр = Кв/Кд Косн Повышение темпер, усиливая диссоциацию воды, повышает конц-цию водородных и гидроксильных ионов. При гидролизе солей, образов слаб основанием и сильн кислотой или сильным основанием и слаб кислотой, в том же направлении влияет и пониж концентрации р-ра. Поэтому для усиления гидролиза следует.пользоваться более разбавленными р-рами и работать при более высокой темпер.
Соль, образ сильной кислотой и слабым основанием, лучше гидролизуется при низкой конц-ции водородных ионов, а соль, образованная сильноснованием и слаб кислотой, наоборот при высоком содерж водородных ионов.
Диаграмма состояния воды Графич изображение зависимости св-в систем от t и P Анализ диаграмм состояния позволяет опред число фаз в системе границы их сущ-ия, характеристику взаимод компонентов. В основе анализа диаграммы состояния лежат 2 принципа: принцип непрерывности и принцип соответствия. 1) принцип непрерывности: при непрерывном измен параметров состояния св-ва отдельных фаз меняются непрерывно, св-ва всей системы меняется непрерывно до тех пор, пока не изменится число или природа фаз, что приводит к скачкообразному изменению св-ва системы. 2) Принцип соответствия: на диаграмме состояния каждой фазе соответствует часть плоскости – поле фазы, линии пересечения плоскостей отвечающих равновесию между 2-мя фазами. Всякая точка на диаграмме состояния (фигуративная точка) соотв некоторому состоянию системы с определ значением параметра.
Окислители и восстановители Окисление — это проц отдачи электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд:
Если отрицательно заряженный ион (заряд -1), например Сl-, отдает 1 электрон, то он становится нейтральным атомом: Если полож заряженный ион или атом отдает электроны, то величина его положит заряда увеличив соответственно числу отданных электронов:
Восстановление — это проц присоединения электронов атомом, молекулой или ионом.Если атом присоединяет электроны, то он превращ в отрицательно заряженный ион:
Если полож заряж ион принимает электроны, то велич его заряда уменьш:
или он может перейти в нейтрал атом:
Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны. Окислит-восстан потенциалы Окисл-восстановпотенциалы определяют возможность и направленность протекания окисл-восстан реакций. 1. Пластинка активного металла Поскольку металл активен, катионы из пластинки переходят в раствор. Чем активнее металл, тем разность потенциалов выше. Активный малоактивный
Е<0 Е>0. Представим себе металлич пластинку, погруженную в воду. Под действием полярных молекул воды ионы металла отрываются от поверх пластинки и гидратированными переходят в жидкую фазу. Последняя при этом заряжается полож, а на металлической пластинке появляется избыток электронов. Чем дальше протекает процесс, тем больше становится заряд, как пластинки, так и жидкой фазы.
Наконец, наступает момент, когда между раствором и металлич пластинкой устанавл равновесие, которое можно выраз уравн:
или с учетом гидратации ионов в растворе:
При погружении металла в раствор на границе раздела фаз образ двойной электрический слой. Разность потенциалов, возник между металлом и окружего жидкой фазой, наз электродным потенциалом. Этот потенциал явл характерист окисл-восстан способности металла в виде твердой фазы.У изолированного металлич атома (состояние одноатомного пара, возникающее при выс темпер и высоких степенях разрежения) окислит-восстан с-ва характериздругой величиной, назионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома.. Окисл-восстан св-ва воды В воде возможны протекания 2ух процессов:1. Восстановление ионов водородом или молекул воды:
2. Окисление гидроксид анионов или молекул воды:
Уравнение Нертнса для восстановления ионов в воде:
Если pH=7, то Это значит, что система с потенциалом меньшем чем -0,41В => не устойчива в воде. (вода выступает как восстановитель) Св-ва коллоидных систем. Молекулярно-кинетические св-ва. Молекулярно - кинетич наз св-ва, которые обусловлены хаотическим тепловым движ частиц. Применительно к коллоидным р-рам к этим св-вам следует отнести броуновское движение, диффузию и седиментацию. Броун движ — беспорядочное, хаотичное движ колл частиц.Диффузия - самопроизвольный процесс перемещения в-ва в результате беспорядочного тепл движчастиц,.Седиментация — распредел коллоидных частиц по высоте. В нижних слоях р-ра концентрация частиц дисперсной фазы значительно выше, чем в верхних..Отличител св-вом коллоидных систем явл их способность рассеивать свет. Коллоидные частицы обладают св-вом рассеивать во всех направлениях падающие на них лучи света Поверхностное натяжение Пов натяжение в жидкости — величина, численно равная работе, которая затрач на преодоление сил притяжения между частицами поверхностного слоя при выходе молекул на поверхность. При растворении какого-либо в-ва в жидкости ее поверхностное натяжение, как правило, изменяется. Неорганич соли при растворении в воде несколько повышают величину ее поверхностного натяжения. Органич в-ва, например жирные кислоты, спирты, кетоны, мыла, протеины, весьма значительно понижают поверхностное натяжение воды. Вещества, вызывающие резкое понижение поверхностного натяжения, называются поверхн-активными. Количественно явление адсорбции опред урав Гиббса, установленным с помощью термодинамических расчетов:
где с — конц-ция растворенного вещества в растворе; Г — избыток его в поверхн слое, моль/см2; Величину Адсорбция равновесия Адсорбция- процесс поглащения сорбтива всем объемом сорбента. Сорбция-процесс поглащ-я одного вещ-ва(сорбтива) другим вещ-ом(сорбентом) независимо от механ-го поглащ-я. Если сорбция протекает с образ-ем химич-х связей, то это хемосорбция. Необрат-ть, специфичность, высокая теплота сорбции. Водопотребление -наз. Изьятие воды из источников для разной цели (питьевой,хоз-бытовой,на нужды животноводства,земледелия,рыболовства,отраслей промышленности и т.д.) Использование воды может быть: возвратным,безвозвратным и для орашени. 33.Особ химич состава природных вод При формир состава природных вод происходит взаимодействие с окружающей средой (почва, атмосфера, горные породы), при этом протекают следующие процессы: растворение соединений, химич взаимод с водой и водными р-рами, биохимические реакции, калоидно – хими взаимодействия. Действие каждого процесса в свою очередь определяются следующими условиями: темп, давление, геологич особенности Природные воды квалифицируют: -по происхожд разл: атмосф воды (осадочные), подземные воды (ключевые и колодезные), и поверхн воды (речные, озерные, морские, болотные). - согласно классификации О.А. Алекин природные воды по преобладающему аниону делятся на 3 класса: 1) карбонатный или гидрокарбонатный (С);2) сульфатный (S);3) хлорные(Cl); по преобладающему катиону классы делятся на группы: 1) кальциевая (Са);2)магниевая(Mg); 3)натриевые(Na); группы делятся на типы в кот указывается соотношение между ионами (мг-экв) I гидрокарбонат анионов HCO-3>Ca2++Mg2+- II HCO-3+SO42-< Ca2++Mg2+ IV кислые воды содержащие HCO-3=0 34.Классификация примесей природных вод на основе их фазово-дисперсной характеристики.. Кульский предложил классиф.примесей воды подлеж-му очистке с учётом фазодисперстных характ-ик загрязнения и хим.состава. 4 группы по отнош-ию к дисперстной среде: 1)нерастворимые в воде примеси(взвеси,эмульсии…)эти примеси за искл-ем микроорг-ов образуют кинетически неустойчивую систему. 2)коллоидные примеси,вирусы,бактерии и высокомолек-ые соединения,т.к.диаметр этих частиц мал,необходимо введение хим.реагентов вызывающие коагуляцию частиц или воздействие электр.током. 3)соед-ия образ-ие молекулярные р-ры(газы,орган-ие в-ва…)они образуют гомогенные смеси,часть примесей удал-ся хим.реагентами,часть активированным углём. 4)в-ва диссоциирующие на ионы. Удаление ионов из воды осущ-ся связыванием молераств-ых соед-ий, преобразованием в газообразные и малодиссоциирующие соединения 35.Понятиеоб обобщённыхоценочных показателях качества воды. Правило отбора проб: для открытых водоёмов:с пов-сти воды и с той глубины на которой берётся вода. для действующего водозабора проба воды отбирается после насосов 1-ой ступени. Оценка кач-ва классиф.по грунтам: 1)мутность воды опред-ся гравимитрическим и нефеломитрическим методом. 2)цветность воды. Гулиновые и фульвокислоты и их расворимые соли сообщают воде окраску.Цветность опред-ся по платиново кобальтовой шкале и выраж-ся в градусах. 3)запах и вкус воды. Опред-ют при t=20℃ и при подогреве до t=60℃. 4)температура воды.Наиболее благоприятная- 7-12℃ питьевой воды. 5)хим.компоненты влияющие на органо-липтические св-ва. Предусмотрены предельно допустимые компонентов,прежде всего общие солисод-ие и минерал. 6)жёсткость воды.Ионы Са2+ и Mg2+ хар-ют жёсткость.Общая жёсткость не должна превышать 7 ммоль/л 7)водородный показатель. 6,5<рН<8,5 Осаждение Рассм осаждение частиц двух типов — гранулированных и флокулированных. Гранулированные частицы осаждаются независимо друг от друга и с постоянной скоростью. Флокулированные – с различной скоростью в зависимости от исходной концентрации в-ва. Если их концентрация мала, то осаждение идет медленно виде отдельных хлопьев, при столкновении хлопье сливаются и укрупняются, скорость осаждения увеличивается. Это явление называется – стесненное или флокулянтное осаждение. При высокой концентрации частиц происходит совместное осаждение хлопьев с четким разделом фаз между верхним слоем жидкости и осадком. Такое осаждение называют зонным. Уравнение Стокса:
где ν – скорость осаждения частиц, м/с; ρ и ρж – плотность частиц и жидкости, Н/м3; μ – динамической вязкости жидкости, Па·сr – радиус частицы, м. Взвешенные вещества и взвесь, образующаяся в результате обработки воды, неоднородны. Такая взвесь называется полидисперсной, агрегативно неустойчивой. Исследуется экспериментальным путем, а уравнений для этих случаев не существует. Для реш задач проектирования отстойных сооруж изучают зависимость эффекта осаждения от времени T/H = t/h Т – необходимое время осаждения агрегативно устойчивой взвеси. Если частицы взвеси в процессе осаждения образуют агломераты: T = t(H/h)n. Где n – показатель степени, отражающий влияние агломерации. Для расчета зонного осаждения иногда используется понятие объемный индекс I – это объем осадка, занимаемый 1 г взвешенного вещества после 30 мин отстаивания. Фильтрование воды Фильтров наз проц прохождения осветляемой воды через слой фильтрующего материала. Фильтр, так же как и отстаивание, применяют для осветления воды, т. е. для задержания находящихся в воде взвешенных веществ. Если размеры частиц больше размеров пор фильтрующей загрузки, то частицы остаются на поверхности фильтра, такое фильтрование называется поверхностным. Если частицы проходят внутрь материала загрузки, то фильтрование объемное. Процесс поверхностного фильтрования подчиняется закону Дарси: v=kp, где k=1/μR (v-скорость фильтрования, р-напор, k-коэф пропорциональности, зависит от динамической вязкости μ и сопротивления среды R=Rн+Rос, Rн-начальное сопротивление фильтрующей основы, Rос - сопротивление образовавшегося слоя осадка Rос=rМ/F, r-удельное сопротивление осадка фильтрованию, М – масса отложившегося осадка, F – площадь фильтра). Следовательно скорость фильтрования тогда равна: v=p/(μ(rM/F+Rн)) При фильтров воды со взв в-вами через слой песка или другие зернистые материалы, т.е. при объемном фильтровании, наблюдаются след проц: извлечение взв частиц из воды и их закрепление на зернах фильтрующей загрузки под действием сил адгезии; отрыв части задержанных частиц от зерен загрузки и перенос их в послед слои, где они снова задерживаются в порах загрузочного материала. До тех пор пока интенсивность первого процесса прев интенсивность второго, происходит очистка воды от взвешенных частиц. Время, в течение которого слой загрузочного материала обеспеч очистку воды до требуемой концентрации, наз временем защитного действия загрузки t3 = 1 / K·b/a (x-X0/b) где К и X0 — константы, зависящие только от треб эффекта очистки и определяемые по номограммам Д.М. Минца; b/a и b — кинетич параметры процесса фильтрования, характеризующие соответственно скорость проникновения взвести в глубь загрузки и интенсивность прилипания частиц к зернам загрузки. Продолжительность работы фильтра tH до момента достижения предельной потери напора определяется из выражения: tH =[(Hпр - H0)i0]x/H0T где H0 и Hпр- соответственно нач и предельно доп потеря напора в. за грузке фильтра; i0 -темп прироста потери напора; х- толщина слоя загрузки. Отношение t3/tH характ надежность работы фильтра и при t3/tHl гарантирует высокое кач фильтрата. Чем больше это отношение, тем выше степень санитарной надежности фильтра. Флотация и электрофлотация Флотация (всплывание) основана на разности удельных масс взв частиц (или капель жидкости) и жидкости, в которой они суспензированы. Флотация осуществима в том случае, если примеси способны образ комплекс "частица—воздух" с плотностью, меньшей плотности воды. В рез. действия сил всплывания, гравитации и сопротивления комплексы "частица—воздух" флотируют и образуют концентриров слой на свободной поверхности жидк,откуда этот слой затем удаляется. Для осущ-ия флотации необходимо, чтобы сила слипания, т.е. адгезия пузырьков воздуха была выше смачиваемого действия воды нал примесью. Угол смачивания тем меньше. Чем меньше угол смачивания тем лучше происходит адгезия частиц с воздухом. Флотацию различают по сп-бу насыщения газом жидкости: Пена, напорная, эдектрофлотация. . 42. Коагуляция - объединение частиц дисперсной фазы в агрегаты вследствие сцепления (адгезии) частиц при их соударениях. Колл примеси возникают в результате алюмо-кремниевых кислот и солей, являющимися основным компонентом глины. Колл частицы образуются отрицательно заряж ионами (имеют отриц.заряд). При ум pH устойчивость коллоидов снижается и наоборот. Если вода очень жесткая, то колл частицы могут иметь полож заряд.Метод обработки воды, направл на удаление в-в, находящихся в коллоидном состоянии, с помощью хим.реагентов, наз коагулированием. Применяющиеся при этом хим.в-ва наз коагулянтами. Метод применяется для осветления и обесцвечивания воды. При коагулировании наряду с коллоидными примесями удаляются грубодисперсные в-ва, а также бактерии и вирусы.В качестве коагулянтов чаще всего используют соли алюминия и железа: сульфат алюминия Al2(SO4)3·18H2O, алюминат натрия NaAlO2, сульфат железа (II) FeSO4·7H2O (железный купорос), хлорид железа (III) FeCl3·6H2O. .Осн фактором скорости коагулирования явл.стадия хлопьеобразования. Чем быстрее растут хлопья, тем быстрее идет осаждение, тем выше степень осветления воды. На проц коагуляции влияет t воды (при ум t устойчивость колл увелич), pH и солевой состав. Озонирование . Озон представляет собой аллотропическое видоизменение кислорода, при обычных условиях газообразное вещество голубоватого цвета, в жидком – тёмно синее, в твёрдом – почти чёрное.Озон – один из наиболее сильных окислителей. Он уничтожает бактерии, споры и вирусы.Преимущества озона: одновременно с обеззараж действием происх обесцвечивание воды; устраняются привкусы и запахи; улучшается вкус воды; воды насыщается кислородом.Озон получают при действии на кислород «тихого» электричтока в аппаратах озонаторах, при напряжении более 10 кВт.Озон получают непосредственно на очистных сооружениях, после чего озоновоздушную смесь растворяют в воде и порциями добавляют в обрабатываемую воду. Бактерицидное действие связано с реакциями окисления. В реакции участвуют свободные радикалы, образовавшиеся при разложении озона. Недостатки: высокая стоимость; образование токсичных побочных продуктов; низкая растворимость и высокая взрывоопасность озона; высокая коррозионная активность; возможна новая волна микроорганизмов при неполном окислении органических веществ. Единицы измерения жесткости Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л). Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности. В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы -градусы жёсткости. Удаление кремниевой кислоты Достаточно часто для удаления соединений кремния из воды использ такой доступный и дешевый продукт, как гашеная известь. Этот реагент, представляющий собой сильное основание – Са(ОН)2, взаимодействует с кремниевой кислотой, в результате чего происходит образование нерастворимого силиката кальция. Практика показывает, что введение в воду гашеной извести позволяет снизить содерж примесей кремния до 0,3–0,5 мг/л.Другим распростр способом, позволяющим снизить содерж примесей кремния, является обработка воды магнезитом.. Аналогичные химичпроц протекают и при обработке воды обожженным доломитом – CaMg(CO3)2. После прокаливания этот минерал превращается в смесь оксидов кальция и магния, которые, взаимод с водой, превращаются в соответствующие гидроокиси, реагирующие с кислотным остатком кремниевой кислоты. В ряде случаев удаление соединений кремния проводится на стадии осветления и обесцвечивания.. Удаление из воды соединения кремния может осущ также с помощью мембранного метода, имеющего, однако, существенный недостаток. Как показали исследования по обессоливанию воды с высокой минерализацией, на поверхности мембраны происходит полимеризация соединений кремния, переход их в коллоидное состояние. 65.Обесфторирование и фторирование воды.Обесфторивание -метод удаления фтора из воды.Об.природных вод производят методами фильтрации, осаждения, гиперфильтрации, ионного обмена. Метод фильтр основан на обменной адсорбции ионов при пропуске обесфториваемой воды, содержащей не более 8 мг/л взвеси и общее количество солей до 1000 мг/л, через сорбент - активированную окись алюминия. Обесфтор воды происх в результате обменной адсорбции анионов фтора и сульфат-иона. Этот метод прим при обработке поверхн вод, когда кроме обесфторивания треб еще осветление и обесцвечивание, а также для обработки подземных вод при необходимости их одновременного реагентного умягчения и обесфторивания. Удаление фтора из воды с помощью трикальцийфосфата.. ФТОРИРОВАНИЕ ВОДЫ - добавление в нее фтора в виде порошков, гранул или растворов фторсодержащих соединений, таких, как кремнефтористый или фтористый натрий, кремне-фтористый аммоний, кремнефтористая и фтористоводородная кислота, фтористый калий или алюминий при концентрации его в исходной воде менее 0,5 мг/л Оптим. содержание фтора в питьевой воде 0,8—1,2 мг/л. Фтораторные установки могут дозировать фторсодержащие реагенты в сухом и жидком видах. 66.Углекислота и ее формы. При химичанализе различают углекислоту: 1) общую; 2) гидрокарбонатную; 3) карбонатную; 4) свободную; 5) равновесную и 6) агрессивную. Нейтрализация сточных вод Нейтр. Сточные воды, содерж кислоты или щелочи, перед сбросом в водоемы или перед технологич использованием подвергаются нейтрализации. Практически нейтрал считаются воды, имеющие рН 6,5 – 8,5. Для нейтрализации кислых стоков используют щелочи, для нейтрализации щелочных – кислоты. Нейтрализ можно проводить различными путями: смешением кислых и щелочных сточных вод, добавлением реагентов, фильтрованием через нейтрализующие материалы 80.Радиац очистка сточных вод от органических загрязнений. Радиолизом водных растворов наз преобразование раств о ренныхвеществ вследствие поглощения энергии ионизирующего излучения. Химичизменения в системах происходят за счет поглощения энергии. Резэтого процесса являются ионизация ивозбуждение молекул воды, приводящие впоследствии к образованию химичактивных частиц — радикалов. В разбавленных р-рах, в которых ионизирующее излучение полностью поглощается водой, такими частицами могут быть атомы водорода Н, гидратированные электроныеГидр, радикалы ОН*. Колич энергии, поглощенное системой, наздозой кот выраж в радах или электрон-вольтах. Радиационно-химич процесс характеризуется выходом продукта G, т. е. колич преобразов частиц при поглощении 100 эВ энергии ионизирующего излучения.Механизм радиац способа очистки промышл сточных вод зависит от концентрации растворенных веществ. Например, при не очень высокой концентрации загрязнений радиационно-химичпревращения органических в-в протекают через реакции образования радикалов Н. С этими активными частицами загрязнители могут вступать в реакции окисления, восстановл, присоед, отщепления атомов или целых групп и т. д.Процесс очистки при высоких концентрациях загрязнителя становится экономически невыгодным, поскольку он требует слишком больших затрат энергии излучения.Радиацочистка является быстрым одностадийным процессом, дает комплексный эффект. Преимущество заключается в комплексном действии излучения, ускоряется коагуляция и седиментация, устраняются цветность и запах, снижаются величины ХПК и БПК, происходит дезинфекция воды. Конечными продуктами разложения загрязнений являются простые экологически безвредные соединения. 81.Химич очистка сточных вод Очистка сточных вод — это разрушение или удаление из них загрязняющих веществ, обеззараж и удаление патогенных организмов. Прим для выделения из сточных вод растворимых неорганических примесей. Для химич очистки произв сточных вод в настоящее время использ разл реагенты. Наибольшее применение имеют: окислители — хлор, перманганат калия, озон; подщелачивающие вещества — известь, гидроксид натрия, сода; подкисляющие вещества — серная и соляная кислоты.Например, сточные воды, содержащие соли хрома (VI), образовывают гидросульфитом NaHSO3, сульфитом NaSO3 или сульфатом железа FeSO4 в щелочной среде с последующим удалением осадка гидроокиси хрома Cr(OH)3Процесс окисления фенолов и других орган.в-в кислородом воздуха в присутствии катализаторов также можно отнести к хим очистке сточных вод.В случае пром ст вод химическое осаждение применяется и как самост способ очистки, и как предварительная ступень перед биологич очисткой.хим добавки приводят к обесцвечиванию, осветлению и образованию шлама.
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 240; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.93.221 (0.133 с.) |
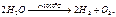








 – неустойчивы,при повышении температуры разлагаются.
– неустойчивы,при повышении температуры разлагаются.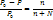
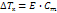


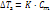




 – степ диссоциации, k – кол-во ионов, образ-хся при диссоциации
– степ диссоциации, k – кол-во ионов, образ-хся при диссоциации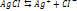


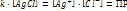
 – постоянная при данной температуре
– постоянная при данной температуре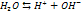




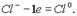





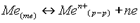

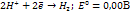





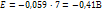
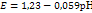 (при рН=7)
(при рН=7) 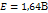

 - изменение поверхн натяжения р-ра с концентрацией; R — газовая постоянная, равная 8,314·107 эрг/град·моль; Т—абсолютная температура, К; σ — поверхностное натяжение, эрг/см2.
- изменение поверхн натяжения р-ра с концентрацией; R — газовая постоянная, равная 8,314·107 эрг/град·моль; Т—абсолютная температура, К; σ — поверхностное натяжение, эрг/см2.