
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Щелочные нецианистые (цинкатные) электролиты
Основными компонентами цинкатных электролитов являются комплексная соль цинка Na2Zn(OH)4 или K2Zn(OH)4 и свободная щелочь NaOH или КОН. Цинкатный электролит готовят растворением свежеприготовленного гидроксида или оксида цинка в горячем щелочном растворе (1.4.1.2)
В отсутствие специальных добавок из этих электролитов на катоде выделяются губчатые осадки цинка даже при малых плотностях тока. Добавление к цинкатному раствору 0,25 - 0,5 г/л олова, до 0,05 г/л свинца и следов ртути, а также 0,005-0,01 г/л солей мышьяка, сурьмы и селена полностью устраняет местное образование цинковой губки и позволяет получать компактные осадки цинка. Такой электролитиспользовали для цинкования деталей во вращающихся барабанах. Однако вследствие малой допустимой плотности тока на катоде он не получил затем большого распространения. Позднее было показано, что при некоторых режимах периодического изменения направления (реверсия) и пульсации постоянного тока из цинкатных электролитов могут быть получены компактные блестящие осадки цинка на катоде даже при отсутствии указанных добавок. Блестящие цинковые покрытия образуются только на тщательно отполированной поверхности стали, меди и других металлов после кратковременного (5-10 с) повышения в начале электролиза плотности тока ("толчка" тока) при переключении полярности. Блестящее цинковое покрытие (на полированной стали) из цинкатного электролита получается также при электролизе реверсированным током с толчком тока в начале электролиза. Окись цинка растворяется хуже, чем гидроокись, и для полного растворения ее предварительно смешивают с горячей щелочью, добавляя небольшое количество воды. После тщательного перемешивания получают концентрированный раствор, который затем разбавляют водой до нужной концентрации. Последняя зависит главным образом от сложности конфигурации покрываемого изделия: чем рельефнее покрываемая поверхность, тем ниже должна быть концентрация цинка, особенно при условии перемешивания электролита. Концентрация свободной щелочи, необходимой для обеспечения устойчивости комплексной соли цинка и нормального растворения цинковых анодов, должна быть тем больше, чем выше концентрация цинка.
На рассеивающую способность факторы влияют в обратном направлении. Наибольшее влияние на равномерность распределения металла по катодной поверхности оказывает концентрация цинка в электролите, при повышении которой рассеивающая способность ухудшается. Добавки солей олова, свинца и ртути практически не оказывают влияния на допустимый предел плотности тока и распределение металла. В качестве блескообразующих добавок к цинкатному электролиту предложены также ароматические альдегиды, поливиниловые спирты, полиалкиламины, алкиламины и продукты конденсации аминов с эпихлоргидрином или с окисью этилена. В цинкатном электролите всегда присутствуют углекислые соли за счет взаимодействия щелочи с двуокисью углерода воздуха [1]. Пирофосфатные электролиты Исходными компонентами для приготовления пирофосфатных электролитов могут быть ZnS04·7H2O, Zn (OH)2 или ZnO и пирофосфорнокислые соли натрия, калия и аммония. Пирофосфаты калия и аммония лучше растворяются в воде, чем пирофосфат натрия, из них можно готовить более концентрированные растворы, обладающие и большей электропроводностью. Однако эти соли менее доступны потребителям из-за ограниченного их производства. При введении сернокислого цинка в раствор пирофосфата калия или натрия образуется сначала осадок пирофосфата цинка, который затем растворяется в избытке пирофосфата щелочного металла с образованием комплексной соли. При действии пирофосфата калия или натрия в избытке на гидроокись или окись цинка образуется комплексная соль пирофосфата цинка. Состав пирофосфатных комплексов цинка зависит от значения рН и концентрации свободного пирофосфата в растворе. Процесс электроосаждения цинка из пирофосфатных растворов протекает при повышенной катодной поляризации, которая обусловлена как диффузионными ограничениями, так и торможением электродной реакции. Показано, что катодный процесс характеризуется сочетанием диффузионной поляризации и перенапряжения. Катодная поляризация возрастает при увеличении концентрации свободного пирофосфата щелочного металла, уменьшении концентрации цинка и температуры электролита, но снижается при возрастании значения рН.
Положительное влияние на качество катодных осадков и кинетику катодного процесса в пирофосфатных электролитах оказывают органические вещества. Цинковые аноды плохо растворяются в пирофосфатных электролитах вследствие пассивирования [1]. Аммиакатные электролиты Аммиакатный электролит цинкования получают растворением окиси или гидроокиси цинка в избытке хлористого или сернокислого аммония по уравнению реакции (1.4.1.3)
ZnO + 2NH4C1 = Zn (NH3) 2Cl2 + Н2О Zn(OH)2 + 2NH4C1 = Zn (NH3) 2Cl2 + 2H2O (1.4.1.3)
Показано, что содержание цинка в насыщенном растворе NH4C1 зависит от рН среды. Минимальная растворимость ZnO соответствует нейтральной области в пределах рН = 6,3-7. При более высоком и более низком значениях рН растворимость резко возрастает. Твердая фаза, содержащая цинк, находится в равновесии с насыщенным раствором NH4C1 в нейтральной области, она представляет собой комплексное соединение Zn (NH3)2Cl2. При добавлении NH4OH увеличивается рН и число связанных в комплексе молекул аммиака (лигандов); в этих условиях образуются другие, по-видимому, более растворимые комплексные соединения: Zn (NH3)3Cl2, Zn(NH3)4Cl2. Наряду с этим образуются также и соединения типа Zn (NH3)n(OH)2, особенно, если значение рН повышают добавлением щелочи (КОН или NaOH). При большой концентрации аммиака в водном растворе цинк образует устойчивые тетра-амин-ионы. При введении ZnO в насыщенный раствор сернокислого аммония образуются соответствующие комплексные соединения типа Zn (NH3) nSO4, растворимость которых при рН>7 также резко возрастает. При уменьшении рН растворимость такой комплексной соли, наоборот, снижается почти до нуля и выпадает осадок труднорастворимой соли. Подобные соединения образуются также и при взаимодействии ZnO с уксуснокислым аммонием. Исследования кинетики электродных процессов (катод - амальгама цинка) в аммиачных растворах методом радиоактивных индикаторов в сочетании с электрохимическими измерениями показали, что стадией, определяющей скорость электродных процессов, является электрохимическая реакция. Поляризуемость катода и рассеивающая способность аммиакатных электролитов зависят от рН и концентрации компонентов. Наибольшие поляризуемость катода и рассеивающая способность аммиакатных электролитов соответствуют нейтральной области. При увеличении концентрации хлористого аммония (а также сернокислого аммония) поляризуемость катода и рассеивающая способность при низких плотностях тока в щелочной области несколько возрастает. Благоприятное влияние хлористого аммония на рассеивающую способность сказывается также вследствие увеличения электропроводности. Аммиакатные электролиты обладают хорошими буферными свойствами благодаря образованию у катода слабо диссоциированного основания гидроокиси аммония. С целью улучшения структуры осадков в аммиакатные электролиты рекомендуют вводить поверхностно-активные вещества (клей, желатин, декстрин, тиомочевину, фурфурол, диспергатор НФА, ОС-20 и др.). При совместном присутствии ОС-20 и НФА образуются мелкозернистые полублестящие осадки цинка. Температура аммиакатных электролитов от 18 до 40 °С. Катодная и анодная плотности тока до (1,5-4) – 102А/м2. Аноды изготовляют из чистого цинка. Выходы по току на катоде и аноде в рабочем интервале плотностей тока составляют 90-100%.
|
||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 389; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.140.108 (0.007 с.) |
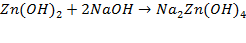 (1.4.1.2)
(1.4.1.2)


