
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Простое вещество состоит из атомов только одного вида или из молекул, построенных из атомов одного вида.
Сложное вещество состоит из молекул, построенных из атомов разных видов. Смесью называется вещество, состоящее из молекул (или атомов) двух или нескольких веществ. Вещества, составляющие смесь, могут быть простыми и сложными. На Земле пока никто не смог написать такой книги, в которой были бы описаны абсолютно все известные человечеству вещества - от "а" до "я". Впрочем, в этом нет особой необходимости. Чтобы знать химию, не нужно заучивать названия или сведения об огромном количестве веществ - достаточно знать законы, по которым они образуются и взаимодействуют с другими веществами. Посмотрите простой опыт из "Единой коллекции цифровых образовательных ресурсов", с помощью которого можно приблизительно определить состав воздуха. Опыт легко проделать даже в домашних условиях. Задачи. 1.7. Представьте, что у вас в руках волшебная палочка и вы превращаете: а) камень в песок; б) кислород в озон; в) лед в пар. В каком случае вы проводите химические превращения? 1.8. Найдите простые вещества среди перечисленных веществ: воздух, вода, озон, мед, морская вода, кислород, азот. 1.9. Из перечисленных веществ два являются смесями. Найдите их: а) кислород, б) озон, в) вода в реке, г) вода в облаке, д) поваренная соль, е) воздух, ж) сахар. Смеси. Разделение смесей. Абсолютно чистое вещество, не содержащее примесей других молекул, получить чрезвычайно трудно. Поэтому на практике чистым называют вещество, состоящее из молекул одного вида, в котором других молекул настолько мало, что они не влияют на его свойства. ** Например, воду из родника мы считаем вполне чистой и пригодной для питья, потому что мельчайшие примеси в ней для нас просто неощутимы. Но для некоторых научных и технических целей такая вода совершенно непригодна. Например, в замкнутых контурах атомных электростанций нужна еще более чистая вода, иначе трубы, по которым она циркулирует, быстро выйдут из строя. Но иногда бывает нужна еще более чистая вода! Для получения и хранения такой сверхчистой воды даже стеклянная посуда уже не подходит, потому что из стекла в воду попадают другие молекулы. Годится только кварцевая посуда, а над поверхностью воды не должно быть воздуха, потому что многие газообразные вещества (углекислый газ, азот, кислород) растворимы в воде и "загрязняют" ее.
Реальные вещества всегда содержат какие-то примеси. Даже лекарственные вещества (например, аспирин - рис. 1-2), к чистоте которых предъявляются особые требования, Рис. 1-2. Модель молекулы аспирина (ацетилсалициловой кислоты) C9H8O4. Серые шары - атомы углерода, белые - водорода, красные - кислорода. Не нужно думать, что чистые вещества абсолютно во всех случаях лучше смесей. Например, нельзя дышать чистым кислородом. Если бы из атмосферы вдруг по каким-то причинам исчез азот, “разбавляющий” кислород до безопасного уровня, все живые организмы на суше погибли бы в течение нескольких часов, а растительность на всех континентах была бы полностью уничтожена чудовищным пожаром Многие лекарства являются смесями. Провизоры в аптеках приготовляют из чистых лекарственных веществ микстуры, что в переводе с латинского означает именно смеси. Особым случаям смесей являются растворы. Если смесь глины с песком можно на глаз отличить от песка и глины, то растворив поваренную соль в воде, мы получим прозрачную жидкость, по внешнему виду неотличимую от воды. Однако в этой смеси частицы, составлявшие ранее кристаллы соли, равномерно распределены в толще молекул растворителя (воды). Если позволить воде испаряться, то соль выпадет на дно сосуда в виде тех же кристаллов. Химического превращения не происходит - соль и вода остаются самими собой. ** Если даже лекарства не бывают абсолютно чистыми, то что же тогда можно называть (в широком смысле) чистым веществом, а что - смесью? К счастью, есть такие физические свойства вещества, которые перестают изменяться после того, как количество примесей уменьшается до определенного предела. Для очень многих целей вещество с такими неизменными свойствами можно считать чистым. Эти физические свойства - точка плавления и точка кипения. Если плавление образца какого-нибудь вещества не растягивается на несколько градусов, а происходит в пределах одного градуса - то такое вещество химик обычно называет чистым. Если вещество кипит при одной температуре, которая не изменяется по мере испарения образца - то это тоже, скорее всего, чистое вещество. Конечно, из этих правил бывают исключения, поэтому окончательный вывод о чистоте вещества можно сделать только на основании анализа. Что такое химический анализ - об этом мы поговорим позже.
Как же выделяют чистые вещества из смесей? Для этого существует несколько способов. Опишем некоторые из них. Чтобы задача выглядела полезной с практической точки зрения, рассмотрим очистку воды. Допустим, в нашем рапоряжении есть около полулитра загрязненной воды. В любом населенном пункте найти такую воду - не проблема (можно взять воду из лужи или пруда). Приступим к ее очистке сначала простыми, а потом все более сложными методами. 1. ОТСТАИВАНИЕ. а) Нальем грязную воду в химический стакан и дадим спокойно постоять:
б) Тот же стакан через 30 минут. Наиболее крупные частицы примесей осели на дно. Жидкость в верхней части стакана стала светлее. Если на поверхности имеется тонкая радужная пленка - значит, вода загрязнена не только частичками почвы, ила, но и нефтепродуктами:
2. ФИЛЬТРОВАНИЕ. Осторожно сольем жидкость с осадка в воронку, в которую вставлен фильтр из пористой бумаги. Воронка находится в другом сосуде, в котором скапливается уже гораздо более чистая вода. На фильтре оcтаются мелкие частицы примесей. Полученная вода еще не пригодна для питья, так как в ней содержатся бактерии, а также растворенные органические вещества и соли. Но полученная нами вода уже вполне пригодна для того, чтобы помыть доску или полить цветок:
. ПЕРЕГОНКА или ДИСТИЛЛЯЦИЯ. Соберем прибор, показанный на рисунке, перельем загрязненную воду в перегонную колбу, поместим туда же кипелки (мелкие кусочки фарфора или кирпича, которые нужны для спокойного кипения жидкости), включим стеклянный холодильник (охлаждается водопроводной водой) и нагреем жидкость в колбе до кипения. Вода превращается в пар, который через стеклянную насадку попадает в холодильник и конденсируется. Термометр в верхней части колбы должен показывать 100 градусов - температуру кипения воды. Первые 1-2 мл дистиллята следует отбросить, потому что в воде могут находиться примеси легких нефтепродуктов (бензина). Когда перегонка подходит к концу, следует быть внимательным и оставить немного жидкости в колбе, чтобы не перегонялись другие, более высококипящие примеси (следы тяжелых нефтепродуктов). Остаток в колбе содержит все ранее растворенные в воде соли, остатки механических загрязнений и выглядит не очень привлекательно. Зато воду, собранную на выходе из прибора, можно безбоязненно пить.
А так лабораторная установка для перегонки выглядит на фотографии:
** С помощью перегонки можно очищать не только воду, но и другие жидкости. Если это летучие, пахучие, боящиеся влаги или токсичные жидкости (а таких немало среди органических веществ), то обязательно используют закрытый приемник (как на верхней схеме), а аллонж соединяют с атмосферой через специальную защитную трубку с подходящим наполнителем. Установку собирают не на лабораторном столе, а в вытяжном шкафу. По показаниям термометра во время перегонки можно судить о том, какая именно жидкость перегоняется в данный момент. Таким образом, не только неоднородные смеси (вода с частицами почвы), но и однородные смеси (растворы) могут быть разделены с помощью перегонки. Отстаиванием и фильтрованием однородные смеси (растворы) разделить невозможно.
|
||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 361; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.99.7 (0.007 с.) |
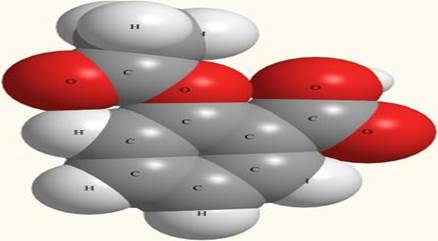 всегда содержат незначительные примеси других веществ. Но этих примесей так мало, что наш организм их просто не замечает. В то же время лекарство с истекшим сроком годности может стать неактивным или даже оказать побочное действие, поскольку количество примесей в нем накопилось выше определенного предела.
всегда содержат незначительные примеси других веществ. Но этих примесей так мало, что наш организм их просто не замечает. В то же время лекарство с истекшим сроком годности может стать неактивным или даже оказать побочное действие, поскольку количество примесей в нем накопилось выше определенного предела.







