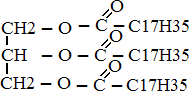Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Применение уксусной кислоты: получение лекарств, ацетатного шёлка, солей, фруктовых эссенций, растворителей для лаков, киноплёнки, красителей для тканей, стимуляторов роста растений.
Задача. № 12. Решение. Запишем уравнение реакции и условие задачи в формульном виде: BaO + H2SO4 = BaSO4 + H2O m(BaSO4) = 100 г; M(BaSO4) = 233 г/моль n(BaO) =? n(H2SO4) =? В соответствии с коэффициентами уравнения реакции, которые в нашем случае все равны 1, для получения заданного количества BaSO4 требуются: n(BaO) = n(BaSO4) = m(BaSO4) / M(BaSO4) = 100: 233 [г: (г/моль)] = 0,43 моль n(H2SO4) = n(BaSO4) = m(BaSO4) / M(BaSO4) = 100: 233 [г: (г/моль)] = 0,43 моль Ответ. Для получения 100 г сульфата бария требуются 0,43 моль оксида бария и 0,43 моль серной кислоты. Билет № 13. 1. Соли. Краткая характеристика. Химические свойства солей 2. Жиры. Физические и химические свойства. Применение. 3. Задача. № 13. Прежде чем вылить в канализацию жидкие отходы лабораторных работ, содержащие соляную кислоту, полагается их нейтрализовать щелочью (например, гидроксидом натрия) или содой (карбонатом натрия). Определите массы NaOH и Na2CO3, необходимые для нейтрализации отходов, содержащих 0,45 моль HCl. Какой объем газа (при н.у.) выделится при нейтрализации указанного количества отходов содой?
Соли. Краткая характеристика. Химические свойства солей. Соли делятся на три типа: нормальные (средние), кислые, осно,вные. Существуют и другие типы солей. Нормальные (средние) соли – это продукты полного замещения атомов водорода в молекуле кислоты атомами металла, или продукты полного замещения гидроксильных групп в молекуле основания кислотными остатками.
В молекуле нормальной соли сумма валентностей атомов металла равна сумме валентностей кислотных остатков. Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла. Двухосновная кислота с любым металлом образует одну нормальную и одну кислую соль. Трёхосновная соль с любым металлом образует одну нормальную и две кислые соли. Приставка ди- используется, если в молекуле кислой соли с одним кислотным остатком связаны два атома водорода. Например: KH2PO4 – дигидрофосфат калия, Ca(H2PO4)2 – дигидрофосфат кальция. Основные соли – это продукт неполного замещения гидроксильных групп в молекулах многокислотных оснований кислотными остатками.
2. Жиры – это сложные эфиры глицерина и высших карбоновых кислот.
глицерин карб. к-ты триглицерид (жир) Физические свойства Жиры образованные предельными кислотами – твёрдые (животные (кроме рыбьего), жиры образованные непредельными – жидкие. Химические свойства 1. Гидролиз
глицерин карбоновые кислоты 2. Взаимодействие со щелочами
натриевая соль карбоновых кислот 3. Гидрирование Подвергаются жиры образованные непредельными кислотами.
триглицеридолеиновая триглицеридстеориновая кислота кислота Реакция используется для получения маргарина.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 229; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.100.42 (0.004 с.) |

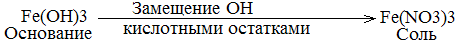

 +3HOH à
+3HOH à  +
+ 

 + 3H2 à
+ 3H2 à