Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие скорости химической реакции
Скорость реакции – скорость химического превращения исходных(ого) вещества в продукт(ы) реакции. Скорость химической реакции определяется числом элементарных актов химического взаимодействия, происходящих в единицу времени в единице объёма в гомогенной системе или на единице площади поверхности раздела фаз гетерогенной системах. Рассмотрим использованные в приведённом определении термины. Система – это совокупность элементов (веществ, тел, объектов природы), фактически или мысленно выделяемых из окружающего пространства (например воздух – фактически выделяемое вещество, а составляющие его азот и кислород – мысленно). Различают физические, технические, химические, биологические, экологические или какие-либо другие системы. Химическая система – это вещество (или совокупность веществ), между частями которого (или между которыми) происходят или могут происходить взаимодействия с образованием других веществ. Гомогенная система (от греч. homogenes – однородный)состоит из одного или нескольких веществ, не разделённых поверхностями раздела, то есть находящимися в одной фазе. Примерами гомогенных систем могут служить газовые смеси или растворы (например раствор поваренной соли или сахара в воде). В каждом из этих случаев система состоит из одной фазы: газа или жидкости. Гетерогенная система (от греч. heteros – другой, иной, неоднородный)– состоит из нескольких фаз. Примеры двухфазных систем: жидкая вода и лёд, вода и бензин или ртуть, насыщенный раствор какого-либо вещества с его осадком. Фазой называется часть гетерогенной системы, отличающаяся по своим свойствам (физическим, химическим) от других частей системы и ограниченная поверхностью раздела, при переходе через которую свойства системы резко меняются – скачком. Если химическая реакция протекает в гомогенной системе, то она осуществляется во всём её объёме и называется гомогенной.
Например:
Если химическая реакция осуществляется между веществами, образующими гетерогенную систему, то она протекает только на поверхности (границе) раздела фаз, образующих эту систему.
Например:
Одним из основных параметров химических реакций является скорость, с которой они протекают. Средняя скорость гомогенной химической реакции измеряется изменением концентрации какого-либо исходящего вещества (реагента) или продукта реакции за данный промежуток времени. Для количественной характеристики скорости реакции используют скорость изменения количества вещества в единице объёма. Если за время Δt в объёме V образовалось Δn молей продукта, то среднюю скорость реакции можно определить по формуле:
Когда реакция осуществляется при неизменном объёме, её скорость обычно выражают через изменения молярной концентрации (c = n / V) любого из исходных веществ или её продуктов:
где υгомо – скорость реакции в гомогенной системе; υгетеро – скорость реакции в гетерогенной системе; с 1 и с 2 – молярная концентрация вещества-участника реакции соответственно в момент времени t1 и t2 · моль/л; ∆t – промежуток времени, с; S – площадь поверхности соприкосновения реагирующих веществ, (м2, см2).
Поскольку скорость химической реакции не может быть величиной отрицательной, перед дробью, характеризующей уменьшение концентрации исходного вещества во времени (∆ с < 0), ставится знак «–», а в случае продукта реакции, концентрация которого увеличивается (∆ с > 0), ставится знак «+» (Рис. 1).
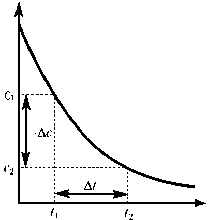 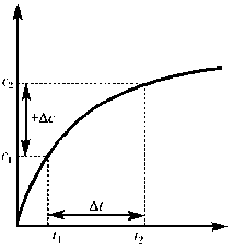
а б Рис. 1. Зависимость концентрации исходного вещества (а) и продукта реакции (б) от времени Мгновенная (истинная) скорость характеризует скорость химической реакции в данный момент времени. Она определяется как предел, к которому стремиться средняя скорость при Δ t → 0, то есть как первая производная от концентрации какого-либо вещества-участника реакции по времени и равна тангенсу угла наклона (α) касательной к кривой с = f (t) в точке, соответствующей времени ti (рис. 2):
Кривые на рис. 1,2 определяются совокупностью точек величинами истиной скорости
В начале химической реакции её скорость является наибольшей, поскольку концентрация исходных веществ максимальная (поэтому кинетические кривые, выражающие зависимость концентрации реагента или продукта реакции от времени, на этом участке рис 1 а, б наиболее крутые).
Рис. Чем выше концентрация соляной кислоты, тем быстрее протеакет химическое растворение и ней металлического цинка Для определения концентрации реагирующих веществ в разные моменты времени используют различные методы – химические и физические с образованием газа, как взаимодействие карбоната кальция (мела) с уксусной кислотой: CaCO3 + 2CH3COOH = (CH3COO)2Ca + CO2↑ + H2O, то за ней удобно наблюдать, измеряя объём выделившегося газа (рис.). Когда в реакции участвует окрашенное вещество, за её течением можно следить по изменению интенсивности окраски с помощью колориметров (от лат. color – цвет и греч. metro - мерю).

Впервые скорость реакции и её зависимость от концентрации исходных веществ исследовал в 1850 г. немецкий химик Людвиг Фердинанд Вильгельми (1812-1864), который изучал кислотнокатализируемый гидролиз сахарозы. Для определения концентрации реагентов в разные моменты времени используют различные химические и физические методы. Например, если химическая реакция проходит с образованием газа, как растворение мела в уксусной кислоте: CaCO3 + 2CH3COOH = (CH3COO)2Ca + CO2↑ + H2O, то за ней удобно наблюдать, измеряя объём выделившегося углекислого газа. Когда в реакции участвует окрашенное вещество, за её течением можно следить по изменению интенсивности окраски с помощью колориметров, спектрофотометров и других спектральных приборов. Средняя скорость химической реакции – величина приближённая. Мгновенная скорость реакции является более объективной характеристикой, однако и она не удобна для сравнения скоростей реакций в следствие её изменяемости во времени. Поэтому как средняя, так и мгновенная скорость не может служить кинетическим параметром химической реакции, каковым является её константа (раздел 2.2). Каждая химическая реакция протекает по определённому механизму, характеризующему её путь, то есть характер последовательности элементарных актов химического взаимодействия веществ. По механизму химические реакции подразделяются на простые и сложные.
Простые химические реакции состоят из однотипных элементарных актов, то есть протекают в одну стадию.
Уравнение простой химической реакции показывает, какие частицы (атомы, молекулы, ионы, радикалы) и в каком соотношении участвуют в её элементарном акте.
Например:
а) Хе + F2 = XeF2; б) О2 + О = О3; в) Н+ + ОН– = Н2О; г) CH4 + Cl·→·CH3 + HCl
Большинство химических реакций осуществляются не в одну, а в несколько стадий. Это связано с тем, что одновременно сталкиваются друг с другом могут только две (редко – три) частицы, в то время как во многих реакциях участвует большее число реагентов. Сложные химические реакции − это реакции, при протекании которых осуществляются разнотипные элементарные акты, то есть реакции протекают в несколько стадий, каждая их которых является простой.
Совокупность и последовательность стадий сложной химической реакции представляет собой механизм реакции. Уравнение сложной химической реакции отражает количественную характеристику процесса в целом и не учитывает, какие частицы и в каком соотношении участвуют в отдельных его стадиях.
Стадии сложных реакций могут осуществляться:
В соответствии с этим сложные реакции подразделяют на последовательные, параллельные, последовательно-параллельные и циклические. Большинство, например, биохимических реакций являются последовательно-параллельными и циклическими процессами. Многие химические реакции [например крекинг (расщепление) углеводородов, хлорирование и окисление органических соединений, радикальная полимеризация, имеют цепной – радикальный характер. К таким реакциям неприменимы обычные закономерности химической кинетики. Для них характерны три основные стадии: зарождение, развитие и обрыв цепи. На стадии зарождения цепи происходит образование промежуточных активных частиц под воздействием энергии (температуры, света, радиоактивного излучения или механического воздействия, например, удара или трения). Роль активных частиц могут выполнять электронейтральные атомы, возбуждённые молекулы, ионы и радикалы[3]. На стадии развития цепи активные частицы, вступая в химическое взаимодействие с молекулами исходного вещества, вызывают появление других активных частиц. При этом реакции могут осуществляться:
а) без разветвления цепи, когда одна активная частица вызывает появление только одной активной частицы (• → • → • → • → •); б) с разветвлением цепи, когда одна активная частица вызывает появление двух и более активных частиц •
Большинство сложных реакций являются последовательными. Кинетические кривые зая реакции из двух стадий показаны на рис.. В последовательных реакциях скорость образования конечного продукта не равна скорости исчезновения исходного вещества. Конечный продукт образуется со скоростью, диктуемой самой медленной стадией реакции.
Рис. 2. Изменение концентраций в последовательной реакции А→В→Р
Кривая А соответствует убыванию концентрации исходного вещества. Концентрация промежуточного вещества В проходит через максимум, так как вначале оно накапливается, а потом исчезает. Кривая Р характеризует накопление продукта реакции.
Стадия развития цепи, повторяясь многократно, приводит к образованию множества промежуточных активных частиц и продуктов реакции.
Например:
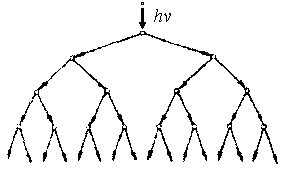
На стадии обрыва цепи происходит расходование активных частиц за счёт их взаимодействия друг с другом с образованием продуктов реакии или исходных веществ[4]. Обрыв цепей происходит, и когда активные атомы реагируют с молекулами примеси, либо «принимают» к стенке сосуда. В начале процесса, когда концентрация активных частиц во много раз меньше концентрации исходных веществ, преобладают стадии развития цепи. Скорость цепной разветвлённой реакции на этой стадии резко возрастает, так как одна активная частица способствует образованию до 104–106 молекул продуктов реакции. В конце процесса, когда стадии обрыва цепи преобладают, скорость химической реакции резко снижается. По цепному механизму (рис. 3) развиваются процессы трения, горения, взрыва, фотохимические реакции, такие как, образование озона в атмосфере (3О2 2О3), свободно-радикальное окисление веществ в организме, а также процессы, возникающие под воздействием радиационного облучения.
Рис. 3. Механизм цепного процесса подобен эффекту домино, зарождение, рост и обрыв цепи.
В сложных химических реакциях скорости отдельных стадий могут значительно отличаться. В этих случаях скорость реакции определяется скоростью наиболее медленной (лимитирующей) стадии.Поэтому при установлении механизма реакции, прежде всего, определяют кинетические характеристики этой стадии. Роль лимитирующей стадии в определении скорости химической реакции можно сравнить с движением множества автомобилей через туннель, в котором скорость всего потока определяется скоростью машины, движущейся с наименьшей скоростью. Одна из основных задач химической кинетики – управление скоростью реакции. "Полезные" реакции нужно заставить идти быстрее, а "вредные" – замедлить. Для этого надо знать, какие факторы влияют на их скорость.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 445; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.190.101 (0.039 с.) |
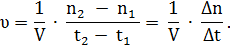
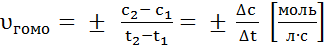 ;
; 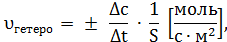
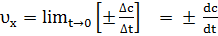 .
.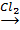 CH3Cl
CH3Cl