
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определить, какой объем 2 н раствора нитрата хрома (III) расходуется на взаимодействие с бромом массой 4,3 Г.
НОК ДМ
окисл-ль Br0 + e = Br- 3 6
3Br2 + 2Cr+3 = 6Br- + 2Cr+6
Переносим найденные коэффициенты в молекулярное уравнение. Уравниваем число ионов:
2Cr(NO3)3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KNO3 + 8H2O.
По закону эквивалентов: n эк(Cr(NO3)3) = n эк(Br2);
V р-ра
M эк(Br) =
V р-ра
V р-ра
Ответ: V р-ра 2. Найти массы воды и кристаллогидрата CrCl3∙6H2O, необходимые для приготовления 1 л раствора, содержащего 5 % (мас.) безводной соли. Плотность 5 % раствора CrCl3 равна 1,05 г.
Масса раствора равна
m р-ра = 1·103·1,05 =1050 г,
где 103 – коэффициент перевода литров в сантиметры кубические. Тогда масса CrCl3 в растворе составляет:
Масса CrCl3·6H2O, в которой содержится 52,5 г CrCl3, может быть найдена по пропорции
Тогда
Зная массу раствора и кристаллогидрата, определяем массу воды:
Ответ:
3. Написать уравнения, при помощи которых можно осуществить следующие превращения: K2CrO4 → CrO3 → Cr2O3 → KCrO2 → Cr2(SO4)3.
Решение
1. K2CrO4 + 2H2SO4конц = СrO3 + 2KHSO4 + H2O. t 2. 4СrO3 = 2Cr2O3 + 3O2. t 3. Cr2O3 + 2KOH = 2KCrO2 + H2O. 4. 2KCrO2 + 4H2SO4разб = K2SO4 + Cr2(SO4)3 + 4H2O.
МЕТАЛЛЫ VII ГРУППЫ УРОВЕНЬ А Написать сокращенную электронную формулу атома технеция и указать расположение валентных электронов по подуровням.
Ответ:
2. Определить степень окисления всех элементов в соединениях MnO2, Mn2(SO4)3, KMnO4.
+4 -2 +3 +6-2 +1+7 -2 Ответ: MnO2, Mn2(SO4)3, KMnO4. 3. Как изменяются кислотно-основные свойства оксидов технеция с увеличением его степени окисления в ряду Тс+4, Тс+6, Тс+7? Ответ: в указанном ряду с увеличением степени окисления технеция кислотные свойства оксидов усиливаются, а основные свойства ослабевают (TcO2, TcO3, Tc2O7). УРОВЕНЬ В 1. Уравнять реакцию методом электронного баланса. Указать окислитель и восстановитель:
FeCl2 + KMnO4 +HCl→FeCl3 + MnCl2+KCl + H2O.
окисл-ль Mn+7 + 5e = Mn+2 1
5Fe+2 + Mn+7 = 5Fe+3 + Mn+2
Переносим полученные коэффициенты в молекулярное уравнение и определяем необходимое количество молекул HCl для получения продуктов реакции. Уравниваем Н и О → 4Н2О.
5FeCl2 + KMnO4 + 8HCl = 5FeCl3 + MnCl2 + KCl + 4H2O. УРОВЕНЬ С Уравнять реакцию Na2S + KMnO4 + H2O → MnO2 + Na2SO4 + KOH.
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 226; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.183.117 (0.013 с.) |
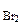 = 4,3 г
с эк(Cr(NO3)3) = 2 моль/л
= 4,3 г
с эк(Cr(NO3)3) = 2 моль/л
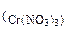 –?
–?



 →6
→6 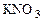 . Считаем число ионов К+ в продуктах реакции и определяем коэффициент перед
. Считаем число ионов К+ в продуктах реакции и определяем коэффициент перед  ;
; г/моль;
г/моль; ;
;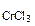 = 5%
ρр-ра= 1,05 г/см3
= 5%
ρр-ра= 1,05 г/см3
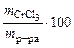 , %
откуда
, %
откуда 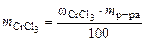

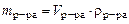 ,
,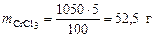 .
.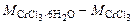 266 г/моль – 158 г/моль
266 г/моль – 158 г/моль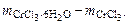
 – 52,5 г.
– 52,5 г. .
.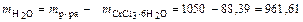 г.
г.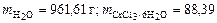 г
г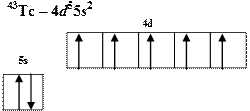
 НОК ДМ
НОК ДМ восст-ль Fe+2 – e = Fe+3 5
восст-ль Fe+2 – e = Fe+3 5



