
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные положения теории кислот и оснований Бренстеда- Лоури: молекулярные и ионные кислоты и основания, сопряженная протолитическая пара. амфолиты.
Теория Бренстеда-Лоури: кислотой называют всякое вещество, молекулярные частицы которого(в том числе и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют всякое вещество, молекулярные частицы которого(в том числе и ионы) способны присоединить протоны, т.е. быть акцептором протонов. Например:HNO3+H2O=H3O++NO3- Молекула и ион, отличающиеся по составу на один протон, называются сопряженной кислотно-основной парой. Частицы, способные к взаимодействию как с кислотами, так и с основаниями, называются амфолитами. Частицы, способные к взаимодействию как с кислотами, так и соснованиями, называются амфолитами.. Типичным примером амфолитов являются аминокислоты. Ионное произведение воды. Водородный показатель среды растворов. Математическое выражение рН, его значение в кислой, щелочной, нейтральной средах. Биологическая роль водородного показателя. Вода – слабый электролит, являющийся амфолитом, поэтому участвует в процессе автопротолиза. Автопротолиз воды – это процесс отдачи и присоединения протонов молекулами воды, являющейся амфолитом: Н2О+Н2О Ионное произведение воды, K w – величина, равная произведению активностей водород- игидроксид-ионов,постоянная при данной температуре: K w = а (Н+) а (ОН–)=10–14 моль2/л2 (Т = 298 К) Водородный показатель, рН – количественная характеристика кислотности среды, равная отрицательному десятичному логарифму активной концентрации ионов водорода: рН = –lg а (Н+)
Постоянство рН биологических жидкостей называется кислотноосновным гомеостазом. Система, поддерживающая протолитический гомеостаз, включает в себя физиологические механизмы (лѐгочную и почечную компенсации) и физико-химические:буферное действие, ионный обмен. В норме рН некоторых биологических жидкостей меняется в следующих диапазонах (табл. 8):
Основные положения теории кислот и оснований Льюиса. Понятие о жестких и мягких кислотах и основаниях (теория ЖМКО). Электронная теория Льюиса
Согласно теории Льюиса, кислотно-основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием новой связи. Кислоты Льюиса – акцепторы пары электронов, основания Льюиса – доноры пары электронов. Кислотами Льюиса могут быть молекулы, атомы или катионы, обладающие вакантной орбиталью и способные принимать пару электронов с образованием ковалентной связи. К кислотам Льюиса относятся галогениды элементов II и III групп периодической системы, галогениды других металлов, имеющих вакантные орбитали, протон. Кислоты Льюиса в реакциях участвуют в качестве электрофильных реагентов. Основаниями Льюиса являются молекулы, атомы или анионы, имеющие неподеленную пару электронов, которую они предоставляют для образования связи с вакантной орбиталью. К основаниям Льюиса относятся спирты, простые эфиры, амины, тиоспирты, тиоэфиры, а также соединения, имеющие p-связи. В реакциях основания Льюиса проявляют себя как нуклеофильные частицы. Развитие теории Льюиса привело к созданию принципа жестких и мягких кислот и оснований (принцип ЖМКО или принцип Пирсона). Согласно принципа Пирсона, кислоты и основания подразделяются на жесткие и мягкие. Жесткие кислоты – это кислоты Льюиса, донорные атомы которых малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. К ним относятся: протон, ионы металлов (К+, Na+, Mg2+, Ca2+, Al3+), AlCl3 и др. Мягкие кислоты - – это кислоты Льюиса, донорные атомы которых имеют большие размеры, большую поляризуемость, обладают малым положительным зарядом и низкой электроотрицательностью. К ним относятся: ионы металлов (Ag+, Cu+), галогены (Br2, I2), катионы Br+, I+ и др.
Жесткие основания – основания Льюиса, донорные атомы которых обладают высокой электроотрицательностью, низкой поляризуемостью, имеют малый радиус атома. К ним относятся: Н2О, ОН-, F-, Cl-, NO3-, ROH, NH3, RCOO- и др. Мягкие основания -основания Льюиса, донорные атомы которых обладают высокой поляризуемостью, низкой электроотрицательностью, имеют большой радиус атома. К ним относятся: Н-, I-, C2H4, C6H6, RS- и др. Суть принципа ЖМКО состоит в том, что жесткие кислоты реагируют с жесткими основаниями, мягкие кислоты – с мягкими основаниями
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 1093; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.66.13 (0.005 с.) |
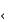 Н3О++ОН–
Н3О++ОН–


