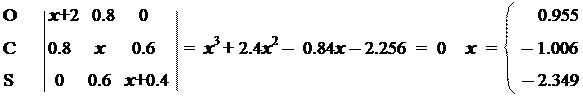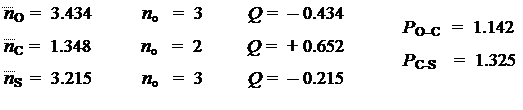Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Циклические полиены (аннулены).Стр 1 из 3Следующая ⇒
Метод МО Хюккеля Метод молекулярных орбиталей Хюккеля (МОХ) является одним из наиболее простых и полезных вариантов общего метода МО ЛКАО. В его основе лежит несколько приближений, позволяющих избежать вычислительных трудностей, характерных для полного варианта метода МО. Каждая МО в методе Хюккеля строится в виде линейной комбинации атомных орбиталей (ЛКАО): y i = С 1 × j 1 + С 2 × j 2 +... + Сn × j n где n — число атомов. Полный набор МО удобно задать в матричном виде:
Система уравнений Рутана для нахождения коэффициентов Сi m имеет вид:
где Fij — матричные элементы оператора Фока, Sij — интегралы перекрывания для данной пары атомов, e — орбитальная энергия. Основные проблемы метода МО, как известно, связаны с необходимостью процедуры самосогласования, включающей многократные вычисления интегралов типа F и S. В методе Хюккеля ни один из этих интегралов не вычисляется — они определяются на основании экспериментальных данных (спектральные, калориметрические и т.д.). Таким образом МОХ относится к большой группе т.н. полуэмпирических вариантов общего метода МО. Еще одно приближение метода Хюккеля заключается в том, что все диагональные интегралы Fii (оба индекса одинаковы), характеризующие некоторый атом (точнее, энергию электрона, локализованного на этом атоме), полагаются равными друг другу и поэтому обозначаются одним и тем же символом: Fii = Fjj = a (т.н. остовный интеграл). Другими словами, предполагается, что все атомы, входящие в состав молекулы, одинаковы по своей химической природе. Поэтому простой метод МОХ применяется почти исключительно для описания углеводородов типа полиенов и аренов. Существуют и усовершенствованные разновидности метода МОХ, позволяющие учесть различия в природе атомов гетероатомных молекул. Третье приближение сводится к тому, что недиагональные интегралы Fij разделяются на два типа. Первый тип относится к парам атомов, соединенными между собой химическими связями. Для таких пар атомов принимается следующее условие: Fij = b (т.н. резонансный интеграл). Второй тип относится к парам атомов, которые не связаны между собой химически; для них Fij = 0. Резонансный интеграл представляет собой поправку к полной энергии, обусловленную возможностью перехода электрона от атома j к атому i, и наоборот. Химически связанные атомы располагаются близко друг к другу и амплитуда обмена электронами для такой пары атомов велика. Напротив, химически несвязанные атомы практически не могут обмениваться электронами, и, следовательно, соответствующая поправка к энергии настолько мала, что ею можно пренебречь. Заметим, что разделение недиагональных интегралов Fij на два типа (нулевые и ненулевые) осуществляется не на основании квантовомеханических соображений, а исключительно на химической основе — по химической структурной формуле. Структура матрицы уравнений Рутана в методе Хюккеля определенным образом "приспосабливается" к топологии молекулы. Поэтому метод МОХ относится к классу т.н. топологических вариантов МО.
Четвертое приближение заключается в том, что интегралы перекрывания Sij также разделяются на два типа: диагональные интегралы приравниваются к 1, а недиагональные к 0:
Такой подход называется приближением нулевого дифференциального перекрывания (НДП). После сделанных приближений, матрица уравнения Рутана существенно упрощается — она уже не содержит интегралов (типа F mnи S mn), которые надо вычислять итерационным методом ССП, а содержит только небольшое число констант a и b, значения которых предполагаются заранее известными, а также параметр e. Поэтому интегро-дифференциальная система уравнений Рутана превращается в методе МОХ в обычную систему линейных уравнений, которую можно легко решить стандартными методами линейной алгебры. Эта система имеет следующий вид: по диагонали матрицы стоят числа (a – e), а недиагональные элементы равны либо числу b, либо или нулю, в зависимости от топологии молекулы. С целью упрощения, можно провести дополнительное преобразование: разделим все элементы матрицы на число b. Т огда диагональные элементы приобретают вид (a – e)/ b = х, а недиагональные элементы будут равны или 0/ b = 0, или b / b = 1:
Заметим, что эта система является однородной (все правые части равны 0). Такие системы имеют решения только тогда, когда определитель системы равен нулю.
Раскрыв этот определитель, получим характеристическое уравнение, имеющее n корней { x 1, x 2,..., xn }. При подстановке их в систему, получим n экземпляров системы, причем все они будут заведомо совместны (разрешимы). В качестве решения каждая такая система будет давать набор коэффициентов для одной из МО. Энергии соответствующих орбиталей легко рассчитать через значения корней: e i = a – b • хi. Этим и исчерпывается общая схема решения Хюккелевской задачи.
Для иллюстрации рассмотрим несколько простых примеров. ЭТИЛЕН Электроны p-типа в молекуле этилена описываются двухцентровыми МО, построенными в виде линейной комбинации всего двух атомных орбиталей, причем обе атомные орбитали одинаковы (р -типа): p 1 = С 1 а pa + C 1 b pb p 2 = С 2 а pa + C 2 b pb Уравнения Рутана имеют простой вид:
Запишем характеристическое уравнение: х 2 – 1 = 0, откуда получим два корня: х 1 = +1 и х 2 = –1. При подстановке первого корня в систему получим:
Отсюда следует, что коэффициенты первой МО равны по величине, но противоположны по знаку: Сa = – Cb, и из условия нормировки найдем их абсолютные величины: С 1 a = (0,5)1/2 и C 1 b = – (0,5)1/2. Аналогично, подставив в систему второй корень х 2 = –1, найдем явный вид второй МО: С 2 a = (0,5)1/2 и C 2 b = (0,5)1/2. Таким образом, МО молекулы этилена имеют вид:
а соответствующие им энергии равны: e1 = a – b • х 1 = a – b e2 = a – b • х 2 = a + b С математической точки зрения, задача полностью решена. Обсудим некоторые физические выводы из полученного решения. Во-первых, зная величины энергий МО, мы можем построить корреляционную энергетическую диаграмму, которая показывает каким образом изменяются энергии стационарных состояний электронов при перекрывании атомных орбиталей, приводящему к образованию молекулярных орбиталей. При этом, надо иметь в виду, что оба интеграла (a и b) отрицательны, откуда следует, что энергия e2 = a + b лежит ниже по шкале энергий, чемe1 = a – b.
Из диаграммы ясно видно, что энергия одной из МО ниже энергии исходных атомных орбиталей, и ее заселение двумя электронами приведет к общему уменьшению энергии на величину D Е = 2 b. Следовательно, эта МО будет связывающей. Напротив, энергия другой МО выше энергии АО и ее заселение электронами привело бы к повышению общей энергии. Эта МО, следовательно, будет разрыхляющей. Можно легко определить, что переход одного из электронов со связывающей МО на разрыхляющую будет сопряжен с поглощением порции энергии D Е = 2 b, следовательно, такой переход будет происходить при облучении молекулы светом с частотой n = 2 b / h. Частоту перехода легко определить экспериментально. Это позволит оценить и величину резонансного интеграла b (около 16 ккал/моль или 65 кДж/моль). Во-вторых, зная коэффициенты МО, мы можем построить графическое изображение МО и соответствующих им электронных облаков
Можно отметить две важные особенности найденных нами МО: 2 МО с более высокой энергией имеет дополнительную узловую поверхность, относительно МО с меньшей энергией, 2 МО могут быть охарактеризованы определенной симметрией, которая совпадает с симметрией всей молекулы этилена, так как полученные нами орбитали относятся к каноническому типу. Подчеркнем, что используя менее грубые приближения, мы можем получить более точную форму МО и их энергии. Тем не менее, узловая структура и симметрия МО, полученных самым грубым методом МОХ, в точности такая же, как и у самосогласованных МО, получаемых самым точным методом Хартри-Фока. Поэтому многие результаты, получаемые в рамках МОХ, отличаются полной надежностью, что позволяет с успехом использовать простой метод Хюккеля для анализа многих важных задач, таких как, например, установление правил отбора в электронной спектроскопии и в химических реакциях (принцип сохранения орбитальной симметрии).
ЦИКЛОБУТАДИЕН Хюккелевские МО в циклобутадиене образуются при суперпозиции 4‑х атомных орбиталей р -типа.
Уравнения Рутана и корни характеристического уравнения имеют следующий вид:
Здесь мы имеем случай двукратно вырожденного корня (х 2 = х 3). При решении системы для невырожденных корней никаких проблем не возникает, и мы легко находим коэффициенты соответствующих МО:
При подстановке вырожденного корня в систему уравнений получаем такой результат:
Ca + Cc = 0 Сb + Cd = 0 Ca + Cc = 0 Видно, что набор из четырех неизвестных распадается на два поднабора, причем Ca = – Cc и Сb = – Cd. Поскольку поднаборы никак не связаны между собой, любая их линейная комбинация является решением системы:
Очевидно, что в данном случае (т.е. в случае вырожденных по энергии орбиталей) получилось целое двумерное пространство орбиталей, каждая из которых описывает возможное состояние электрона с энергией a. Для того, чтобы не перечислять все эти орбитали, мы можем выбрать из них две линейно независимые и взаимно ортогональные МО, которые будут играть роль базиса в этом двумерном пространстве. Например, такой базис можно получить, если положить:
Возможны и другие варианты выбора базиса. Например, образуем еще один базис из предыдущего путем построения суммы и разности орбиталей p' и p'': p + = (0,5)1/2 [ p' + p'' ] p – = (0,5)1/2 [ p' – p'' ] Эти новые базисные орбитали будут иметь такие коэффициенты: p + = 0,5 (pa + pb – pс – pd ) e + = a p – = 0,5 (pa – pb – pс + pd ) e – = a Обратим внимание на то, что с аналогичной ситуацией мы уже встречались при рассмотрении модели плоского ротатора. Там вырождение было связано с вращательным характером движения. В молекуле циклобутадиена ситуация точно такая же: поскольку скелет молекулы замкнут, электроны движутся в потенциальной яме почти цилиндрической формы, и описание данной системы качественно совпадает с описанием плоского ротатора. Подобная аналогичность описаний для внешне различных систем часто наблюдается в квантовой механике.
Общие решения В некоторых случаях метод Хюккеля допускает формулировку общих решений для целых классов однотипных молекул. К таким классам относятся, например, линейные полиены и аннулены(циклические полиены). ЛИНЕЙНЫЕ ПОЛИЕНЫ Молекулы такого типа можно описать общей структурно-топологической формулой
Определитель Хюккеля для таких молекул имеет стандартный вид: по главной диагонали располагаются числа х, и кроме того,имеются две побочные диагонали (сверху и снизу от главной), состоящие из единиц. Остальные элементы равны нулю.
Это общее решение имеет простую графическую интерпретацию. Нарисуем полуокружность с радиусом 2 и разделим ее на (n + 1) равных частей n радиус-векторами. Проекции этих векторов на вертикальную ось и дадут искомые значения величин хi, а следовательно, и вид энергетической диаграммы.
Легко заметить общую закономерность: все энергетические уровни линейных молекул лежат в узком интервале от a + 2 b до a – 2b, располагаясь, по мере увеличения числа атомов, все более и более тесно:
В пределе образуются две энергетические зоны, разделенные небольшой щелью. Такая структура, как известно, характерна для полупроводников. Действительно, очень длинные линейные полиены (полиацетилен) обладают полупроводниковыми свойствами. Можно также заметить следующее: связывающие и разрыхляющие энергетические уровни располагаются симметрично, относительно атомного уровня (a). Для нечетных полиенов (нечетное число атомов) наблюдается, кроме того, один несвязывающий уровень. Все рассмотренные особенности обусловлены топологическим характером метода МОХ. Общее решение существует и для коэффициентов МО:
Для этого решения также можно найти графическую интерпретацию. Для каждой МО рассчитаем набор углов: q k n = (p • k • n) / (n + 1) Теперь построим для каждого такого угла (угол нужно отсчитывать от горизонтальной оси) радиус-вектор в круге радиусом R = [2 / (n + 1)]1/2. Проекции этих векторов на вертикальную ось и дадут величины коэффициентов Сkn. Рассмотрим для примера молекулу бутадиена. Здесь имеется 4 атома и, следовательно, должно быть 4 МО.
{0,372 0,602 0,602 0,372}. Соответствующую МО можно схематически изобразить так:
{0,602 0,372 – 0,372 – 0,602}.
Приближенные значения коэффициентов таковы: {0,602 – 0,372 – 0,372 0,602}. Соответствующую МО можно схематически изобразить так:
Приближенные значения коэффициентов таковы: {0,372 – 0,602 0,602 – 0,372}. Соответствующую МО можно схематически изобразить так:
Достаточно очевидно, что наблюдается симметрия: С 11 = С 14 и С 12 = С 13.
Можно заметить, что огибающие совокупности АО весьма напоминают отрезки синусоид, которые мы получали для простой модели “частица в ящике”. Эта аналогия, конечно, не случайна. Действительно, электроны в молекуле бутадиена заперты в одномерном ящике, стенки которого создаются электрическими полями ядер молекулы. Очевидно, что и в этом случае выполняется общее правило: чем больше узлов — тем выше энергия. Порядок химической связи.
Для заданной пары атомов с номерами n и m порядок связи может быть рассчитан по формуле:
Рассчитанные порядки относятся только к p-связям. Полные порядки связи между атомами можно получить, добавив соответствующие величины для порядков s -связей. Винилхлорид >C= C — Cl: h = 2.0 K = 0.4
Решив уравнения Рутана, найдем и коэффициенты МО:
Располагая коэффициентами МО и заселенностями, рассчитаем молекулярные параметры:
Молекулярная диаграмма (порядки связей указаны с учетом и s-связей) имеет вид:
Для сравнения справа приведена молекулярная диаграмма, соответствующая классической структурной формуле молекулы винилхлорида. Легко заметить, что между классической и Хюккелевской диаграммами имеются различия: изменены порядки связей и заряды атомов. С физической точки зрения, эти изменения можно рассматривать как результат "смещения" электронной плотности от атома хлора к этиленовому фрагменту. Это, разумеется не настоящее смещение, а просто поправка, которую необходимо ввести в классическую формулу, чтобы согласовать ее с реальным распределением электронной плотности. Такое "смещение" принято изображать кривой стрелкой, указывающей его направление. Результатом введения такой поправки будет т.н. неклассическая структурная формула, в которой отмечены такие особенности, как нецелочисленный порядок связей и наличие зарядов на атомах.
Отличие реальной структуры молекулы от классической формулы часто рассматривается как результат некоторого мезомерного эффекта или эффекта сопряжения (n- p — типа). Необходимость в учете таких поправочных "эффектов" химики установили на основе экспериментального изучения реакционной способности молекул и независимо от квантовой механики. Однако, метод Хюккеля (и другие, более точные методы квантовой химии) позволяют не только установить наличие такие "эффектов", но описать их количественно. Подчеркнем, что указанные на диаграмме заряды атомов обусловлены только p-электронами, а индуктивные эффекты смещения s-электронов не учтены (поскольку это выходит за рамки простого метода Хюккеля). Корреляционная диаграмма МО
Располагая корреляционной диаграммой, мы можем оценить количественно величину энергетического эффекта, связанного с делокализацией электронов в реальной молекуле, относительно классической структуры. Так, если бы электронная пара атома хлора не участвовала в образовании p-облака, то оно было бы образовано только двумя электронами атомов углерода, и имело бы точно такой же вид, как в молекуле этилена. Энергия делокализации этих двух p-электронов, была бы равна 2b. Энергия неподеленной электронной пары атома хлора была бы равна 2´2b. Итого, получили бы суммарную энергию в 6b. По корреляционной диаграмме легко подсчитать, что энергия делокализации 4-х электронов в реальной молекуле составляет 2´0.928b + 2´2.099b = 6.053b. В результате получим разницу в 0.053b, что и составит т.н. энергию сопряжения. За счет того, что энергия реальной молекулы меньше, ее реакционная способность снижена, относительно тех предсказаний, что дает нам классическая теория строения молекул. Так, например, хорошо известно, что винильные атомы галогенов замещаются гораздо труднее, чем обычные. Известно и множество других особенностей таких молекул, полностью согласующихся с полученной нами моделью. Амидная группа
В молекулах амидов карбоновых кислот p-электронное облако охватывает только часть молекулы — амидную группу. Поэтому хюккелевскую задачу нужно решать только для трехатомного фрагмента молекулы. В этом фрагменте содержится два различных гетероатома, каждому из которых соответствует свой набор поправочных параметров: кислород h = 1.0 K = 1.0 азот h = 1.5 K = 0.8 Запишем матрицу Хюккеля и характеристическое уравнение:
Зная коэффициенты МО, можно рассчитать молекулярные характеристики, построить молекулярную и корреляционную диаграммы и вид МО
Молекулярная диаграмма и ее классический аналог имеют вид:
Теперь легко установить характер сопряжения и построить "неклассическую" формулу амидной группы:
Можно заметить, что в количественном отношении эффект сопряжения здесь существенно больше, чем в молекуле винилхлорида. Наиболее характерное следствие этого эффекта — слабое проявление амидами карбоновых кислот основных свойств. Корреляционная диаграмма
Сероокись углерода (O = С = S) В этой молекуле имеется две системы p-связей, расположенные во взаимно перпендикулярных плоскостях (точками обозначены валентные электроны):
Каждую систему нужно рассматривать отдельно.
Решение Хюккелевской матрицы выглядит так:
Коэффициенты МО и молекулярные характеристики:
Решение Хюккелевской матрицы выглядит так:
Коэффициенты МО и молекулярные характеристики:
Для того, чтобы найти суммарные параметры молекулы, необходимо сложить величины, соответствующие отдельным подсистемам:
Теперь можно построить суммарные диаграммы:
Следует отметить, что у метода Хюккеля имеется и ряд существенных недостатков, которые ограничивают область его применимости. Во-первых, это возможность расчета только p-электронных свойств молекул. Во-вторых, полуэмпиричность метода приводит к необходимости экспериментального определения величины b, являющейся наиболее важной величиной. Опыт показывает, что оценки этой величины, получаемые данных различных экспериментальных методов, плохо согласуются между собой. В результате, для каждой конкретной задачи приходится подбирать свое собственное значение этого интеграла. Задачи. Составить матрицу Хюккеля для некоторой молекулы. Рассчитать энергии и коэффициенты МО для некоторого линейного полиена. Определить число узлов на заданной МО некоторого линейного полиена и изобразить графически вид этой МО и соответствующего ей одноэлектронного облака. Рассчитать электронную плотность и заряд на заданном атоме некоторой молекулы. Рассчитать порядок заданной связи в некоторой молекуле. Рассчитать индекс свободной валентности для заданного атома некоторой молекулы. Построить молекулярную диаграмму заданной молекулы. Описать имеющие в ней место эффекты сопряжения. Изобразить неклассическую структурную формулу молекулы. Построить корреляционную диаграмму для заданной молекулы. Метод МО Хюккеля Метод молекулярных орбиталей Хюккеля (МОХ) является одним из наиболее простых и полезных вариантов общего метода МО ЛКАО. В его основе лежит несколько приближений, позволяющих избежать вычислительных трудностей, характерных для полного варианта метода МО. Каждая МО в методе Хюккеля строится в виде линейной комбинации атомных орбиталей (ЛКАО): y i = С 1 × j 1 + С 2 × j 2 +... + Сn × j n где n — число атомов. Полный набор МО удобно задать в матричном виде:
Система уравнений Рутана для нахождения коэффициентов Сi m имеет вид:
где Fij — матричные элементы оператора Фока, Sij — интегралы перекрывания для данной пары атомов, e — орбитальная энергия. Основные проблемы метода МО, как известно, связаны с необходимостью процедуры самосогласования, включающей многократные вычисления интегралов типа F и S. В методе Хюккеля ни один из этих интегралов не вычисляется — они определяются на основании экспериментальных данных (спектральные, калориметрические и т.д.). Таким образом МОХ относится к большой группе т.н. полуэмпирических вариантов общего метода МО. Еще одно приближение метода Хюккеля заключается в том, что все диагональные интегралы Fii (оба индекса одинаковы), характеризующие некоторый атом (точнее, энергию электрона, локализованного на этом атоме), полагаются равными друг другу и поэтому обозначаются одним и тем же символом: Fii = Fjj = a (т.н. остовный интеграл). Другими словами, предполагается, что все атомы, входящие в состав молекулы, одинаковы по своей химической природе. Поэтому простой метод МОХ применяется почти исключительно для описания углеводородов типа полиенов и аренов. Существуют и усовершенствованные разновидности метода МОХ, позволяющие учесть различия в природе атомов гетероатомных молекул. Третье приближение сводится к тому, что недиагональные интегралы Fij разделяются на два типа. Первый тип относится к парам атомов, соединенными между собой химическими связями. Для таких пар атомов принимается следующее условие: Fij = b (т.н. резонансный интеграл). Второй тип относится к парам атомов, которые не связаны между собой химически; для них Fij = 0. Резонансный интеграл представляет собой поправку к полной энергии, обусловленную возможностью перехода электрона от атома j к атому i, и наоборот. Химически связанные атомы располагаются близко друг к другу и амплитуда обмена электронами для такой пары атомов велика. Напротив, химически несвязанные атомы практически не могут обмениваться электронами, и, следовательно, соответствующая поправка к энергии настолько мала, что ею можно пренебречь. Заметим, что разделение недиагональных интегралов Fij на два типа (нулевые и ненулевые) осуществляется не на основании квантовомеханических соображений, а исключительно на химической основе — по химической структурной формуле. Структура матрицы уравнений Рутана в методе Хюккеля определенным образом "приспосабливается" к топологии молекулы. Поэтому метод МОХ относится к классу т.н. топологических вариантов МО. Четвертое приближение заключается в том, что интегралы перекрывания Sij также разделяются на два типа: диагональные интегралы приравниваются к 1, а недиагональные к 0:
Такой подход называется приближением нулевого дифференциального перекрывания (НДП). После сделанных приближений, матрица уравнения Рутана существенно упрощается — она уже не содержит интегралов (типа F mnи S mn), которые надо вычислять итерационным методом ССП, а содержит только небольшое число констант a и b, значения которых предполагаются заранее известными, а также параметр e. Поэтому интегро-дифференциальная система уравнений Рутана превращается в методе МОХ в обычную систему линейных уравнений, которую можно легко решить стандартными методами линейной алгебры. Эта система имеет следующий вид: по диагонали матрицы стоят числа (a – e), а недиагональные элементы равны либо числу b, либо или нулю, в зависимости от топологии молекулы. С целью упрощения, можно провести дополнительное преобразование: разделим все элементы матрицы на число b. Т огда диагональные элементы приобретают вид (a – e)/ b = х, а недиагональные элементы будут равны или 0/ b = 0, или b / b = 1:
Заметим, что эта система является однородной (все правые части равны 0). Такие системы имеют решения только тогда, когда определитель системы равен нулю.
Раскрыв этот определитель, получим характеристическое уравнение, имеющее n корней { x 1, x 2,..., xn }. При подстановке их в систему, получим n экземпляров системы, причем все они будут заведомо совместны (разрешимы). В качестве решения каждая такая система будет давать набор коэффициентов для одной из МО. Энергии соответствующих орбиталей легко рассчитать через значения корней: e i = a – b • хi. Этим и исчерпывается общая схема решения Хюккелевской задачи. Для иллюстрации рассмотрим несколько простых примеров. ЭТИЛЕН Электроны p-типа в молекуле этилена описываются двухцентровыми МО, построенными в виде линейной комбинации всего двух атомных орбиталей, причем обе атомные орбитали одинаковы (р -типа): p 1 = С 1 а pa + C 1 b pb p 2 = С 2 а pa + C 2 b pb Уравнения Рутана имеют простой вид:
Запишем характеристическое уравнение: х 2 – 1 = 0, откуда получим два корня: х 1 = +1 и х 2 = –1. При подстановке первого корня в систему получим:
Отсюда следует, что коэффициенты первой МО равны по величине, но противоположны по знаку: Сa = – Cb, и из условия нормировки найдем их абсолютные величины: С 1 a = (0,5)1/2 и C 1 b = – (0,5)1/2. Аналогично, подставив в систему второй корень х 2 = –1, найдем явный вид второй МО: С 2 a = (0,5)1/2 и C 2 b = (0,5)1/2. Таким образом, МО молекулы этилена имеют вид:
а соответствующие им энергии равны: e1 = a – b • х 1 = a – b e2 = a – b • х 2 = a + b С математической точки зрения, задача полностью решена. Обсудим некоторые физические выводы из полученного решения. Во-первых, зная величины энергий МО, мы можем построить корреляционную энергетическую диаграмму, которая показывает каким образом изменяются энергии стационарных состояний электронов при перекрывании атомных орбиталей, приводящему к образованию молекулярных орбиталей. При этом, надо иметь в виду, что оба интеграла (a и b) отрицательны, откуда следует, что энергия e2 = a + b лежит ниже по шкале энергий, чемe1 = a – b.
Из диаграммы ясно видно, что энергия одной из МО ниже энергии исходных атомных орбиталей, и ее заселение двумя электронами приведет к общему уменьшению энергии на величину D Е = 2 b. Следовательно, эта МО будет связывающей. Напротив, энергия другой МО выше энергии АО и ее заселение электронами привело бы к повышению общей энергии. Эта МО, следовательно, будет разрыхляющей. Можно легко определить, что переход одного из электронов со связывающей МО на разрыхляющую будет сопряжен с поглощением порции энергии D Е = 2 b, следовательно, такой переход будет происходить при облучении молекулы светом с частотой n = 2 b / h. Частоту перехода легко определить экспериментально. Это позволит оценить и величину резонансного интеграла b (около 16 ккал/моль или 65 кДж/моль). Во-вторых, зная коэффициенты МО, мы можем построить графическое изображение МО и соответствующих им электронных облаков
Можно отметить две важные особенности найденных нами МО: 2 МО с более высокой энергией имеет дополнительную узловую поверхность, относительно МО с меньшей энергией,
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 474; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.159.19 (0.24 с.) |

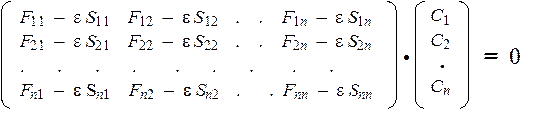
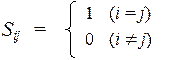

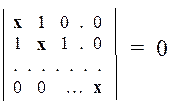
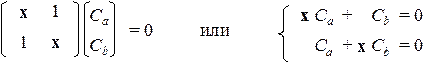
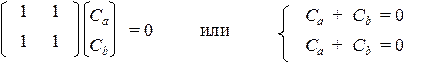





 Сb + Cd = 0
Сb + Cd = 0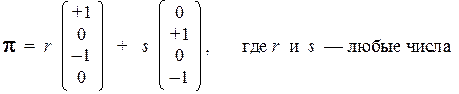
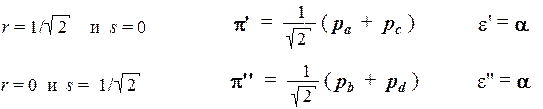

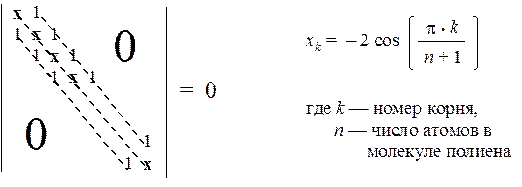



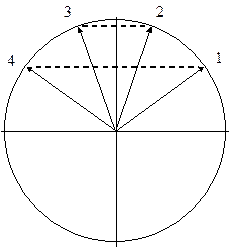 При k = 1 углы равны: q1n = p/5; 2p/5; 3p/5; 4p/5. Приближенные значения коэффициентов таковы:
При k = 1 углы равны: q1n = p/5; 2p/5; 3p/5; 4p/5. Приближенные значения коэффициентов таковы:
 При k = 2 углы равны: q2n = 2p/5; 4p/5; 6p/5; 8p/5. Приближенные значения коэффициентов таковы:
При k = 2 углы равны: q2n = 2p/5; 4p/5; 6p/5; 8p/5. Приближенные значения коэффициентов таковы: Соответствующую МО можно схематически изобразить так:
Соответствующую МО можно схематически изобразить так: k = 3. q3n = 3p/5; 6p/5; 9p/5; 12p/5.
k = 3. q3n = 3p/5; 6p/5; 9p/5; 12p/5.
 k = 4. q4n = 4p/5; 8p/5; 12p/5; 16p/5.
k = 4. q4n = 4p/5; 8p/5; 12p/5; 16p/5.
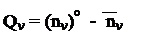
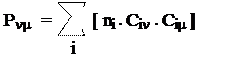
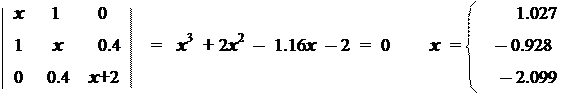

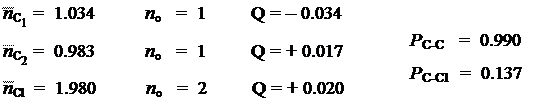
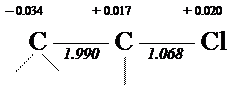


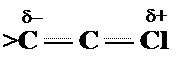

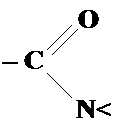
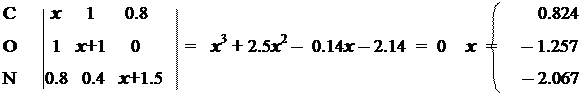
 Решив систему уравнений Рутана с указанными корнями, получим коэффициенты МО.
Решив систему уравнений Рутана с указанными корнями, получим коэффициенты МО.
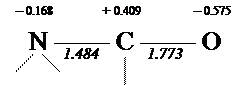





 Первая система (вертикальная плоскость) может быть изображена так:
Первая система (вертикальная плоскость) может быть изображена так: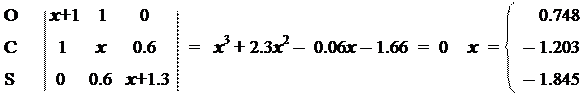

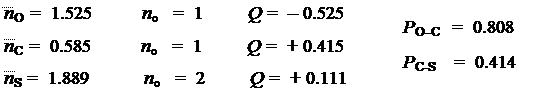
 Вторая система (горизонтальная плоскость) может быть изображена так:
Вторая система (горизонтальная плоскость) может быть изображена так: