
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
AAGAATTGCGGAATTCGAGCTTAAGGGCCGCGCCGAAGCTTTAAA-3’ ⇐ ПредыдущаяСтр 7 из 7
TTCTTAACGCCTTAAGCTCGAATTCCCGGCGCGGCTTCGAAATTT-5’
4. Плазмидную ДНК обработали рестриктазами BclI, Hin1I и их смесью. Продукты реакции разделили в агарозном геле и окрасили бромистым этидием. Результаты электрофореза представлены на рис. 21. Цифры справа указывают на приблизительные размеры фрагментов в п.н. Постройте рестрикционную карту плазмиды.
Рис. 21
5. Линейный фрагмент ДНК обработали рестриктазами Hinс II, Ndel I и их смесью. Продукты реакции разделили в агарозном геле и окрасили бромистым этидием. Результаты электрофореза представлены на рис. 22. Цифры справа указывают на приблизительные размеры фрагментов в п.н. Постройте рестрикционную карту фрагмента.
Рис.22
6. На Рис. 23 представлены электрофореграммы исследования полиморфизма экзона 9 гена VDR-3 (ядерный рецептор витамина D) рестриктазой Taq I в контрольной выборке (дорожки 1-21) и у больных остеопорозом (22-42). Цифрами справа обозначены длины фрагментов ДНК в п.н. Составьте возможные варианты рестрикционной карты аллелей T (с одним сайтом рестрикции) и t (с двумя сайтами рестрикции), если исходная длина амплифицированного фрагмента экзона 9 составляет 745 п.н. и в нем есть два сайта для рестриктазы Taq I, один из которых полиморфный, а другой – нет. Определите частоту аллелей T и t в контрольной выборке и у больных.
Рис. 23 7. В кодирующей части гена CRR5 рецептора хемокинов встречается делеция 32 п. н. (CRR5de!32). Известно, что рецептор хемокинов CRR5 используется также вирусом иммунодефицита человека ВИЧ-1 для проникновения в клетки человека. Данная делеция приводит к дефекту рецептора, препятствует его взаимо-действию с вирусом и тем самым определяет устойчивость к ин-фекции ВИЧ-1 у гомозигот по присутствию делеции (CRR5del32/ CRR5del32). На электрофореграмме представлены результаты IIЦР-амплификации участка гена CRR5, затронутого этой делецией, у группы с высоким риском заражения ВИЧ-1. Определите дорож-ки, на которых представлены образцы людей, устойчивых к инфек-ции. Цифрами справа обозначены длины фрагментов ДНК в п. н.
8. В кодирующей части гена CRR5 рецептора хемокинов описаны две мутации, приводящие к дефекту рецептора CRR5: деления 32 п. н. (CRR5del32) и замена одного нуклеотида в положении 303 (CRR5m303), которая приводит к возникновению стоп-кодона и нарушению синтеза белка. Гомозиготы CRR5del32 / CRR5del32 и CRR5m303/CRR5m303, а также гетерозиготы по обеим мутациям в трансположении устойчивы к ВИЧ-1 инфекции, так каквирус не может использовать дефектный рецептор CRR5 для проникновения в клетку. В таблице на Рис. 24 показаны результаты идентификации рассматриваемых мутаций после ПЦР-амплификации с последующим рестрикционным анализом продуктов рестриктазой Hindi (в случае мутации CRR5m303 сайт Hindi исчезает) в группе риска по заражению ВИЧ-1. Праймеры фланкируют фрагмент гена CRR5, в котором возникают обе мутации. Размер ПЦР-продукта составляет 620 п. н., а с делецией — 588 п. н. Установите ге-нотипы изученных людей и определите, кто из них может быть устойчив к ВИЧ-1 инфекции.
9. ДНК некоторых вирусов может встраиваться в геном хозяина. Вы исследуете структуру встроенной ДНК определенного вируса. Для этого вы получаете образцы ДНК свободного вируса и ДНК из клеток хозяина-носителя вируса. Эту ДНК вы гидролизуете рестриктазами, для которых вам известны сайты рестрикции (Рис. 25). Далее вы разделяете полученные фрагменты при помощи электрофореза и визуализируете полосы (бэнды), соответствующие вирусной ДНК, при помощи Саузерн-блот гибридизации, используя в качестве зонда радиоактивно-меченную вирусную ДНК. Результат изображен на рис. 25В. Попробуйте определить, в каком из отмеченных участков (а-е) происходит разрыв кольца при интеграции вируса в геном хозяина.
Рис. 25 10. Медленное изменение частоты нейтральных мутаций в пуле генов какого-либо вида служит причиной того, что отдельный ген часто присутствует в популяции в нескольких формах, слегка отличающихся друг от друга (в нескольких аллельных формах или в виде нескольких аллелей). Некоторые мутации приводят к изменению или к исчезновению функции кодируемого продукта, а, следовательно, они могут приводить к возникновению наследственных болезней. Другие мутации, не затрагивающие важных кодирующих участков, обычно не приводят к фенотипическим последствиям. И те, и другие мутации, изменяя первичную структуру ДНК, могут приводить к возникновению различий в сайтах рестрикции, в результате чего возникает так называемый полиморфизм длин рестрикционных фрагментов (ПДРФ, или RFLPs – restriction-fragment-length polymorphisms). Анализ ПДРФ позволяет проследить за наследуемостью определенных участков хромосом. При определенных условиях по наличию ПДРФ вблизи дефектного гена можно узнать, имеется ли ген, вызывающий заболевание, у еще не родившегося ребенка, то есть, использовать для пренатальной диагностики наследственных заболеваний.
Супружеская пара пришла к вам на генетическую консультацию. Их второй ребенок умер вскоре после рождения от наследственного заболевания, и мать опять ждет ребенка. Умерший ребенок был вторым заболевшим в семье. Брат бабушки со стороны отца также был болен. Супруги хотят узнать, унаследовал ли их еще не родившийся ребенок эту болезнь. Вам известно, что это заболевание определяется аутосомной рецессивной мутацией. Область хромосомы, в которой локализована эта мутация, имеет несколько участков, где при анализе популяции проявляется полиморфизм сайтов рестрикции, как показано на рис. Полиморфизм сайтов рестрикции в популяции отмечен знаком (+/-).
Вы выделяете ДНК обоих родителей, всех бабушек и дедушек, а также здорового ребенка и проводите картирование с помощью рестриктаз, как показано на рис. 26. Теперь вы готовы проанализировать ДНК плода. Какие полосы рестриктов укажут, что плод, вероятно, унаследовал болезнь?
Рис. 26 11. Цветное зрение у человека определяется тремя различными зрительными пигментами, поглощающими свет в красной, зеленой и синей областях видимого спектра. Потеря одного из этих пигментов приводит к дальтонизму. Примечательно, что около 8% всех мужчин имеют дефекты цветового зрения, сцепленные с Х-хромосомой и затрагивающие красный или зеленый пигменты. Дальтонизм по голубому цвету-аутосомный признак - встречается крайне редко. Гены человека, кодирующие зрительные пигменты, были обнаружены путем выявления генов, гомологичных клонированному гену бычьего родопсина, который кодирует зрительный пигмент, находящийся в палочках сетчатки и определяющий черно-белое зрение. Таким способом было идентифицировано четыре типа генов: ген родопсина и три других гена (один аутосомный и два сцепленных с Х-хромосомой), кодирующих белки, структура которых весьма сходна с родопсином. Два гена сцепленные с Х-хромосомой и предположительно кодирующие красный и зеленый пигменты, идентичны на 98% как в области экзонов, так и в области интронов. Рестрикционные карты этих двух генов (А-типа и В-типа) приведены на рис. 27. Гены можно различить благодаря полиморфизму длины рестрикцион-ных фрагментов (ПДРФ), один из которых (при обработке Rsal) показан под картами генов на рис. 27. Для проверки того, что именно эти гены кодируют красный и зеленый пигменты, обследовали нескольких нормальных мужчин и нескольких дальтоников по красному или зеленому цвету. В этих экспериментах использовали гибридизационные зонды, специфичные для ПДРФ-маркеров, выявляемых при обработке Rsal (рис. 28). Удивительную вариабельность по наблюдаемому числу генов А-типа изучали путем обработки препаратов ДНК определенных индивидов рестриктазой NotI, последующего разделения получаемых длинных рестриктов методом пульс-электрофореза и гибридизации их с зондом, комплементарным к обоим генам (рис. 29).
A. Какие гены кодируют красный зрительный пигмент и какие зеленый? Б. Генетический анализ показал, что гены, кодирующие красный и зеленый зрительные пигменты, расположены на Х-хромосоме рядом друг с другом. Каким образом эксперименты, описанные выше, позволяют сделать вывод, что эти гены физически сцеплены? B. Зонд, специфичный для уникальных последовательностей, расположенных непосредственно перед 5'-концом гена В-типа, гибридизуется с рестриктом 32 т. п. н., получившимся в результате обработки Sfil. Один конец этого фрагмента образуется при разрезании внутри гена, а другой при расщеплении в участке вне данного гена. Этот Sfil-фрагмент разрезается в свою очередь рестриктазой NotI, которую использовали для анализа, показан ного на рис. 29. Исходя из этой информации определите, какой ген расположен на 5'-конце этого кластера, а какой на З'-конце. (За 5'-конец кластера принимается конец вблизи 5'-конца первого гена.)
Рис. 28. ПДРФ, выявляемый при обработке рестриктазой Rsal, у нормальных мужчин, у дальтоников, не воспринимающих зеленый цвет, и у дальтоников, не воспринимающих красный цвет. Вариант ПДРФ, специфичный для гена А-типа, обозначен Rsal А; вариант ПДРФ щ гена В-типа обозначен Rsal В. Индивиды обозначены номерами.
Рис. 29. Фрагменты обработан-I ной NotI ДНК некоторых нормаль-I ных мужчин и дальтоников. Цифры, обозначающие I индивидов, соответствуют цифрам I на рис. 28. Соотношение генов I А-типа и В-типа определено по I интенсивности зон гибридизации на |рис. 28. Размеры фрагментов, [образующихся при расщеплении •NotI, указаны в т. п. н. Рис. 30
12. Важный подход к изучению репликации ДНК-это применение электронной микроскопии, благодаря которой можно непосредственно наблюдать репликативную вилку, а на мелких молекулах ДНК можно видеть всю реплицирующуюся структуру. Кроме того, при использовании специальных методов приготовления образцов можно отличать двухцепочечную ДНК от одноцепочечной. На рис. 30 изображен ряд гипотетических реплицирующихся молекул с участками одноцепочечной ДНК, показанными тонкими линиями. В одном раннем и очень важном электронно-микроскопическом исследовании репликации у бактериофага лямбда некоторые из этих структур были действительно обнаружены и встречались часто, а другие никогда не наблюдались.
А. Нарисуйте схематически репликационную структуру с двумя вилками, смещающимися в противоположных направлениях. Пометьте концы всех цепей (5' или 3') и укажите лидирующую и отстающую цепи в каждой репликативной вилке. Б. На основе своих знаний по репликации ДНК укажите четыре структуры на рис. 5-16, которые наблюдались наиболее часто. 13. Где образуется РНК-затравка, на специфических или на случайных участках матрицы? Идеальной матрицей при изучении этого вопроса может служить ДНК вируса М13, потому что она не содержит З'-ОН-группы. Для ответа на данный вопрос кольцевую ДНК этого вируса полностью копировали в присутствии ДНК-полимеразы бактериофага Т4, праймосомы Т4 (комплекс геликазы и РНК-праймазы), различных rNTP (рибонуклеозидтрифосфатов) и dNTP (дезокси-рибонуклеозидтрифосфатов). Затем двухцепочечные кольцевые продукты обрабатывали рестриктазой, которая расщепляет двойную цепь в специфическом участке. Продукты этого расщепления подвергали денатурации, после чего анализировали последовательность нуклеотидов ДНК методом гель-электрофореза с высоким разрешением. Было обнаружено много отдельных полос. Если продукты расщепления до электрофореза обрабатывали РНКазой, то все они становились на пять нуклеотидов короче, о чем свидетельствовала более быстрая миграция их в секвени-рующем геле. Зная, что каждый продукт рестрикции заканчивается специфическим участком рестрикции, можно было по длине продукта установить матричную последовательность вблизи 5'-конца. (Полная последовательность М13 известна.) Некоторые из этих матричных последовательностей показаны на рис. 31 слева. Последовательность ДНК на каждом из соответствующих 5'-концов цепей продуктов была определена после удаления РНК-затравки. Эти последовательности показаны на рис. 31, справа, в той же строчке, что и комплементарная последовательность матричной ДНК. Определите на основе этих данных стартовый участок для РНК-затравки на каждой матричной последовательности. Какой сигнал нужен для начала реакции, катализируемой РНК-праймазой?
Рис. 31. Матричные последовательности М13 (слева) и соответствующие последовательности ДНК, образуемые в каждом сайте (справа) во время синтеза РНК-затравки (задача 5-25). РНК-затравки были отделены от этих цепей ДНК перед секвенированием.
14. Ген dnaB у Е. coli кодирует геликазу, которая участвует в расплетании ДНК на участке репликативной вилки. Свойства этого фермента были изучены с использованием искусственных суб стратов, подобных тем, которые изображены на рис. 32. Экспериментальный подход заключался в том, что субстраты инкубировали в разных условиях и затем исследовали образцы методом электрофореза в агарозных гелях. Короткая одиночная цепь будет двигаться медленно, если она еще соединена с длинной цепью ДНК, и будет двигаться гораздо быстрее, если она расплетена и отделена от длинной цепи. Введя в короткую одиночную цепь радиоактивную метку, можно избирательно следить за ее миграцией, определяя ее положение в геле методом радиоавтографии.
Результаты нескольких экспериментов показаны на рис. 33. Субстрат 1, представляющий собой гибридную ДНК без «хвостов», не расплетался с помощью dnaB (рис. 33, дорожки 1 и 2). Однако когда инкубировали субстраты с «хвостами» при + 37 °С в присутствии dnaB и АТР, то за счет расплетания освобождалось значительное количество мелких фрагментов (дорожки 6 и 10). В случае субстрата 3 был раскручен только З'-полуфрагмент (дорожка 10). Процесс расплетания во всех случаях полностью зависел от гидролиза АТР. Расплетание существенно увеличивалось при добавлении белка, связывающегося с одноцепочечной ДНК, (SSB-белок) (сравните дорожки 5 и 6 с 9 и 10). Интересно, что этот белок нужно было добавлять приблизительно через 3 мин после dnaB, в противном случае он ингибировал расплетание. A. Почему для расплетания нужен гидролиз АТР? Б. В каком направлении движется dnaB по длинной одноцепочечной ДНК? С чем больше согласуется это направление, с движением по ведущей цепи или по отстающей цепи в репликативнои вилке? B. Почему белок, связывающийся с одноцепочечной ДНК (SSB), мог ингибировать расплетание, когда его добавляли до dnaB, но стимулировал расплетание, когда его добавляли после dnaB?
Рис. 33. Результаты нескольких экспериментов по измерению расплетания с участием dnaB (задача 5-26). Радиоактивная метка содержалась только в одноцепочечных фрагментах, положение которых показано на схеме. 15. Условно летальные мутации чрезвычайно полезны для генетического и биохимического анализа такого сложного процесса, как репликация ДНК. Температурочувствительные (ts) мутации, являющиеся одной из форм условно летальных мутаций, позволяют организму расти при определенной температуре (например, 30 °С), но препятствуют росту при более высокой температуре (например, 42 °С). У Е. coli выделено большое число температурочувствительных мутантов. Все они дефектны по репликации ДНК при 42 °С, но не при 30 °С. Если температура среды повышается с 30 до 42 °С, синтез ДНК прекращается у этих мутантов одним из двух характерных способов. У «быстро останавливающихся» мутантов синтез ДНК прекращается сразу же, а у «медленно останавливающихся» мутантов это происходит только спустя много минут. А. Попробуйте предсказать, мутациями в каких из нижеперечисленных белков, если они температурочувствительные, будет обусловлен «быстро останавливающийся» фенотип, а в каких-«медленно останавливающийся». В каждом случае объясните ваше предсказание. 1. ДНК-топоизомераза I. 2. Инициаторный белок репликации. 3. Белок, дестабилизирующий спираль. 4. ДНК-геликаза. 5. ДНК-праймаза. 6. ДНК-лигаза. Б. Характер репликации в бесклеточных экстрактах мутантов по существу не отличается от такового в интактных клетках. В экстрактах «быстро останавливающихся» мутантов при температуре 42 °С синтез ДНК прекращается сразу же, тогда как в случае «медленно останавливающихся» мутантов синтез ДНК продолжается в течение еще нескольких минут после повышения температуры до 42 °С. Предположим, что экстракты из мутанта, дефектного по температурочувствительной ДНК-геликазе, и из мутанта по температурочувствительной ДНК-лигазе были смешаны при 42 °С. Какой фенотип будет показывать смесь: «быстро останавливающийся», «медленно останавливающийся» или немутантный?
16. Прокомментируйте следующее утверждение. “Фермент праймаза делает очень много ошибок. В ходе репликации праймеры, синтезированные праймазой затем заменяются на фрагменты ДНК, синтезированные более высокоточными полимеразами. Это расточительно. Было бы энергетически более выгодно, если бы синтез сразу шел без ошибок.” 17. В лаборатории, где вы работаете, занимаются изучением жизненного цикла вирусов животных. Геном у этих вирусов представлен кольцевой двухцепочечной ДНК. Вам поручено определить положение точки(-ек) начала репликации и выяснить, в одну или в обе стороны от начальной точки протекает репликация (однонаправленный или двунаправленный синтез). Чтобы достигнуть цели, вы выделяете реплицирующиеся молекулы, расщепляете их ферментом рестрикции, который разрезает вирусный геном в определенном сайте (в результате чего из кольцевой молекулы образуется линейная молекула ДНК) и затем исследуете образующиеся молекулы с помощью электронной микроскопии. Некоторые молекулы, которые вы видите, схематически изображены на рис. 5-22. (Обратите внимание, что в электронном микроскопе невозможно отличить один конец молекулы ДНК от другого.)
 Вы должны представить свои выводы сотрудникам лаборатории на следующий день. Как вы ответите на вопросы, поставленные перед вами руководителем: 1) имеется ли здесь одна точка начала репликации или таких сайтов несколько; 2) в одном или в двух направлениях происходит репликация? Вы должны представить свои выводы сотрудникам лаборатории на следующий день. Как вы ответите на вопросы, поставленные перед вами руководителем: 1) имеется ли здесь одна точка начала репликации или таких сайтов несколько; 2) в одном или в двух направлениях происходит репликация?
18. Полагают, что автономно реплицирующиеся последовательной (ARS), сообщающие стабильность плазмидам дрожжей, являются точками начала репликации. Однако доказать это весьма сложно. Трудность состоит главным образом в выделении достаточного для анализа количества определенных реплицирующихся молекул ДНК. Это препятствие можно обойти, используя двумерный гель-электрофорез, который позволяет разделить молекулы ДНК по размеру в одном направлении и по форме - в другом. Из-за того, что у реплицирующихся молекул имеются разветвления, они мигрируют во втором направлении медленнее, чем линейные молекулы с той же массой. Разрезая реплицирующиеся молекул рестриктазами, можно получить ряд различных разветвлении форм, дающих в двумерном геле характерное распределение (рис. 35). Вы используете этот метод для изучения репликации плазмиды содержащей ARS1. Чтобы увеличить количество реплицирующейся плазмидных молекул, вы синхронизируете культуру дрожжей и выделяете ДНК из клеток, находящихся в S-фазе. Затем вы А. Что представляет собой интенсивное пятно, возникшее в результате гибридизации и расположенное на обоих гелях в положении, соответствующем 4,5 т.п.н. (рис. 36, Б)? Б. Доказывают ли результаты этого эксперимента, что ARS1 является точкой начала репликации? Объясните ваш ответ. В. На том геле, где разделяли материал, обработанный Pvul (рис. 36, Б), в дугообразной линии зоны гибридизации имеется разрыв. В чем причина этого?
Рис. 35. Двумерный гель-электрофорез молекул с одним разветвлением (А), симметрично расположенным решшкационным глазком (Б), двумя разветвлениями (В) и асимметрично расположенным реплика-ционным глазком (Г). В верхней части рисунка изображены промежуточные формы, образующиеся в процессе репликации условного фрагмента длиной 1 т.п.н. В нижней части рисунка показано, как такие интермедиаты процесса репликации распределяются в геле.
Рис. 36. Строение плазмиды •ARS1 (А) и результаты двумерного гель-электрофореза этой плазмиды, обработанной рестриктазами Bgl II и Pvul I.
19. От С-конца молекулы фермента бета-лактамазы из В. licheniformis после того, как он синтезируется, отделяется несколько аминокислот. Последовательность на С-конце этого фермента можно установить путем сравнения его с ферментом мутанта, у которого происходит сдвиг рамки считывания в результате вставки или делении одного нуклеотида. Аминокислотные последовательности очищенного фермента из клеток дикого типа и из клеток мутанта со сдвигом рамки представлены ниже, начиная с 263-го остатка до С-конца: дикий тип: N М N G К, мутант: N М I W Q I C V M K D. А. В чем заключалась мутация, приведшая к сдвигу рамки? Б. Определите количество аминокислот в новосинтерованном ферменте из клеток дикого типа и, насколько возможно, реальную последовательность для этого фермента.
20. Белки, пронизывающие мембрану, обладают характерной структурой в области бислоя. Какая из трех приведенных последовательностей, состоящих из 20 аминокислот, более всего подходит на роль такого трансмембранного сегмента и подходит ли какая-то из них вообще? Объясните причины вашего выбора.
A. ITLIYFGVMAGVIGTILLIS B. ITEIYFGRMAGVIGTDLLIS
21. Бактериофаг фХ174 демонстрирует пример удивительной экономии в использовании ограниченных возможностей кодирования. Он образует только одну мРНК. Однако один особый участок ДНК кодирует четыре совершенно разных белка, гены которых перекрываются, как изображено на рис. 37. A. Какой из перекрывающихся генов транслируется слева направо, как показано на рис. 37? Б. Какие из этих генов, если такие вообще существуют, транслируются с одной рамки считывания? B. Мутация в особом тирозиновом кодоне (ТАС) в гене для белка К приводит к появлению стоп-кодона (TAG). Эта мутация сопровождается заменой глутамина (САА) на глутаминовую кислоту (GAA) в белке В. Какое изменение эта мутация вызовет в белке А, в белке С?
22. Если небольшое число фагов Т4 смешивают с большим количеством клеток Е. coli штамма В и затем в тонком слое мягкого агара рапределяют на поверхности толстого слоя питательного агара в чашке Петри, то бактерии растут, образуя сплошной «газон», однако в тех местах, где находятся бактерии, инфицированные фагом, фаговые частицы размножаются и убивают все соседние бактерии, приводя к образованию прозрачных круглых бляшек в мутном «газоне». Часто наблюдаемая мутация вируса приводит к изменению морфологии бляшки. Мутанты бактериофага Т4, называемые r-мутантами, были сначала открыты по их способности быстрее других образовывать бляшки в «газоне» Е. coli (здесь «r» обозначает быстрый лизис). Один из классов r-мутантов, а именно rII-мутанты, не образует бляшек в культуре Е. coli штамма К. Эти мутанты начинают инфекцию у Е. coli, но она носит характер абортивной, и вирусы не размножаются. Особая морфология бляшек rII -мутантов в культуре Е. coli В, а также их неспособность расти на Е. coli К были виртуозно использованы в ранних опытах по изучению основных механизмов мутирования генов и установлению триплетной структуры генетического кода. Для практического знакомства с этими классическими исследованиями вам дали восемь rII -мутантов, которые нужно охарактеризовать. Сначала вы ставите ряд тестов на образование бляшек. Вы заражаете одну пластинку агара с Е. coli К мутантом 1, взятым в высокой концентрации, а вторую пластинку - мутантом 2 в высокой концентрации, так что много бактерий на каждой пластинке становится зараженными. Затем вы наносите по капле одного мутанта или фага Т4 дикого типа в кружки, расположенные по окружности пластинки. В качестве контроля вы наносите мутантные фаги и фаг Т4 дикого типа на «газон» незараженных бактерий Е. coli К. После инкубации в течение ночи вы получаете результаты, показанные на рис. 38. Эти результаты определенно кажутся информативными, но вам не все ясно. Чтобы определить, какой вид фага находится в прозрачных кружках, вы отбираете некоторое количество фагов из пятна, образованного фагом дикого типа, и из прозрачного пятна, образованного мутантом 5, и исследуете их рост. Фаги из пятна с фагом дикого типа образуют нормальные бляшки и на Е. coli В, и на Е. coli К, как и ожидалось. Большинство фагов из пятна, образованного мутантом 5, ведут себя по-прежнему как мутанты: они образуют r -бляшки на Е. coli В, но не растут на Е. coli К. Однако некоторые фаговые частицы из пятна, образованного мутантом 5, по-видимому, относятся к дикому типу: они образуют нормальные бляшки на обоих штаммах Е. coli. Частота встречаемости фагов дикого типа слишком высока, чтобы она могла определяться обратным мутированием (обращением мутации), которое происходит, но с частотой всего от 10-5 до 10-6. A. Почему некоторые смеси мутантных фагов растут в кружках, а другие нет? Б. Какую картину роста следует ожидать, если повторить тест с кружками, используя Е. coli, зараженную мутантом 3? B. Насколько возросла небольшая фракция фага Т4 дикого типа в прозрачном пятне, образованном мутантом 5?
Рис. 38. Тест с кружками для разных rn-мутантов. 23. Клетки Е. coli растут на моносахариде глюкозе быстрее, чем в дисахариде лактозе, по двум причинам: 1) лактоза поглощается медленнее, чем глюкоза, и 2) для того чтобы лактоза использовалась клетками, она должна быть сначала гидролизована (бета-галактозидазой до глюкозы и галактозы. Если Е. coli выращивать на среде, содержащей одновременно глюкозу и лактозу, то кривая роста будет иметь сложную форму (рис. 39, квадратики). Вначале бактерия растет с большей скоростыо. чем в конце периода роста, а между этими двумя фазами роста наблюдается период задержки, когда рост практически останавливается. Определение концентрации глюкозы и лактозы в среде показывает, что после нескольких циклов деления клеток содержание глюкозы резко снижается (рис 39, кружки), а концентрация лактозы остается высокой почти до конца. Хотя концентрация лактозы остается высокой в течение всего эксперимента, однако ген Бета-галактозидазы, регулируемый как часть lac-оперона, индуцируется только через 100 мин (рис. 39. треугольники). А. Объясните, почему кривая роста бактерий в этом эксперименте имеет такую форму. Учтите быстрый начальный рост, замедление роста в конце и остановку роста в середине опыта. Б. Объясните, почему lac-оперон не индуцируется лактозой во время короткой начальной фазы роста бактерий.
Рис. 39. Рост Е coli на среде с глюкозой и лактозой 24. На рис. 40 приведены четыре возможные ситуации локализации в зоне промотора Lac-оперона белка CAP и Lac-репрессора. Каждая ситуация соответствует определенному соотношению в клетке глюкозы и лактозы. Для каждой из четырех комбинаций укажите, какие сахара должны присутствовать в клетке, и состояние при этом Lac-оперона (вкл/выкл).
Рис. 40 25. Представьте себе, что вы создали рекомбинантный ген, состоящий их фрагмента триптофанового оперона (кодирует ферменты, осуществляющие биосинтез триптофана) и фрагмента Lac-оперона (кодирует ферменты, необходимые для утилизации лактозы) (Рис. 41). При каком сочетании условий (А-Е) будет происходить экспрессия b-галактозидазы в клетках, несущих такой рекомбинантный оперон?
А. Только при отсутствии глюкозы и лактозы Б. Только при наличие глюкозы и лактозы В. Только когда есть глюкоза, но нет лактозы Г. Только когда есть лактоза, но нет глюкозы Д. Только в присутствие триптофана Е. Только при отсутствии триптофана
Рис. 41 26. В отсутствии глюкозы E. coli может расти на арабинозе (пентоза), используя набор индуцибельных генов, расположенных на хромосоме тремя группами. В одном из таких сайтов гены araA, araB и araD кодируют ферменты, участвующие в метаболизме арабинозы, тогда как ген araC кодирует белок-регулятор, связывающийся неподалеку от промотора арабинозных генов и координирующий экспрессию генов, входящих в арабинозный оперон. Две другие группы генов кодируют белки, участвующие в транспорте арабинозы. Для изучения регуляторных свойств белка araC вы получаете мутантную бактерию, у которой ген araC делетирован. Как показано в таблице, мутантный штамм при добавлении в среду арабинозы не экспрессирует продукт гена araА.
генотип продукт гена araA в отсутствие арабинозы в присутствии арабинозы
araC + 1 1000 araC - 1 1
· Можно ли по данным таблицы судить о том, негативную или позитивную регуляцию арабинозного оперона осуществляет белок araC? · Как выглядели бы цифры в таблице, если бы белок осуществлял регуляцию противоположного типа? 27. Вы выделили из культуры бактерий антибиотик эдеин. Он ингиби-рует синтез белка, но не затрагивает ни синтеза ДНК, ни синтеза РНК. При добавлении эдеина к лизату ретикулоцитов синтез белка прекращается спустя некоторое время, как показано на рис. 42. В отличие от этого циклогексимид останавливает синтез белка сразу после добавления. Анализ лизата после ингибирования эдеином, проведенный методом центрифугирования в градиенте плотности сахарозы, показал, что после остановки синтеза белка в лизате не оставалось полирибосом. Вместо них вся мРНК глобина накапливалась в аномальном пике 40S, содержащем также эквимолярные количества малых субъединиц рибосом и инициа-торную тРНК. A. Какой этап в синтезе белка ингибирует эдеин? Б. Почему синтез белка прекращается не сразу после добавления эдеина? От чего зависит длительность этой задержки? B. Следует ли ожидать исчезновения полирибосом, если вы добавите одновременно с эдеином циклогексимид?
Рис. 42 28. Для выделения чистых транскрипционных факторов была разработана следующая система: промотор и подшитая к нему последовательность длиной 400 п. о., не содержащая ни одного цитозина. Если исследуемая смесь не содержит GTP (при этом CTP, UTP и ATP присутствуют), единственный длинный РНК-транскрипт считывается с этой синтетической последовательности, поскольку транскрипция любых других последовательностей терминируется, как только необходимо вставить в цепь G. Эта система позволяет быстро количественно оценить прохождение специфической транскрипции путем измерения встраивания в длинный транскрипт нуклеотидов, меченных радиоактивными изотопами. Чтобы проверить, хорошо ли сработает эта система были сконструированы две плазмиды с такой искусственной последовательностью: одна с промотором аденовируса (pML1) и другая, без промотора (pC1) (Рис 43А). Каждую плазмиду смешивали с очищенной РНК-полимеразой II, транскрипционными факторами, UTP, ATP и 32P- CTP. Кроме того, добавляли в различных комбинациях GTP, РНКазу Т1 (которая расщепляет РНК вблизи каждого G) и 3’-O-метил-GTP, на котором транскрипция терминируется, как только он встает напротив С. Продукты разделяли на электрофорезе в геле (Рис. 43В). А. Почему продукт длиной 400 п.о. отсутствует в дорожке 4, но присутствует в дорожках 2, 6 и 8? Б. Можете ли вы объяснить наличие продукта в дорожке 3, соответствующей плазмиде без промотора? В. Почему транскрипт длиной примерно 400 п.о. присутствует в дорожке 5, но его нет в дорожке 7? Г. Эта система была разработана для очистки транскрипционных факторов. Однако процесс очистки начинают с грубых клеточных экстрактов, содержащих GTP. Каким образом можно исследовать специфическую транскрипцию в таких экстрактах?
Рис. 43. (А) Карты плазмид. (В) Результат гель-электрофореза продуктов, полученных в разных условиях. Все смеси содержали РНК-полимеразу II, транскрипционные факторы, UTP, ATP и 32P- CTP. Остальные компоненты перечислены над каждой дорожкой. 29. C-концевой домен большой субъединицы РНК-полимеразы II дрожжей состоит из 27 почти идеальных повторов последовательности YSPTSPS. Если в клетке вместо нормального гена содержится мутантная последовательность, кодирующая С-концевой домен только с 11 повторами, то такие клетки будут жизнеспособными при 30°С, но не смогут расти при 12°С. Такая температурная чувствительность позволяет отбирать ревертантные штаммы по их способности расти на 12°С. Оказалось, что некоторые из ревертантов имеют доминантную мутацию в гене Srb2. В экстрактах из дрожжевых клеток, не имеющих гена Srb2, добавленные ДНК матрицы не могут быть транскрибированы, но их можно активировать для транскрипции путем добавления белка Srb2.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 1480; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.245.196 (0.114 с.) |



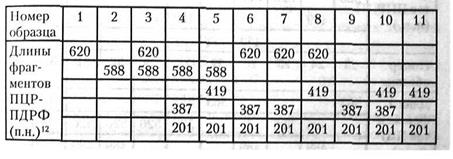 Рис. 24
Рис. 24
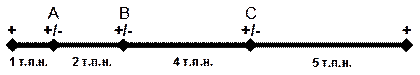


 Рис. 27. Рестрикционные карты генов зрительных пигментов А-типа и В-типа. Экзоны обозначены маленькими светлыми прямоугольниками. Участки ПДРФ, выявленные при обработке Rsal, обозначены под генами. E-EcoRI, B-BamHI, H-HindIII, S - Sail.
Рис. 27. Рестрикционные карты генов зрительных пигментов А-типа и В-типа. Экзоны обозначены маленькими светлыми прямоугольниками. Участки ПДРФ, выявленные при обработке Rsal, обозначены под генами. E-EcoRI, B-BamHI, H-HindIII, S - Sail.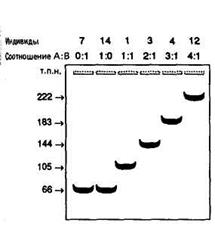


 Рис.32. Субстраты, использованные для определения свойств dnaB (задача 5-26). А -субстрат 1, Б- субстрат 2, В -субстрат 3.
Рис.32. Субстраты, использованные для определения свойств dnaB (задача 5-26). А -субстрат 1, Б- субстрат 2, В -субстрат 3.


 Рис. 37. Четыре перекрывающихся гена в фХ174 и соответствующая им мРНК. Пунктирными линиями отмечены две области, где перекрываются три гена.
Рис. 37. Четыре перекрывающихся гена в фХ174 и соответствующая им мРНК. Пунктирными линиями отмечены две области, где перекрываются три гена.









