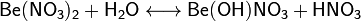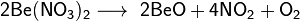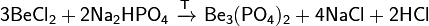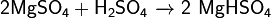Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Берилий и Магний.Распространение.Способы добыванияСтр 1 из 12Следующая ⇒
Оксиды бериллия и магния Окси́д бери́ллия — амфотерный оксид, имеющий химическую формулу BeO. В зависимости от способа получения, при стандартных условиях, оксид бериллия представляет собой белое кристаллическое или аморфное вещество без вкуса и запаха, очень малорастворимое в воде. Растворяется в концентрированных минеральных кислотах и щелочах, хорошо растворим в щелочных расплавах.[2][3] Оксид бериллия является единственным бинарным соединением бериллия с кислородом, хотя в паровой фазе над ВеО при температуре около 2000°С было отмечено присутствие полимеров типа (ВеО)3 и (ВеО). Химические свойства Реакционная способность оксида бериллия зависит от способа его получения и от степени прокаливания. Повышение температуры при прокаливании ведет к увеличению размера зерен (то есть к уменьшению удельной поверхности), а, следовательно, и к уменьшению химической активности соединения. Прокаленный при температуре не выше 500°С, оксид бериллия растворяется в водных растворах кислот и щелочей (даже разбавленных), образуя соответствующие соли и гидроксобериллаты. Например: BeO+2NaOH BeO+2HCl Оксид бериллия, прокаленный при температуре от 1200 до 1300°С растворим в растворах концентрированных кислот. Например, прокаленный таким образом ВеО реагирует с горячей концентрированной серной кислотой: BeO+ Прокаливание оксида бериллия при температурах выше 1800° С приводит к практически полной утрате им реакционной способности. После такого прокаливая ВеО растворяется только в концентрированной плавиковой кислоте (с образованием фторида) и в расплавленных щелочах, карбонатах и пиросульфатах щелочных металлов (с образованием бериллатов) BeO+2HF BeO+2NaOH BeO+
Выше 1000°С оксид бериллия реагирует с хлором, при этом в присутствии угля данная реакция идет легче и при гораздо меньших температурах (600—800°С):[2] 2BeO+2 BeO+ При температуре выше 1000°С оксид бериллия ступает в обратимую реакцию гидрохлорирования (понижение температуры системы вызывает обратный процесс разложения образовавшегося хлорида бериллия) BeO+2HCl При нагревании оксид бериллия способен реагировать со многими хлорсодержащими соединениями. В частности уже при 500°С начинается реакция с фосгеном
BeO+CO Хлорирование тетрахлорметаном протекает при температуре 450—700°С:[2] 2BeO+ Гораздо труднее оксид бериллия взаимодействует с бромом, сведений же о взаимодействии ВеО с иодом нет. Оксид бериллия реагирует далеко не всеми обычно применяемыми восстановителями. В частности, для восстановления бериллия из оксида применимы лишь кальций, магний, титан и уголь (при высокой температуре). Кальций и магний могут быть использованы в качестве восстановителя при температуре ниже 1700°С и атмосферном давлении, титан применим при давлении ниже 0,001 мм рт. ст. и 1400°С. BeO+Ca 4BeO+Ti В обоих случаях бериллий получается загрязненным, так как технически очень трудно разделить продукты реакции.
Использование угля более предпочтительно, но реакция с ним идет лишь при температурах выше 2000°С: BeO+C Оксид бериллия при температурах ниже 800°С устойчив по отношению к расплавленным щелочным металлам (литию, натрию и калию) и почти совсем не реагирует с церием, платиной, молибденом, торием и железом; только при 1800° взаимодействует с никелем, кремнием, титаном и цирконием. Окси́д ма́гния (жжёная магнезия, периклаз) — химическое соединение с формулой MgO, белые кристаллы, нерастворимые в воде, пожаро- и взрывобезопасен. Основная форма — минерал периклаз. Химические свойства Легко реагирует с разбавленными кислотами и водой с образованием солей и Mg(OH)2 MgO+2HCl MgO+ Получение Сульфат бериллия может быть получен взаимодействием в водном растворе любой соли бериллия с серной кислотой с последующим выпариванием и кристаллизацией продукта реакции. Получаемый гидрат может быть разложен на воду и безводную соль при нагревании до 400 °C[4]. Нитрат бериллия — химическое соединение с формулой Be(NO3)2. Представляет собой среднюю соль бериллия и азотной кислоты.
Химические свойства Вступает в большинство обменных реакций, свойственных другим нитратам. С карбонатами и сульфидами щелочных металлов и аммония реагирует с образованием гидроксида бериллия:
Нитрат бериллия в водных растворах частично гидролизируется с образованием основного нитрата:
При нагревании в вакууме возгоняется,образуя летучий оксонитрат[1]:
Термическое разложение Be(NO3)2 происходит при 1000°С, при этом образуется оксид бериллия, кислород и оксиды азота:
Фосфат бериллия — неорганическое соединение, кислая соль металлабериллия и ортофосфорной кислоты с формулой Be3(PO4)2, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты. Получение: обработка растворов солей бериллия избытком раствора гидрофосфата натрия Карбонат магния, магний углекислый, MgCO3 — магниеваясоль угольной кислоты. Свойства Белые кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Мg(HCO3)2. Из водных растворов в отсутствие избытка CO2выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли, к которым относится и природный минерал доломит MgCO3·CaCO3. Сульфат магния — неорганическое вещество, соль металла магния и серной кислоты с формулой MgSO4, белый порошок, образует несколько кристаллогидратов. В медицине используется при лечении ожирения как солевое слабительное, для достижения так называемого магниевого стресса. Химические свойства · При нагревании выше температуры плавления разлагается:
· С концентрированной серной кислотой образует гидросульфаты:
при нагревании выпадают сольваты состава MgSO4•H2SO4 и MgSO4•3H2SO4. · При нагревании взаимодействует с сероводородом, двуокисью кремния, углеродом:
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой (а = 0,748 нм, пространств. группа Ра3); температура плавления 426 °C (с разложением); С°р 141,9 Дж/(моль. К); DH0обр −792,8 кДж/моль, DG0обр −591,4 кДж/моль. Выше 300 °C начинает разлагаться на MgO и оксиды азота. Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты. Магния нитрат образует с N2O4 аддукт состава Mg(NO3)2.N2O4, разлагающийся выше 50 °C, а также аммины [Mg(NH3)J(NO3)2 и двойные соли с нитратами др. металлов. Безводный магния нитрат получают взаимодействием Mg с N2O4 с последующим отщеплением N2O4, гидратированный — реакцией MgCO3 или MgO с разбавлением HNO3. Гексагидрат — исходное соединение при синтезе MgO особой чистоты, нитратов др. металлов, а также разложении соединений Mg Ортофосфат магния — неорганическое соединение,соль магния и ортофосфорной кислоты с формулой Mg3(PO4)2. Бесцветные кристаллы почти не растворимые в воде. Образует несколько кристаллогидратов. Нахождение в природе Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/литр. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит(BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр. Ра́дий — элемент главной подгруппы второй группы, седьмого периодапериодической системы химических элементов Д. И. Менделеева, с атомным номером 88. Обозначается символом Ra (лат. Radium). Простое вещество радий (CAS-номер: 7440-14-4) — блестящий щёлочноземельный металл серебристо-белого цвета, быстро тускнеющий на воздухе. Обладает высокой химической активностью. Радиоактивен; наиболее устойчив нуклид 226Ra (период полураспада около 1600 лет). Нахождение в природе Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226. Весь природный радий является радиогенным — возникает при распадеурана-238, урана-235 или тория-232; из четырёх найденных в природе наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238. В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468·109 лет)/(1602 года)=2,789·106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия или 1,02 мкг/т (кларк в земной коре). Химические свойства Взаимодействие ионных гидридов с водой: Получение Ионные гидриды получают взаимодействием простых веществ: Галогени́ды (галоиды) — соединения галогенов с другими химическими элементами или радикалами. При этом галоген, входящий в соединение, должен быть электроотрицательным; так, оксид брома не является галогенидом. По участвующему в соединении галогену галогениды также называются фторидами, хлоридами, бромидами,иодидами и астатидами. Наиболее известны под этим названием галогениды серебра благодаря массовому распространению плёночной галогеносеребряной фотографии.
Соединения галогенов между собой называются интергалогенидами, или межгалоидными соединениями (например,пентафторид иода IF5). В галогенидах галоген имеет отрицательную степень окисления, а элемент — положительную. Сульфиды: · Неорганические сульфиды — бинарные соединения элементов с серой (S), где она имеет степень окисления −2. · Органические сульфиды (тиоэфиры) — соединения общей формулы R'-S-R, где R' и R — органические радикалы. · Нитриды — соединения азота с менее электроотрицательными элементами, например, с металлами (AlN;TiNx;Na3N;Ca3N2;Zn3N2; и т. д.) и с рядом неметаллов (NH3, BN, Si3N4). · Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Получение Нитриды ионного типа получаются при взаимодействии металлов с азотом при температурах 700—1200 °C. Другие нитриды можно получить взаимодействием металла с азотом или аммиаком или восстановлением оксидов, хлоридов металла углеродом в присутствии азота или аммиака при высоких температурах. Нитриды образуются также в плазме в дуговых, высокочастотных и сверхвысокочастотных плазмотронах. В последнем случае нитриды образуются как ультрадисперсные порошки с размером частиц 10-100 нм. Химические свойства Нитриды ионного типа легко разлагаются водой и кислотами, проявляя основные свойства:
Нагревание нитридов элементов V, VI и VIII групп приводит к их разложению с выделением азота, низших нитридов и твердых растворов азота в металлах. Нитриды бора, кремния, алюминия, индия, галлия и переходных металлов IV группы при нагревании в вакууме не разлагаются. Окисление нитридов кислородом приводит к образованию оксидов металлов и азота. Взаимодействие нитридов с углеродом приводит к карбидам и карбонитридам. Карби́ды — соединения металлов и неметаллов с углеродом. Традиционно к карбидам относят соединения, где углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и т.п.) Свойства Карбиды — тугоплавкие твёрдые вещества, не растворимы[ источник не указан 1764 дня ] ни в одном из известных растворителей. Карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью. Берилий и Магний.Распространение.Способы добывания Бери́ллий — элемент главной подгруппы второй группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 4. Обозначается символом Be (лат. Beryllium). Высокотоксичный элемент. Простое вещество бериллий (CAS-номер: 7440-41-7) — относительно твёрдый металл светло-серого цвета, имеет весьма высокую стоимость.
Среднее содержание бериллия в земной коре 3,8 г/т и увеличивается от ультраосновных (0,2 г/т) к кислым (5 г/т) и щелочным (70 г/т) породам. Основная масса бериллия в магматических породах связана с плагиоклазами, где бериллий замещает кремний. Однако наибольшие его концентрации характерны для некоторых тёмноцветных минералов и мусковита (десятки, реже сотни г/т). Если в щелочных породах бериллий почти полностью рассеивается, то при формировании кислых горных пород он может накапливаться в постмагматических продуктах — пегматитах и пневматолито-гидротермальных телах. В кислых пегматитах образование значительных скоплений бериллия связано с процессами альбитизации и мусковитизации. В пегматитах бериллий образует собственные минералы, но часть его (ок. 10 %) находится в изоморфной форме в породообразующих и второстепенных минералах (микроклине, альбите, кварце, слюдах, и др.). В щелочных пегматитах бериллий устанавливается в небольших количествах в составе редких минералов: эвдидимита, чкаловита, анальцима и лейкофана, где он входит в анионную группу. Постмагматические растворы выносят бериллий из магмы в виде фторсодержащих эманаций и комплексных соединений в ассоциации с вольфрамом, оловом, молибденом и литием. Содержание бериллия в морской воде чрезвычайно низкое — 6·10−7 мг/л.[5] Известно более 30 собственно бериллиевых минералов, но только 6 из них считаются более-менее распространёнными: берилл, хризоберилл, бертрандит, фенакит, гельвин, даналит. Промышленное значение имеет в основном берилл, в России (Республика Бурятия) разрабатывается фенакит-бертрандитовое Ермаковское месторождение. Разновидности берилла считаются драгоценными камнями: аквамарин — голубой, зеленовато-голубой, голубовато-зелёный; изумруд — густо-зелёный, ярко-зелёный; гелиодор — жёлтый; известны ряд других разновидностей берилла, различающихся окраской (темно-синие, розовые, красные, бледно-голубые, бесцветные и др.). Цвет бериллу придают примеси различных элементов. Месторождения минералов бериллия присутствуют на территории Бразилии, Аргентины, Африки, Индии, России (Ермаковское месторождение, Бурятия, Сибирь) и др. В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия: Be
В настоящее время бериллий получают, восстанавливая его фторид магнием: Be либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды. Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета. Кларк магния 19 кг/т. Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде. Главными видами нахождения магнезиального сырья являются: морская вода — (Mg 0,12-0,13 %), карналлит — MgCl2 • KCl • 6H2O (Mg 8,7 %), бишофит — MgCl2 • 6H2O (Mg 11,9 %), кизерит — MgSO4 • H2O (Mg 17,6 %), эпсомит — MgSO4 • 7H2O (Mg 16,3 %), каинит — KCl • MgSO4 • 3H2O (Mg 9,8 %), магнезит — MgCO3 (Mg 28,7 %), доломит — CaCO3·MgCO3 (Mg 13,1 %), брусит — Mg(OH)2 (Mg 41,6 %). Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения ископаемых солей карналлита осадочного происхождения известны во многих странах. Магнезит образуется преимущественно в гидротермальных условиях и относится к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они ассоциируют с карбонатными толщами и большинство из них имеет докембрийский или пермский возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод. Природные источники магния: ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные карбонаты: доломит, магнезит), морская вода, рассолы (рапа соляных озёр). Большая часть мировой добычи магния сосредоточена в США (43 %), странах СНГ (26 %) и Норвегии (17 %), возрастает доля Китая.
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния: MgCl2 (электролиз) = Mg + Cl2. Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше. Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс: MgO + C = Mg + CO Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции: CaCO3·MgCO3 = CaO + MgO + 2CO2, 2MgO + CaO + Si = CaSiO3 + 2Mg. Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 268; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.13.173 (0.057 с.) |
 [Be(
[Be( ]
] Be
Be  +
+  O
O Be
Be  +
+  +
+  +
+  +
+ 
 +
+ 
 +
+  2Be
2Be  +
+