
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Схема экспериментальной установки. ⇐ ПредыдущаяСтр 2 из 2
Синтез фенолоформальдегидной смолы проводится на установке, описанной в лабораторной работе №4 (рис. 4.1), но без капельной воронки (5)
Методика выполнения работы. Расчет исходных реагентов ведется на 20 – 30 г фенола. Фенол и формалин, взятые для получения новолачной смолы в молярном отношении фенол: формальдегид, равном 1,15, смешиваются в колбе при комнатной температуре. После растворения фенола в колбу вводится катализатор (соляная кислота в количестве 1% от массы фенола). Колба соединяется с обратным холодильником и нагревается на водяной бане при включенной мешалке до температуры 90 – 95 оС. Реакция ведется до тех пор, пока выделившийся водяной слой не перестанет изменяться в объеме. Следует учесть, что при быстром нагревании смеси после введения катализатора может происходить вспенивание и выбрасывание реакционной массы из колбы. Поэтому необходимо наблюдать за интенсивностью процесса. Если реакция протекает бурно и жидкость начинает сильно кипеть, необходимо прекратить нагрев и убрать водяную баню. Реакция продолжается некоторое время без нагрева (за счет тепла реакции конденсации). Когда бурная реакция закончится, колба снова нагревается на водяной бане до тех пор, пока смесь не разделится на два устойчивых слоя. По окончании процесса нагревание прекращается, верхний водный слой после отстаивания сливается из колбы, а смола быстро (до остывания) переливается в фарфоровую чашку и сушится сначала на водяной бане, затем на песчаной бане при температуре не выше 130 оС. Сушка прекращается, когда застывшая на палочке капля смолы будет легко размельчаться. Высушенная смола взвешивается.
Методика обработки экспериментальных данных Выход смолы в расчете на 1 моль формальдегида, взятого для опыта, определяется по формуле:
где
В соответствии с формулой новолачной смолы из (5.1) ее молярная масса составляет:
С другой стороны Решая совместно уравнения (5.5) и (5.6), можно определить среднюю молекулярную массу смолы и степень полимеризации:
Техника безопасности. 1. Установка для синтеза должна располагаться в вытяжном шкафу.
2. При приготовлении смеси исходных реагентов необходимо пользоваться резиновыми перчатками. 3. Работающую установку нельзя оставлять без присмотра. При бурном протекании реакции необходимо прекратить нагрев и убрать баню. 4. Сушку смолы проводить в вытяжном шкафу на песочной бане при непрерывном перемешивании. 5.7 Контрольные вопросы 1. Что такое пластмассы? Назовите основные компоненты, входящие в состав пластмасс. 2. Методы получения синтетических смол. 3. Основные группы поликонденсационных смол. 4. Термопластичные и термореактивные смолы. 5. Феноло-формальдегидные смолы. Основные виды этих смол. 6. Новолачные смолы, условия их получения и свойства. 7. Резольные смолы, их разновидности, условия получения и свойства.
Литература. 1. Мухленов И,П. и др. Общая химическая технология, ч. 2. – М.: Высшая школа, 1984, с.213 – 222. 2. Мухленов И.П. и др. Практикум по общей химической технологии. - М.: Высшая школа, 1973, с.174 – 185. 3. Николаев А.Ф. Технология пластических масс. – Л.: Химия, 1977, с. 418 – 430.
Лабораторная работа» № 6 Ионообменное умягчение воды Цель работы Ознакомиться с процессом ионообменного умягчения воды, определить эффективность умягчения.
Теоретические сведения Вода чрезвычайно широко используется в различных производствах химической промышленности. В ряде производств она является сырьем и реагентом, непосредственно участвующим в основных химических реакциях, например, в производстве водорода, серной и азотной кислот, щелочей, в реакциях гидратации и гидролиза. В некоторых производствах вода образуется в качестве побочного продукта, например, при пиролизе топлива, сжигании топлива, окислении аммиака и др. Во многих производствах вода используется в качестве растворителя. Во всех этих случаях вода применяется непосредственно для технологических целей. В еще больших количествах вода используется как теплоноситель или хладоагент, т.е. для подогрева исходных реагентов, подвода или отвода тепла из химических реакторов, охлаждения продуктов реакций.
Вода является хорошим растворителем, поэтому природные воды обычно содержат различные примеси. Природные воды по происхождению делятся на три вида, сильно отличающиеся по содержанию примесей. Атмосферная вода – вода, выпадающая на поверхность земли в виде атмосферных осадков, в основном в виде дождя и снега. Это наиболее чистая вода, содержащая в растворенном виде газы, присутствующие в воздухе: кислород, азот, углекислый газ. В промышленных районах атмосферная вода может содержать также газы промышленного происхождения, например, сероводород, оксиды азота, серы, а также органические соединения. Поверхностные воды – воды рек, озер, морей и других природных водоемов. Кроме примесей, содержащихся в атмосферной воде, они содержат различные соли, главным образом сульфаты, хлориды, карбонаты щелочных и щелочноземельных металлов, а также органические соединения, которые являются продуктами жизнедеятельности живых организмов. Органические примеси часто придают воде желтоватую окраску. Подземные воды – воды, образующиеся при просачивании атмосферных и поверхностных вод через водопроницаемые слои горных пород и скапливающиеся в подземных резервуарах. Они могут выходить на поверхность земли в виде источников, ключей или добываться из колодцев, артезианских скважин. Подземные воды характеризуются разнообразием состава растворенных солей, высокой прозрачностью и практически полным отсутствием органических примесей. Подземные воды с высокой концентрацией растворенных солей (так называемые минеральные воды) используются как сырье для химической промышленности, а также в лечебных целях. Воды всех видов содержат также различные количества микроорганизмов. На крупных химических предприятиях расход воды измеряется миллионами кубических метров в сутки, при этом каждое предприятие предъявляет свои требования к качеству воды, которое определяется наличием в нейрастворенных, коллоидных и механических примесей. Вредность примесей связана с их химическим составом, дисперсным состоянием, а также с технологией производства, использующего воду. Грубодисперсные механические взвеси засоряют трубопроводы и аппараты. Коллоидные примеси засоряют диафрагмы электролизеров, вызывают вспенивание воды и перебросы воды в котлах и аппаратах. Растворенные соли образуют накипь на теплообменных поверхностях, усиливают коррозию металлов. В большинстве случаев основным качественным показателем является жесткость воды, обусловленная присутствием в воде растворенных солей кальция и магния. Жесткость воды подразделяется на временную и постоянную. Временная (или карбонатная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые нормальные или основные карбонаты, выпадающие в осадок.
Постоянная жесткость создается всеми другими растворимыми солями кальция и магния, чаще всего сульфатами и хлоридами, которые остаются при кипячении воды в растворенном состоянии. Сумма временной и постоянной жесткости дает общую жесткость. Жесткость воды выражается в миллиэквивалентах ионов кальция и магния, содержащихся в 1 дм3 воды (мэкв/дм3). Принята следующая классификация природных вод по жесткости:
жесткость водыкласс жесткости 0 – 1,5 очень мягкая 1,5 – 3 мягкая 3 – 6 умеренно жесткая 6 – 10 жесткая >10 очень жесткая
Промышленная водоподготовка представляет собой комплекс операций, обеспечивающих очистку воды от механических, коллоидных и растворенных примесей. От механических примесей вода освобождается отстаиванием или фильтрацией через слой песка или гравия. Удаление коллоидных примесей и осветление воды достигается коагуляцией при добавлении коагулянтов, например, сульфата алюминия или сульфата железа. Умягчение воды, т.е. удаление из нее солей кальция и магния, осуществляется химическими и физико-химическими методами. Сущность химических методов заключается в добавлении к воде реагентов, переводящих ионы кальция и магния в нерастворимые соединения. Известковый метод (добавление извести) используется для устранения временной жесткости.
Содовый метод (добавление соды) используется для устранения постоянной жесткости.
Так как в воде обычно присутствует как временная, так и постоянная жесткость, то используется чаще всего сочетание этих методов. Известково-содовый метод однако позволяет производить лишь грубое умягчение воды примерно до 0,3 мэкв/дм3. Более тонкую очистку (до 0,03 мэкв/дм3) обеспечивает фосфатный метод (добавление фосфата натрия). Это объясняется меньшей растворимостью фосфатов кальция и магния по сравнению с карбонатами.
Из физико-химических методов умягчения воды широко используется ионообменный метод. Иониты – это твердые вещества, способные обменивать свои ионы на ионы, содержащиеся в воде. В зависимости от знака заряда обменивающихся ионов иониты делятся на катиониты и аниониты. В качестве катионитов могут использоваться сульфоуголь или высокомолекулярные смолы, содержащие активные группы с ионами
Таким же образом извлекаются из воды ионы других металлов. В качестве анионитов используются высокомолекулярные смолы, содержащие активные группы с ионами
Реакции ионного обмена обратимы и для восстановления обменной способности ионитов проводится процесс регенерации. Регенерация
|
||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 115; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.114.125 (0.023 с.) |
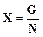 , (5.4)
, (5.4)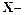 выход смолы на 1 моль формальдегида (г),
выход смолы на 1 моль формальдегида (г),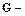 масса полученной смолы (г),
масса полученной смолы (г),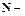 количество вещества формальдегида, взятого для опыта (моль).
количество вещества формальдегида, взятого для опыта (моль). . (5.5)
. (5.5) . (5.6)
. (5.6)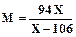 , (5.7)
, (5.7) . (5.8)
. (5.8)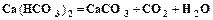 , (6.1)
, (6.1)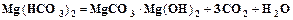 . (6.2)
. (6.2)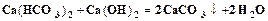 , (6.3)
, (6.3)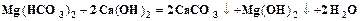 . (6.4)
. (6.4) . (6.5)
. (6.5) . (6.6)
. (6.6) . (6.7)
. (6.7) . (6.8)
. (6.8) В основе катионного процесса умягчения воды лежат реакции обмена ионов
В основе катионного процесса умягчения воды лежат реакции обмена ионов  или
или  , входящих в состав катионита, на ионы
, входящих в состав катионита, на ионы  или
или  , содержащиеся в воде.
, содержащиеся в воде. (6.9)
(6.9) (6.10)
(6.10) (6.11)
(6.11) (6.12)
(6.12) Пропуская через слой анионита воду, предварительно освобожденную от катионов, можно извлечь из нее анионы, полностью обессоливая воду.
Пропуская через слой анионита воду, предварительно освобожденную от катионов, можно извлечь из нее анионы, полностью обессоливая воду.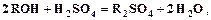 (6.13)
(6.13)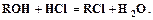 (6.14)
(6.14) катионитов осуществляется раствором
катионитов осуществляется раствором 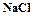 , а
, а  катионитов растворами кислот. Аниониты регенерируются растворами щелочей, гидрокарбоната или карбоната натрия.
катионитов растворами кислот. Аниониты регенерируются растворами щелочей, гидрокарбоната или карбоната натрия.


