
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Простейшим представителем аминокислот является аминоуксусная кислота (глицин).Стр 1 из 4Следующая ⇒
Простейшим представителем аминокислот является аминоуксусная кислота (глицин). Классификация аминокислот: 1. по химической природе радикала аминокислоты подразделяют: - на алифатические; - ароматические; - гетероциклические 2. по общему числу карбоксильных и аминогрупп аминокислоты подразделяют: - на нейтральные (моноаминомонокарбоновые); - основные (диаминомонокарбоновые); - кислые (моноаминодикарбоновые) 3. алифатические аминокислоты в зависимости от положения аминогруппы по отношению к карбоксилу подразделяют: на α -, β -, γ -, δ – аминокислоты и т.д. В организме все многообразие белков и пептидов построено из α-аминокислот. Общее количество аминокислот около 70, причем, около 20 из них являются наиболее важными и встречаются во всех белках. Некоторые аминокислоты являются незаменимыми (валин, лейцин, пролейцин, лизин, треонин, метионин, фенилаланин, триптофан) и обязательно должны поступать в организм с пищей. Acidum glutaminicum (Glutamic acid)
α (моноаминодикарбоновая кислота – кислая) β γ Acidum aminocapronicum (Aminocaproic acid) δ γ β α
(моноаминомонокарбоновая кислота - нейтральная) Aminalonum (Aminobutiric acid gamma) СПОСОБЫ ИДЕНТИФИКАЦИИ ФИЗИКО-ХИМИЧЕСКИЕ: 1. Удельное вращение (подлинность и оценка чистоты) УФ – спектры поглощения
λ, нм ХИМИЧЕСКИЕ СПОСОБЫ ИДЕНТИФИКАЦИИ α - аминокислот (ОБЩИЕ) 4. Реакции по карбоксильной группе: α - аминокислоты со щелочами образуют соли, а с катионами тяжелых металлов – внутрикомплексные соли.
5. Нингидриновая реакция (общая реакция на α – аминокислоты):
Затем к одной части продукта реакции - добавляют раствор нитропруссида натрия, появляется красно-фиолетовое окрашивание:
- к другой части – серную кислоту – выделяются сероводород и меркаптан, идентифицируемые по запаху:
ПЕНИЦИЛЛАМИН идентифицируют по реакции нингидриновой пробы:
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ 1. Ацидиметрия в среде ледяной уксусной кислоты (кислота аминокапроновая; кислота γ – аминомасляная). Растворитель – ледяная уксусная кислота; титрант – раствор хлорной кислоты; индикатор - кристаллический фиолетовый:
2. Алкалиметрия в водной среде (Кислота глутаминовая). Титрант – раствор едкого натра, индикатор БТС (бромтимоловый синий). Титруют до перехода окраски индикатора от жёлтой до синей:
К этой группе ЛВ относятся некоторые комплексообразующие соединения (комплексоны). Они взаимодействуют со многими двух – и трехвалентными ионами металлов и образуют легко растворимые в воде комплексоны, которые довольно быстро выводятся из организма с мочой. Особенно важно использовать это свойство комплексонов для детоксикации организма при отравлении солями тяжелых металлов. Одним из представителей данной группы ЛВ является ЭДТА в виде динатриево-кальциевой соли: Sodium Calcium Edetate (Tetacin – calcium, ЭДТА):
Подлинность: 1. Na+ - окрашивание пламени в жёлтый цвет (после смачивания графитовой палочки соляной кислотой. Соляная кислота гасит окрашивание пламени другими ионами, кроме натрия); - с цинкуранилацетатом; 2. Ca2+ - с оксалатом аммония. Эту реакцию проводят после идентификации ЭДТА-иона по реакции с солями свинца в присутствии калия иодида – см. ниже:
3. ЭДТА - ион идентифицируют по отсутствию осадка желтого цвета после добавления солей свинца и калия иодида:
Количественное определение Комплексонометрия: титрант - 0,05 Моль/л раствор Pb(NO3)2; в качестве буферного раствора используют разведенную HCl и гексаметилентетрамин (CH2)6N4; индикатор – ксиленоловый оранжевый (от лимонно-желтого до красного):
Хранение: в сухом защищенном от света месте. Применение: В качестве детоксицирующего средства при острых и хронических отравлениях солями Pb; Hg; Co; Cd; It; Ce; Th; U и других тяжелых металлов, так как он образует с ними малотоксичные водорастворимые соединения, быстровыводимые из организма. Однако нужно учитывать, что соединения перечисленных катионов с ЭДТА могут всасываться из ЖКТ, усиливая явление интоксикации.
Выпускают: 10% раствор для инъекций (в/в); таблетки по 0,5 г. # СТРУКТУРНЫЕ АНАЛОГИ ГАМК В результате поиска структурных аналогов ГАМК, обладающих психотропным действием, получен пирацетам, являющийся производным полностью гидрированного пятичленного гетероцикла пиррола - пирролидина:
Химические реакции: 1. Выделение NH3 при нагревании с NaOH
2. Образование индофенола при нагревании с гипохлоритом натрия:
Количественное определение: 1. Модифицированный метод Къельдаля Метод основан на разложении пирацетама с выделением аммиака при нагревании с раствором гидроксида натрия. Определение проводится в приборе для определения азота в органических соединениях (можно привести рисунок большого формата на лекции или на лабораторном занятии). В каждой части прибора происходят соответствующие химические реакции. 1.1. Колба Къельдаля:
Колба – приёмник
Титрование
2. ФЭК – метрия по реакции образования индофенола (см. качественные реакции) λ аналит = 630 нм Хранение: в сухом защищенном от света месте по списку Б. Применение: как психотропное (ноотропное) средство, т.е. влияющее на умственную деятельность мозга (мышление, обучение, память) при заболеваниях нервной системы, связанных с нарушением обменных процессов мозга и сосудистыми заболеваниями. Формы выпуска: таблетки (капсулы) по 0,4-0,8 г; 20% раствор для инъекций в ампулах. # ПРОИЗВОДНЫЕ ПРОЛИНА ВЭЖХ
ТСХ система: толуол – лед CH3COOH (3:1)
ГСО
1 2
Количественное определение: 1. Метод иодатометрии (каптоприл субстанция). Титрант – калия иодат в присутствии калия иодида; среда сернокислая; индикатор – крахмал (титруют до голубого окрашивания):
2. УФ – спектрофотометрия (λ = 212 нм) – каптоприл в таблетках. 3. ВЭЖХ – эналаприла малеат в таблетках
Хранение: по списку Б в сухом защищенном от света месте в плотно укупоренной таре. Каптоприл при t не выше 300С. Применение: гипотензивное средство при различных формах гипертонии и сердечной недостаточности в таблетках: Каптоприл – по 0,025; 0,05 и 0,1 г; Эналаприл – по 0,005; 0,01 и 0,02 г. Производные бис – (β –хлорэтил) - амина Производные фенилаланина
α
ИК – спектр 3. = -30 до –360 (в метаноле)
4. Реакция Фудживара используется для идентификации органических полигалогенсодержащих соединений. Её называют «пиридиновым тестом». Она основана на нагревании полигалогенида со смесью 10% раствора NaOH и пиридина:
6. Cl Атом хлора связан с углеродом непрочно, поэтому легко отщепляется при нагревании в вводно-спиртовой среде с раствором нитрата серебра и образует белый творожистый осадок хлорида серебра:
7. Производные бис – (β – хлорэтил) - амина идентифицируют по реакции нагревания с дихроматом калия. В результате образуются летучие альдегиды, которые окрашивают фильтровальную бумагу, смоченную нитропруссидом натрия, в синий цвет:
8. Фенилаланин в мелфалане идентифицируют как аминокислоту по реакции нингидриновой пробы (см. выше). При нагревании с нингидрином образуется продукт реакции, имеющий фиолетовое окрашивание:
Количественное определение: 1. Аргентометрия (потенциометрическое титрование): Метод основан на отщеплении хлорид-иона в результате минерализации при нагревании с раствором едкого натра. Затем избыток NaOH нейтрализуют раствором уксусной кислоты по фенолфталеину. Образовавшийся натрия хлорид титруют раствором AgNO3. Точку конца титрования устанавливают потенциометрически:
3. СФ – метрия - в лекарственных формах (таблетки):
4. ВЭЖХ - в лекарственных формах (таблетки) в системе: метанол – вода. Расчет по стандартному образцу: Sx Sст
Хранение: по списку А в хорошо укупоренной таре в сухом, прохладном месте, защищая от света. Простейшим представителем аминокислот является аминоуксусная кислота (глицин). Классификация аминокислот: 1. по химической природе радикала аминокислоты подразделяют: - на алифатические; - ароматические; - гетероциклические 2. по общему числу карбоксильных и аминогрупп аминокислоты подразделяют: - на нейтральные (моноаминомонокарбоновые); - основные (диаминомонокарбоновые); - кислые (моноаминодикарбоновые) 3. алифатические аминокислоты в зависимости от положения аминогруппы по отношению к карбоксилу подразделяют: на α -, β -, γ -, δ – аминокислоты и т.д.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 405; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.66.67 (0.039 с.) |
 α – аминоглутаровая кислота
α – аминоглутаровая кислота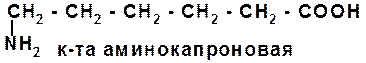
 Температура плавления или разложения
Температура плавления или разложения D
D Со свежеприготовленным раствором гидроксида меди (II) все α-аминокислоты образуют внутрикомплексные (хелатные) соли синего цвета:
Со свежеприготовленным раствором гидроксида меди (II) все α-аминокислоты образуют внутрикомплексные (хелатные) соли синего цвета: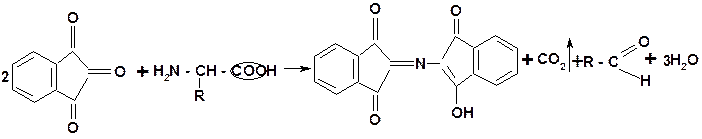









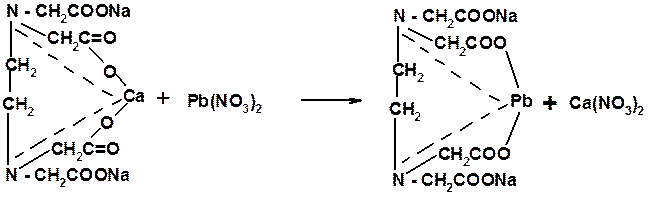

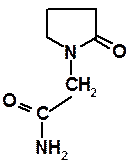


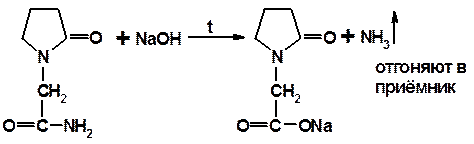



 1 – испытуемый образец
1 – испытуемый образец


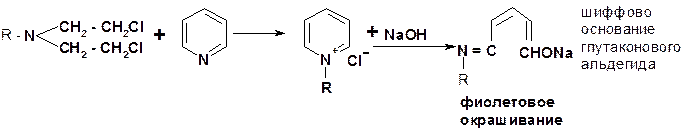 5. Проба Бейльштейна (на органически связанный галоген) – при внесении на медной проволоке в пламя горелки крупинки ЛВ оно окрашивается в зелёный цвет за счет образования галогенида меди.
5. Проба Бейльштейна (на органически связанный галоген) – при внесении на медной проволоке в пламя горелки крупинки ЛВ оно окрашивается в зелёный цвет за счет образования галогенида меди.

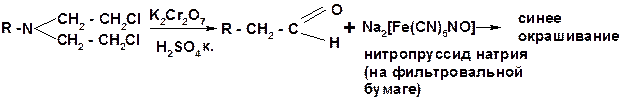



 2. Неводное титрование (ацидиметрия). Растворитель - диоксан; титрант – хлорная кислота:
2. Неводное титрование (ацидиметрия). Растворитель - диоксан; титрант – хлорная кислота:








