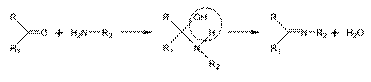Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пути биосинтеза фенольных соединений: шикиматный и ацетатно-малонатный.
Шикиматный путь (синтез В-кольца флавоноидов!) осуществляется в клетках микроорганизмов, грибов и растений. У высш.растений ключевые этапы проходят в пластидах, но гены ферментов локализованы в ядре. У животных нет ферментной системы шикиматного пути. Ферменты ш.п. локализуются в пластидах и в цитозоле. Далее дегидрохинная к-та превращается либо в дегидрошикимовую к-ту)), а потом в шикимовую к-ту(шикиматдегидрогеназа (1)), либо в хинную (хинатдегидрогенза (1)). Хоризмовая кислота служит непосредственным предшественником перфеновой и антраниловой кислот, которые используются для образования аминокислот и фенольных соединений: хоризмовая к-та -> префеновая к-та ->фенилаланин (через образование и аминирование фенилпировиноградной к-ты) или тирозин (через образование и аминирование оксифенилпировиноградной к-ты). С помощью ферментов аммиак-лиаз происходит дезаминирование образование транс-коричная и транс-гидрокоричная к-ты. Из коричных образуются оксикоричные кислоты и кумарины. При аминировании префеновой к-ты с помощью глутаминовой к-ты образуется арогеновая к-та, которая подвергается либо окислительному декарбоксилированию с образованием тирозина, либо гидратации и декарбоксилированию с образованием фенилаланина. Ацетатно-малонатный путь. Широко распространён у грибов, лишайников и микроорганизмов. У высших растений является минорным и реализуется в сочетании с шикиматным путём в биосинтезе флавоноидов и антрахинонов. (синтез А-кольца!)
Сборка флавоноида: кумароил-СоА взаимодействует с малонил-СоА и образует сначала халкон, а потом флаванон. Основная масса фенольных соединений происходит из гидроксикоричных кислот, кот. образуются из фенилаланина и тирозина, а также источниками фенолов являются хинная и шикимовая кислоты. Из них образуются фенольные кислоты и таннины. Гидроксикоричные к-ты образуют кумарины, меланины, участвуют в образовании лигнина и В-кольца флавоноидов. Флавоноиды – источники конденсированных таннинов.
2 8. Общая характеристика, применение, классификация и функции алкалоидов. Алкалоиды - гетерогенная группа азотсодержащих гетероциклических соединений основного характера, обладающих ярко выраженной физиологической активностью. Как правило, алкалоиды содержатся в растениях в виде солей яблочной, винной, лимонной и других кислот. В свободном виде они нерастворимы в воде, но растворяются в органических растворителях. По «модифицированной» химической классификации принято разделять алкалоиды на три подгруппы: \ – истинные алкалоиды (азот в составе гетероцикла); – протоалкалоиды (азот не в гетероцикле); – псевдоалкалоиды (синтез не из аминокислот). Параллельно с химической классификацией существует и биохимическая классификация. По ней алкалоиды подразделяются на подгруппы согласно исходной для их синтеза аминокислоте: – синтезирующиеся из L-орнитина (простые пирролидиновые алкалоиды, тропановые алкалоиды, пирролизидиновые алкалоиды); – из L-лизина (пиперидиновые алкалоиды, хинолизидиновые алкалоиды); – L-триптофана (сложные индольные алкалоиды, β-карболиновые алкалоиды); – L-фенилаланина (сложные изохинолиновые алкалоиды); – антраниловой кислоты (протоалкалоиды, хинолиновые алкалоиды, хиназолиновые алкалоиды); – L-тирозина (сложные изохинолиновые алкалоиды); – гистидина (пуриновые алкалоиды).
Пуриновые алкалоиды (небольшая группа):
Кофеин - оказывает возбуждающее действие на центральную нервную систему, усиливает сердечную деятельность, расширяет сосуды сердца и мускулатуру бронхов. Индольные алкалоиды (самая многочисленная группа из истиных): в молекулах этих алкалоидов индольное ядро часто сохраняет свою ароматическую структуру, но иногда оно может быть гидрировано, ацилировано по атому азота или оксидировано по пятичленному циклу. Часто в молекулу входят в качестве составляющих пиридиновые и пиперидиновые. Индольные алкалоиды синтезируются преимущественно растениями тропиков и субтропиков. Как правило, они очень токсичны. Стрихнин — сильный яд, но в малых дозах применяется в качестве тонизирующего и возбуждающего центральную нервную систему средства. Аймалин обладает антиаритмическим действием. Помимо них, в медицине используются и такие индольные алкалоиды, как физостигмин, эргоалкалоиды (алкалоиды спорыньи), алкалоиды кураре, раувольфии и др. Протоалкалоиды ( третичные растительные амины, немногочислены): Эфедрин выделен из некоторых видов эфедры. По химической структуре и физиологическому действию он сходен с адреналином. Расширяет бронхи, возбуждает дыхательный центр. Широко используется для лечения аллергических заболеваний. Капсаицин содержится в плодах и семенах стручкового перца и определяет их жгучий вкус. Используется в медицине в виде настойки стручкового перца и в виде перцового пластыря (в качестве местного возбуждающего средства). Псевдоалкалоиды (имеют «базовую структуру» молекулы, происходящую не из аминокислот, как у истинных алкалоидов, а из изопреноидов). Самую большую группу изопреноидных псевдоалкалоидов составляют С27-стероидные алкалоиды (гликоалкалоиды – находятся в растениях в виде гликозидов): соласодин, томатидин, соланидин; используются для синтеза гормональных препаратов типа кортизона. Функции алкалоидов: – выполняют роль резерва азота, накапливаясь при усиленном азотном питании; – могут служить транспортной формой азота; – синтез алкалоидов в корнях — один из механизмов снижения уровня токсичных аминокислот и аминов и обезвреживания аммиака; – связывая органические кислоты, осуществляют регуляцию рН клеточного сока; – участвуют в поддержании ионного баланса в растении (благодаря способности к хелатообразованию); – могут принимать участие в регуляции активности некоторых ферментов, а следовательно, оказывать воздействие на скорость метаболических процессов; – повышают устойчивость растений к патогенным грибам; – оказывают воздействие на процессы дифференцировки и органогенеза. Особенности биосинтеза алкалоидов. Исходные метаболиты. Биогенетическими предшественниками большинства алкалоидов (истинных и протоалкалоидов) являются аминокислоты: орнитин, лизин, фенилаланин, тирозин, триптофан, гистидин, аспарагиновая кислота и антраниловая кислота (синтез по шикиматному пути). Все эти аминокислоты, кроме антраниловой кислоты, являются протеиногенными. Никотиновая кислота может быть синтезирована из триптофана или аспарагиновой кислоты. *Псевдоалкалоиды носят в основном изопреноидный характер, и их биосинтез идет по пути образования терпеноидов. Азот вводится в неаминокислотный остаток.
Основными реакциями при биосинтезе являются декарбоксилирование и окислительное дезаминирование или переаминирование аминокислот и диаминов, первичное метилирование (направляет циклизацию, стабилизирует молекулу алкалоида и делает ее менее токсичной; ферменты - метилтрансферазы), трансметилирование, а также циклизация алифатических соединений-предшественников до гетеро- и карбоциклических структур + конденсация. Реакции циклизации, имеющие при образовании алкалоидов универсальное значение, очень разнообразны и могут совершаться через азометин с образованием основания Шиффа, по типу конденсации Манниха, путем альдольной конденсации, через форму лактамной связи и т. д. Образование оснований Шиффа Основания Шиффа могут быть получены в результате реакции аминов с кетонами или альдегидами. Данная реакция является распространённым способом формирования C=N связи.
При биосинтезе алкалоидов реакция образования основания может проходить также внутримолекулярно. Примером может являться реакция образования 1-пиперидеина, происходящая при синтезе пиперидинового цикла:
Реакция Манниха В реакции Манниха, помимо амина и карбонильного соединения, участвует также карбанион, играющий роль нуклеофила в процессе присоединения к иону, образованному взаимодействием амина и карбонильного соединения.
Реакция Манниха также может осуществляться как межмолекулярно, так и внутримолекулярно. Примером внутримолекулярной реакции Манниха может служить синтез пирролизидинового ядра:
Разновидностью внутримолекулярной реакции Манниха является реакция Пикте — Шпенглера — циклизация шиффовых оснований, образованных из -фенилэтиламинов с образованием системы тетрагидроизохинолина. Конденсация: реакции, в ходе которых отдельные кольца, соединяясь друг с другом, образуют более сложные фигуры.При биосинтезе алкалоидов постоянно происходит образование активных центров, которые способны присоединять к себе как отдельные фрагменты алифатических молекул, так и замкнутые гетероциклы. Возникновение этих центров может быть связано не только с декарбоксилированием, но также с отщеплением других функциональных групп. В ряде случаев образование алкалоидов сопряжено с расщеплением (размыканием) циклических структур, наступающим в результате разрыва C—C, C—N или C—O связей (например, реакция окислительного расщепления ароматических колец по соседству с фенольной группировкой – при биосинтезе индольных алкалоидов). Помимо циклизации и конденсации, усложнение углеродного скелета алкалоидов достигается также в ходе внутримолекулярных перегруппировок, при которых происходит не только разрыв, но и образование новых C—C и C—N-связей. Алкалоиды накапливаются в вакуолях, обычно в виде солей. Синтез проходит в пластидах либо в цитозоле или ЭПР.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 865; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.8.247 (0.011 с.) |