
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Діаграми стану, їхнє значення.
Правило відрізків. 3. Діаграми склад-властивості (Курнакова - Матисена). 1. Усі перетворення, що протікають в сплавах у залежності від температури і концентрації, можна зобразити наочно, що здійснюється на діаграмах стану. Діаграма стану - це графічне зображення фазового стану сплавів даної системи в залежності від температури та концентрації. Діаграми стану дають у наочній формі картину зміни будови і властивостей сплаву при зміні його концентрацій і температури, дозволяють визначити температури плавлення, твердіння й алотропічних перетворень у сплавах, вивчити походження структур, що спостерігаються під мікроскопом, і зв’язати структуру сплаву з його механічними, технологічними і фізико-хімічними властивостями.
Мал. 15 Загальний вміст обох компонентів у сплаві дорівнює 100%. і кожна точка на осі абсцис відповідає певному вмісту кожного компонента. По мірі віддалення від точки А збільшується кількість компонента В і в точці В=100%. Кожна точка на діаграмі стану показує стан сплаву даної концентрації при даній температурі. Звичайно діаграми стану будують експериментально. Для визначення температур фазових переходів застосовують термічний аналіз. При цьому одержують експериментальні криві охолодження і по перегинах, які зв'язані з тепловими ефектами перетворень, визначають критичні температури (точки). Для дослідження перетворень, які проходять у сплаві у твердому стані застосовують рентгено - і мікроструктурний, магнітний і інші методи. Діаграми, на яких зображені фази в сплаві (тверді розчини, хімічні з’єднання чи механічні суміши), називають фазовими. Але, при вивченні будови сплавів під мікроскопом спостерігаються як фази, так і структурні складові сплаву, котрі мають певний розмір, форму та розташування. Діаграмами стану, в яких показані структурні складові, отримали назву структурні. Мікробудова сплаву обумовлює їх фізико-механічні, технологічні та експлуатаційні властивості. Розглянемо діаграму стану двохкомпонентних сплавів для випадків, коли обидва компонента нескінченно розчинні у жидком стані, а у твердому стані не розчинні, створюють механічну суміш. Такі діаграми умовно називають діаграми стану першого типу. Компонентами А і В, що складають розглянутий сплав, можуть служити як чисті елементи, так і хімічні сполуки. Криві охолодження компонентів і сплавів різних складів зображені на малюнку ліворуч і праворуч від діаграми.
Мал. 16 На відміну від чистих компонентів, усі сплави за невеликим винятком кристалізуються в інтервалі температур. Причому, спочатку кристалізується тільки один з компонентів, тому що спільна кристалізація компонентів у випадку утворення механічної суміші можлива тільки при визначеній їх концентрації в розплаві. У нашому випадку такою концентрацією є 13% олова і 87% свинцю. При такій концентрації спільна кристалізація протікає при постійній температурі аналогічно кристалізації чистого компоненту. У сплавах, що відрізняються за складом від сплаву зі 13% олова спочатку кристалізується тільки один з компонентів: Pb - у випадку якщо концентрація Sn у сплаві менша 13%; i Sn – якщо концентрація Sn в сплаві більша 13%, при кристалізації надлишкового компоненту його рідкої фази все більше наближається до концентрації при якій можлива одночасна кристалізація обох компонентів тобто до 13% Sn і 87% Pb. Процес кристалізації будь-якого сплаву даної системи завершується одночасним утворенням кристалів речовин А(Pb) і В(Sn). При спільній кристалізації утворюється дисперсна суміш найдрібніших дендритів речовини В і кристалів речовини А, в товщі яких вони залягають. Такі суміші називають евтектиками. Це сплави утворені в результаті одночасної кристалізації різних компонентів при постійній температурі. Евтектики мають постійний хімічний склад і найнижчу температуру кристалізації для даної системи сплавів. Крива кристалізації евтектичного сплаву буде мати такий же вигляд, як і крива кристалізації чистого компонента. У сплавах заевтектичних (>13%Sn), спочатку кристалізується компонент В. При зменшенні концентрації компонента В у рідкій фазі до 13% в кристалізацію вступає також і компонент А, що призводить до утворення евтектики. Критичні точки початку і кінця кристалізації переносять з кривих охолодження на діаграму, де по вісі ординат - температура, по вісі абсцис – склад сплаву. Точки початку і кінця кристалізації з’єднують плавними лініями і одержують діаграму стану. Верхня ламана лінія АСВ відповідає початку кристалізації (кінець плавлення) і називається лінія ліквідус, лінія ДСЕ відповідає
кінцю кристалізації (початок плавлення) і називається лінією солідуса. Вище ліквідуса - сплави в рідкому стані. Між ліквідусом і солідусом йде процес кристалізації, і сплави складаються з твердої та рідкої фаз. Нижче лінії солідуса сплави складаються з різних твердих фаз. Якщо компоненти сплавів значно відрізняється за густиною, то кристали які виділяються, будуть нерівномірно розподілені в рідкому сплаві. Більш важкі кристали осаджуються на дні форми. До моменту повної кристалізації евтектика виявляється переважно зверху, кристали більш важкого надлишкового компоненту знизу. В результаті хімічний склад в різних об’ємах злитку чи виливки буде не однорідним. Це явище носить назву ліквації за густиною (питомою вагою). Усунути її можна розмішуючи або струшуючи сплав який затвердіває. Сплави близькі за складом до евтектичного широко застосовуються в техніці через низьку температуру плавлення і кращі ливарних властивостей. Кількість і склад фаз у процесі кристалізації можна визначити по правилу відрізків (мал.19). Для визначення хімічного складу фаз через точку, що характеризує сплав, проводять горизонтальну пряму до перетину з найближчими лініями діаграми, при цьому проекція точок перетину на вісь абсцис покаже хімічний склад фаз. Кількісне співвідношення між масою рідкої фази і масою твердої фази визначається співвідношенням відрізків КL і NL. Користаючись концентраційними відрізками на осі абсцис можна знайти необхідну величину Qр /Qтв =КL/NL
 Діаграма стану другого типу для випадку необмеженої розчинності компонентів у твердому стані. У цьому випадку кожен кристал будується сумісно Діаграма стану другого типу для випадку необмеженої розчинності компонентів у твердому стані. У цьому випадку кожен кристал будується сумісно
атомами обох речовин і тому в Мал. 17 результаті кристалізації виходить сплав, що складається з однотипних кристалів твердого розчину. На кривих охолодження температури кристалізації сплавів лежать між температурами кристалізації вихідних компонентів. У процесі кристалізації твердого розчину змінюється склад як рідкої, так і твердої фаз. Наприклад, у сплаві 1 центри кристалізації, які виникли при кристалізації, будуть відповідати точці 0 при зниженні температури, наступні шари зерна будуть мати вже концентрацію, що відповідає точці 0 і т.д.. Мал. 18 Тільки наприкінці кристалізації (точка В') складу кристалів твердого розчину буде відповідати концентрація сплаву 1. При швидкому охолодженні неоднорідність по об’єму зерна, що виникла в процесі кристалізації, може зберегтися і зветься дендритною ліквацією. Зміна хімічного складу поблизу границь зерен внаслідок дендритної ліквації може привести до міжкристалічної корозії в хромонікелевих сталей. Дендритна ліквація може бути усунута шляхом тривалої витримки сплавів при високих температурах. Нижче лінії солідус AbB (AqB- ліквідус) усі сплави системи складаються з кристалів твердого розчину різної концентрації. Необмежена розчинність у твердому стані зустрічається порівняно рідко. Значно частіше утворяться сплави з обмеженою розчинністю у твердому стані. Діаграма стану 3
типу для випадку обмеженої розчинності у твердому стані зображена на малюнку 18. При кристалізації компонент В розміщується в гратках компонента А в атомарному вигляді з утворенням твердого розчину a з максимальною концентрацією, що відповідає точці Е при температурі tl. У тому випадку, якщо компонент А в гратках компонента В розміститися не може, область твердого розчину з боку компонента В відсутня. За межею насичення (точка С), коли з'являється друга фаза (компонент В) і утвориться евтектика, лінія солідус стає горизонтальною (ЕД). Таким чином, діаграма стану з обмеженою розчинністю сполучить у собі два попередні типи діаграм.
Діаграма стану 4 типу для випадку утворення хімічної сполуки. Виникає хімічна сполука, якщо вона стійка і не розкладається аж до температури плавлення, поводиться в процесі кристалізації так як і чистий компонент. Вид діаграми стану буде залежати від того. як утворена хімічна сполука взаємодіє з вихідними компонентами в процесі кристалізації.
Мал. 20 Для аналізу такої діаграми її зручно розділити на дві: діаграма компоненту А і хімічної сполуки AmBn і діаграму компонента В і хімічної сполуки АmВn. Евтектики в точках С и Д складаються з кристалів хімічної сполуки й елемента А (ліва частина діаграми) чи В (права частина).
Можливий випадок, коли компоненти обмежено розчинні у твердому стані й утворять механічні суміші в результаті реакції. На відміну від діаграми евтектичного типу, в цій системі кристали, що випали з рідини, одного твердого розчину, реагуючи з рідиною, що залишилася, утворять кристали іншого твердого розчину. Же+bе®aд+Же ділянка СД Же+bе®aд+bе ділянка ДЕ Остаточно затверділий сплав буде складатися з a (під АД) a + b (під ДЕ) b (під ЕВ)
Для визначення концентрації компонентів користуються однією із двох геометричних властивостей рівносторонніх трикутників:
Мал.24 2) сумарна довжина трьох відрізків, відітнутих на сторонах рівностороннього трикутника прямими, паралельними його сторонам, проведеними через будь-яку точку всередині його, є величиною постійною, рівною довжині сторони трикутника (мал. 24). Залежність між хімічним складом, структурою і властивостями сплавів встановлена Н.С. Курнаковим, що розробив методи фізикохімічного аналізу металів. Ця залежність виражається графічно у вигляді діаграм склад - властивості (мал. 25). При утворенні механічної суміші властивості сплавів (твердість, електроопір, коерцитивна сила) змінюються лінійно (а). Отже, властивості сплавів мають середнє значення з кількісних значень властивостей компонентів.
У сплавах, що утворюють твердий розчин з необмеженою розчинністю, властивості змінюються по криволінійній залежності, вже при невеликих домішках другого компоненту твердість, міцність, електричний опір і коерцитивна сила сплавів підвищуються і стають вище властивостей компонентів, а електропровідність і магнітна проникність понижуються. У сплавах, що утворюють тверді розчини з обмеженою розчинністю, властивості в областях, що відповідають твердим розчинам, змінюються по криволінійній залежності, а в областях, що відповідають механічної суміші — по лінійній залежності.
деформованість, оброблюваність різанням та інші. За даними дослідника Л. А. Бочвара, велика відстань між лініями ліквідуса та солідуса на діаграмі стану вказує на схильність сплаву до ліквації за густиною, утворенню розсіяних усадочних раковин і стовпчастої структури, до появи тріщин у виливках. Кращими ливарними властивостями володіють двохфазні сплави, особливо евтектичні, що є найбільш легкоплавкими. Краще деформуються в холодному і гарячому стані однофазні сплави - тверді розчини, що мають менший опір пластичному деформуванню. Якщо в сплаві немає дуже твердих фаз, що зношують різальний інструмент, то двохфазні сплави обробляються різанням легше, ніж однофазні. Але однофазні сплави мають кращий опір корозії, ніж двохфазні. Особливо велике значення мають діаграми стану для вирішення питання про можливість термічної обробки сплавів.
ЗАЛІЗОВУГЛЕЦЕВІ СПЛАВИ
|
|||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 344; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.42.94 (0.017 с.) |
 У залежності від характеру взаємодії компонентів сплавів у твердому стані розрізняють 4 основних типи діаграм стану подвійних сплавів. Діаграми стану подвійних сплавів будують у двох вимірах: по осі ординат відкладають температуру, по осі абсцис - концентрацію у вагових %(мал..15).
У залежності від характеру взаємодії компонентів сплавів у твердому стані розрізняють 4 основних типи діаграм стану подвійних сплавів. Діаграми стану подвійних сплавів будують у двох вимірах: по осі ординат відкладають температуру, по осі абсцис - концентрацію у вагових %(мал..15).

 Оскільки межа насичення змінюється зі зміною температури, концентрація a-твердого розчину при кімнатній температурі буде менша, ніж у точці Е. Усі сплави з концентрацією компонента В меншою, ніж у точці Е', при кристалізації утворять насичені a-тверді розчини і при охолодженні нижче лінії солідус не мають структурних перетворень. Сплави, що знаходяться по концентрації між точками Е и Е' при охолодженні мають структурні перетворення, що полягають в утворенні у зернах чи по границях a-твердого розчину вторинних кристалів елемента В. Ці кристали з'являються при охолодженні сплаву до лінії ЕЕ' (нижче її), коли a- кристали стають перенасиченими компонентом В для даної температури. При концентраціях елемента В, більших ніж межа насичення (точка Е), утворяться сплави з надлишковим вмістом кристалів чистого компонента В (заевтектичні). Сплав, що відповідає по концентрації точці С, має евтектичну будову.
Оскільки межа насичення змінюється зі зміною температури, концентрація a-твердого розчину при кімнатній температурі буде менша, ніж у точці Е. Усі сплави з концентрацією компонента В меншою, ніж у точці Е', при кристалізації утворять насичені a-тверді розчини і при охолодженні нижче лінії солідус не мають структурних перетворень. Сплави, що знаходяться по концентрації між точками Е и Е' при охолодженні мають структурні перетворення, що полягають в утворенні у зернах чи по границях a-твердого розчину вторинних кристалів елемента В. Ці кристали з'являються при охолодженні сплаву до лінії ЕЕ' (нижче її), коли a- кристали стають перенасиченими компонентом В для даної температури. При концентраціях елемента В, більших ніж межа насичення (точка Е), утворяться сплави з надлишковим вмістом кристалів чистого компонента В (заевтектичні). Сплав, що відповідає по концентрації точці С, має евтектичну будову. На мал.20 представлена діаграма для випадку роздільної кристалізації хімічних сполук і вихідних компонентів.
На мал.20 представлена діаграма для випадку роздільної кристалізації хімічних сполук і вихідних компонентів.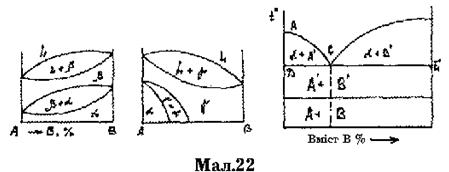 Зміна кристалічної структури при алотропічному перетворенні відбувається в твердому стані і називається вторинною кристалізацією. У випадку, коли алотропічне перетворення відбувається у чистому металі, що входить у структуру затверділого сплаву, вона відбувається для будь-якого складу сплаву при постійній температурі на горизонтальній лінії. Якщо алотропічне перетворення відбувається в одному з компонентів твердого розчину, то у твердому розчині може змінюватися концентрація за рахунок постійного виділення з нього a-фази.
Зміна кристалічної структури при алотропічному перетворенні відбувається в твердому стані і називається вторинною кристалізацією. У випадку, коли алотропічне перетворення відбувається у чистому металі, що входить у структуру затверділого сплаву, вона відбувається для будь-якого складу сплаву при постійній температурі на горизонтальній лінії. Якщо алотропічне перетворення відбувається в одному з компонентів твердого розчину, то у твердому розчині може змінюватися концентрація за рахунок постійного виділення з нього a-фази. В техніці широко використовують сплави, утворені трьома і більшим числом компонентів. Для характеристики фазових перетворень у потрійних сплавах застосовують потрійні діаграми стану. Вони являють собою просторові фігури, на плоскій основі, на яких зображується склад сплавів, а по вертикальній осі -температура. Склад потрійних сплавів зображують на площині рівностороннього трикутника, названого концентраційним трикутником. На сторонах трикутника лежать точки, що виражають склади подвійних сплавів у вершинах - точки, що відповідають чистим компонентам. Будь-яка точка всередині трикутника відповідає складу потрійного сплаву. Вершини трикутника відповідають 100%-му вмісту компонентів А, В, С (мал. 23).
В техніці широко використовують сплави, утворені трьома і більшим числом компонентів. Для характеристики фазових перетворень у потрійних сплавах застосовують потрійні діаграми стану. Вони являють собою просторові фігури, на плоскій основі, на яких зображується склад сплавів, а по вертикальній осі -температура. Склад потрійних сплавів зображують на площині рівностороннього трикутника, названого концентраційним трикутником. На сторонах трикутника лежать точки, що виражають склади подвійних сплавів у вершинах - точки, що відповідають чистим компонентам. Будь-яка точка всередині трикутника відповідає складу потрійного сплаву. Вершини трикутника відповідають 100%-му вмісту компонентів А, В, С (мал. 23). 1) сумарна довжина всіх перпендикулярів, опушених з будь-якої точки, що знаходиться всередині рівностороннього трикутника, на кожну з його сторін - постійна і дорівнює його висоті.
1) сумарна довжина всіх перпендикулярів, опушених з будь-якої точки, що знаходиться всередині рівностороннього трикутника, на кожну з його сторін - постійна і дорівнює його висоті. При утворенні стійких хімічних сполук, твердість, електричний опір і коерцитивна сила різко підвищуються.
При утворенні стійких хімічних сполук, твердість, електричний опір і коерцитивна сила різко підвищуються. Знаючи діаграми стану, можна визначити технологічні властивості сплавів: ливарні,
Знаючи діаграми стану, можна визначити технологічні властивості сплавів: ливарні,


