
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електроліз розплавів і розчинів ⇐ ПредыдущаяСтр 6 из 6
Задача 1. Складіть схему електролізу розплавів: а) калій гідроксиду; б) натрій сульфату. Розв'язання: а) калій гідроксиду дисоціює на іони: КОН = К+ + ОН–. Під час проходження крізь розплав електричного струму до негативного електрода (катода) будуть переходити катіони К+ і приєднувати електрони (відновлюватися). До позитивного електрода (анода) будуть надходити аніони ОН– і віддавати електрони (окиснюватися). Отже, схема процесу набуває такого вигляду: К+ + е– = К
або
б) натрій сульфату в розплаві дисоціює на іони:
Схема процесу електролізу:
або
Задача 2. Складіть схеми електролізу водних розчинів:а) купрум (ІІ)сульфату; б) магній хлориду; в) калій сульфату. В усіх випадках електроліз проводиться з використанням вугільних електродів. Розв' язання: а) у розчині купрум (ІІ) сульфату дисоціює на іони:
Іони купруму (ІІ) можуть відновлюватися на катоді у водному розчині. Сульфат-іони у водному розчині не окиснюються, тому на аноді відбуватиметься окиснення води. Схема електролізу:
або
б) дисоціація магній хлориду у водному розчині:
Іони магнію не можуть відновлюватися у водному розчині (відбувається відновлення води), хлорид-іони — окиснюються. Схема електролізу:
або
в) дисоціація калій сульфату у водному розчині: K2S04 = 2К+ + SO2-4. Іони калію і сульфат-іони не можуть розряджатися на електродах у водному розчині, отже, на катоді відбуватиметься відновлення, а на аноді — окиснення води. Схема електролізу:
або, враховуючи, що 4Н+ + 40Н – = 4Н20 (здійснюється при перемішуванні),
Задача 3. Під час електролізу водного розчину калій гідроксиду з інертними електродами на катоді виділився водень об'ємом 11,2 л (нормальні умови). Розрахуйте об'єм кисню, який виділився при цьому на аноді. Розв'язання: Записуємо рівняння електролізу, враховуючи, що на катоді відновлюється вода (катіони калію не відновлюються при електролізі водних розчинів), а на аноді окиснюються гідроксид-іони:
або
Визначаємо кількість речовини водню, що виділився:
Із рівняння реакції випливає, що
Обчислюємо об'єм кисню, що виділився: V(O2) = n (O2)Vm; V(O2)= 0,25×22,4=5,6(л). Питання і задачі
1. Що називається електродами? Які реакції відбуваються на них? 2. Що трапиться, якщо активний або неактивний метал занурити у розчин власної солі? 3. Дати визначення поняттям «потенціал» і «стандартний потенціал». Як вони експериментально вимірюються і розраховуються? 4. Намалювати схему і пояснити дію водневого електрода. 5. Яка формула встановлює залежність значення електродного потенціалу від концентрації електроліту? 6. Дайте визначення поняттю «гальванічний елемент». З чого він складається? 7. Охарактеризуйте катоди і аноди у гальванічному елементі. 8. Наведіть умови оборотності гальванічного елемента. При якому стані його виконуються умови -D G 0 = А макс = nEF. 9. Що таке ЕРС гальванічного елемента і за якою формулою розраховується ця характеристика? 10. Які типи гальванічних елементів ви знаєте? Чим вони відрізняються? 11. Навести приклади концентраційного гальванічного елемента. 12. Скласти схеми гальванічних елементів, в одному з яких мідь була б анодом, а у іншому - катодом. Написати рівняння реакцій, які відбуваються на електродах при роботі цих гальванічних елементів та розрахуйте ЕРС, використавши стандартні значення потенціалів. 13. Гальванічний елемент складається з срібного електрода, зануреного у 1 M розчин AgNО3, та стандартного водневого електрода. Визначити його ЕРС. Написати електродні та сумарну реакції, які відбуваються у гальванічному елементі. 14. Напишіть схему концентраційного гальванічного елемента, складеного з цинкових електродів. Концентрація іонів цинку у розчинах дорівнює відповідно 0,1 та 0,5 моль/л. Розрахувати ЕРС та максимально корисну роботу, яку виконує цей гальванічний елемент. 15. У якому напрямку будуть рухатись електрони у зовнішньому колі наступних гальванічних елементів: а) Mg|Mg+2||Pd+2|Pb; б) Pb|Pb+2||Cu+2|Cu; в) Cu|Cu+2||Ag+|Ag, якщо всі розчини електролітів одномолярні? Розрахуйте ЕРС цих елементів. 16. Розрахувати потенціал мідного електрода у розчині Сu(NО3)2 з концентрацією іонів Сu+2 0,12 моль/л. Скласти з цього і стандартного мідного електродів гальванічний елемент та розрахувати його DG0. Як зветься такий гальванічний елемент?
17. Що називається електролізом? 18. Які бувають типи поляризації? 19. Чим зумовлена концентраційна поляризація? 20. Від чого залежіть електрохімічна поляризація? 21. Що таке перенапруга і як вона впливає на потенціал конкретної реакції? 22. Поясніть, чому особливе значення має перенапруга виділення водню для електролізу водних розчинів і від чого вона залежить? 23. Сформулюйте правила відновлення на катодах. Від чого залежать ці процеси? 24. Сформулюйте правила окиснення на анодах. Які процеси можуть відбуватися на розчинних і нерозчинних анодах? Чим вони зумовлені? 25. Записати схеми електролізу наступних розплавів: КСl, NaBr, MgCl2, RbI. 26. Записати схеми електролізу наступних розчинів з нерозчинними анодами: K2SO4, MgSO4, CuCl2, NiBr2, FeCl2, Na2SO4 +CuI2. 27. Записати схеми електролізу наступних розчинів з розчинними анодами: FeCl2, CuCl2, NiSO4, Co(NO3)2, AuCl3. 28. Крізь розчин ZnСl2 пройшло 96500 Кл електрики. При цьому маси виділених цинку та хлору відповідно дорівнюють 19,61 та 6,20 г. Записати електродні процеси та розрахувати вихід за струмом. 29. При електролізі солі двовалентного металу струмом силою 1 А протягом 2 год виділилось на катоді 2,219 г металу. Визначити цей метал. Список рекомендованої літератури
1. Гельфман М.И., Юстратов В.П. Химия. – С.-Пб.: Изд-во «Лань», 2000. – 480 с. 2. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1998. 3. Григор'єва В.В., Cамійленко В.М., Сич А.М. Загальна хімія. – Київ: Вища школа., 1991. 4. Романцева З.Л., Лещинская Л.М., Суханова В.А. Сборник задач и упражнений по общей химии. – М.: Высшая школа, 1991. 5. Угай Я.А., Общая химия. – М.: Высшая школа, 2000. – 547 с. Зміст
1 2
+ − − + − + + − + − − + − + + − + − − + − + + − + − − + − + + − + − − + − + + −
3 3 а б Рис. 1. Перерозподіл зарядів біля поверхні розділу фаз: а – електрод з активного металу (1); б – електрод з неактивного металу (2), занурених у розчини електролітів (3).
V 3 1 К (−) А (+) 2
Рис.2. Схема гальванічного елемента (елемент Якобі-Даніеля). 1 - цинковий електрод − цинкова пластина, занурена у розчин цинк сульфату; 2 - мідний електрод − мідна пластина, занурена у розчин купрум сульфату; 3 - електролітичний місток; 4 - вольтметр
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 402; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.120.133 (0.019 с.) |

 .
. .
.

 ,
, .
. .
. ,
, .
. .
.
 ,
, .
. ,
, .
. ,
, .
.


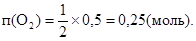

 4
4


