
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Семинар 4. Питательные среды. ⇐ ПредыдущаяСтр 5 из 5
Культивирование микроорганизмов является одним из основных методов микробиологии. От умения культивировать микроорганизмы в лабораторных условиях в значительной степени зависят успехи их изучения и практического применения. Культивирование основано на знании метаболизма микроорганизмов и понимании значения физико-химических условий среды, необходимых для их жизнедеятельности. ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ Потребности микроорганизмов в питательных веществах чрезвычайно разнообразны и определяются особенностями их метаболизма. Во-первых, питательная среда должна включать доступный для клетки источник энергии. Для одних организмов (фототрофов) таким источником служит свет, для других — органический (хемоорганотрофы) или неорганический (хемолитотрофы) субстрат. Во-вторых, среда должна содержать все необходимые компоненты для реализации конструктивных процессов в клетке, причем синтетические способности микроорганизмов могут варьировать от использования СО2 в качестве единственного источника углерода (автотрофы) до потребности в более восстановленных соединениях углерода — кислотах, спиртах, углеводах и др. (гетеротрофы). Последние чаще всего получают и углерод, и энергию, метаболизируя одно и то же органическое соединение, т.е., строго говоря, являются хемоорганогетеротрофами. По способности использовать те или иные источники азота микроорганизмы также существенно отличаются друг от друга. Одни из них довольствуются молекулярным азотом воздуха и не требуют добавления в среду каких-либо азотсодержащих соединений. Другие требуют присутствия в среде неорганических солей азота. Третьим нужна одна или несколько аминокислот. Отдельные аминокислоты в L- или DL-форме добавляют к стерильной среде в концентрации от 0,1 до 0,05 г на 100 мл непосредственно перед засевом ее микроорганизмами. Для этого рекомендуется использовать растворы аминокислот, в которых концентрация превышает содержание аминокислоты в среде в 100 раз. Глицин, аланин, пролин, лизин и орнитин растворяют в дистиллированной воде, фенилаланин и триптофан — в дистиллированной воде, подщелоченной NаОН, остальные аминокислоты - в дистиллированной воде, подкисленной НС1. Аминокислоты — цистин и цистеин, а также амиды — глутамин и аспарагин неустойчивы к нагреванию, поэтому их стерилизуют фильтрованием. Остальные аминокислоты можно стерилизовать при 0,5 атм в течение 15 мин.
Потребности микроорганизмов в некоторых аминокислотах часто удовлетворяют, добавляя к среде гидролизат белка. Состав гидролизатов неодинаков и зависит от исходного субстрата, а также способа получения. Чаще других используют гидролизат казеина, который готовят в лаборатории, как правило, кислотным гидролизом, еще чаще используют готовый препарат гидролизата казеина или готовят его в лаборатории. Его вносят в среду от 1,0 до 0,1 г на 100 мл в зависимости от потребности микроорганизмов. Наиболее требовательные организмы культивируют на средах, содержащих белки или продукты их неполного расщепления — пептоны, представляющие собой смесь поли- и олигопептидов, аминокислот, органических азотных оснований, солей и микроэлементов. Пептоны получают в результате воздействия протеолитических ферментов на белки животного или растительного происхождения. В питательные среды пептон добавляют в количестве от 1 — 2 до 20 г на 1 л. Необходимо иметь в виду, что аминокислоты и пептон могут использоваться микроорганизмами не только как источник азота, но и как источник углерода и энергии. Многие микроорганизмы требуют наличия в среде так называемых факторов роста, к которым относятся пурины, пиримидины и аминокислоты. Чтобы подчеркнуть потребность микроорганизмов в факторах роста, принято использовать термины «прототрофы» и «ауксотрофы». Прототрофы не нуждаются в факторах роста, для ауксотрофов абсолютно необходимо наличие в среде одного или нескольких факторов роста. Этим термином особенно широко пользуются в литературе по генетике. Если потребности микроорганизмов в факторах роста ограничены одним или несколькими витаминами, то рекомендуется вносить их в культуральные среды, используя следующие концентрации: тиамин (витамин В1), пантотенат Са, рибофлавин (витамин В2), никотиновая кислота (ниацин), пиридоксин, пиридоксамин, холин, кобаламин (витамин В12) - по 1 мкг на 1 мл среды; фолиевая кислота и пара-аминобензойная кислота - 0,05 мкг на 1 мл среды; биотин — 0,005 мкг на 1 мл среды.
Витамины добавляют к стерильной среде непосредственно перед ее засевом. Для этого рекомендуется использовать растворы, в которых концентрация витамина превышает его содержание в среде в 100 раз. Растворы готовят в стерильной посуде и используют стерильную дистиллированную воду. Исключение составляют рибофлавин и фолиевая кислота. Рибофлавин растворяют в 0,02 н. уксусной кислоте, а фолиевую кислоту — в 0,01 н. NаОН, доводя затем концентрацию NаОН в растворе до 0,001 н. Полученные растворы стерилизуют прогреванием в кипящей водяной бане 3 мин. Раствор тиамина рекомендуется стерилизовать фильтрованием, так как при нагревании тиамин разрушается. При температуре 4 °С растворы витаминов сохраняются не менее месяца. Растворы фолиевой кислоты, пиридоксина и рибофлавина хранят в темноте, так как они чувствительны к свету. Примерами смесей, содержащих различные факторы роста, могут служить дрожжевой экстракт, дрожжевой автолизат, а также кукурузный экстракт. Дрожжевой экстракт вносят в среду для культивирования от 0,05 до 0,5 г на 100 мл, дрожжевой автолизат — в таком количестве, чтобы концентрация аминного азота составляла 5 — 30 мг на 100 мл среды. Дрожжевой экстракт имеется в продаже. Дрожжевой автолизат легко приготовить в лабораторных условиях. Кукурузный экстракт — готовый продукт заводов крахмалопаточной промышленности. Он содержит аминокислоты, витамины, большое количество органических кислот (молочной, уксусной и муравьиной) и минеральные соли. Кукурузный экстракт вносят в среды в количестве от 0,2 до 5%; стерилизуют при 0,5 атм. Для построения вещества клетки микроорганизмам необходимы фосфор, сера, калий и ряд других элементов. Они должны содержаться в питательной среде в доступной для микроорганизмов форме. Потребности разных групп микроорганизмов в сере, фосфоре и других зольных элементах удовлетворяются обычно за счет минеральных солей. Поэтому «минеральный фон» сред для культивирования многих микроорганизмов может быть близким по составу. Так, потребности значительного числа микроорганизмов в сере удовлетворяются сульфатами, хотя в клетке сера находится в основном в восстановленной форме, в виде сульфгидрильных групп. Значительно реже встречаются микроорганизмы, требующие наличия в среде восстановленной серы. В этом случае в среду вносят сульфиды, чаще всего Н2S или органические соединения, содержащие сульфгидрильные группы, например цистеин. Соли фосфорной кислоты удовлетворяют потребности микроорганизмов в фосфоре. Микроорганизмы все необходимые металлы - К, Nа, Са, Мg, Fе, Мn, Со, Сu — и другие элементы получают в форме катионов или анионов неорганических солей. Например, источником магния служит МgSО4, источником натрия и хлора — NаС1, кальция — СаСО3 или СаС12. Железо вносят в среды в виде хлорида, сульфата или цитрата. Чтобы избежать выпадения осадка в результате образования нерастворимых комплексов фосфатов с некоторыми катионами, особенно с железом или кальцием, к средам рекомендуется добавлять от 0,001 до 1 г/л этилендиаминтетраацетата (ЭДТА) или гексаметафосфата натрия в концентрации 4 г/л. Комплексы, образуемые этими соединениями с катионами, служат резервом, из которого в результате диссоциации поступают свободные катионы.
Калий, магний, кальций и железо требуются в относительно больших количествах, поэтому их соли, как правило, включаются в состав питательных сред. Потребности микроорганизмов в марганце, молибдене, цинке, меде, кобальте и др. очень малы. Эти элементы часто называют микроэлементами, их вносят в среды строго определенного состава, приготовленные на дистиллированной воде в количестве от 1 мг до 1 мкг на 1 л. Об оптимальных концентрациях микроэлементов для разных микроорганизмов известно мало, поэтому предложены различные по составу смеси микроэлементов. Растворы микроэлементов рекомендуется стерилизовать отдельно и вносить в среду непосредственно перед посевом. Среды, приготовленные на водопроводной воде, а также среды, включающие натуральные компоненты, содержат необходимые микроэлементы и не требуют их специального добавления. По составу среды для культивирования микроорганизмов делят на натуральные (естественные) и синтетические. К натуральным относятся среды, состоящие из продуктов животного или растительного происхождения: овощные или фруктовые соки, молоко, животные ткани, разведенная кровь, вода морей, озер, минеральных источников, а также отвары или экстракты, полученные из природных субстратов — мяса, рыбы, дрожжей, растений, круп, навоза и почвы. К натуральным относятся также и так называемые полусинтетические среды, состоящие из природных продуктов в комбинации с рядом определенных химических соединений. Натуральные среды богаты органическими веществами, однако имеют сложный и непостоянный состав, поэтому они малопригодны для исследования обмена веществ микроорганизмов. Синтетические среды представляют собой комплекс определенных химически чистых соединений, взятых в точно указанных концентрациях. Синтетические среды наиболее удобны для изучения метаболизма микроорганизмов. Состав синтетических сред может варьировать настолько широко, насколько широко изменяются пищевые потребности культивируемых на них микроорганизмов. В зависимости от задачи исследования синтетические среды готовят на водопроводной или дистиллированной воде. Синтетические среды могут иметь довольно большой набор компонентов (включая микроэлементы), но могут быть и относительно простыми по составу. Рецепты некоторых синтетических сред и способы приготовления натуральных приведены в приложении 4.
По назначению среды подразделяют на элективные и дифференциально-диагностические (индикаторные). Элективные среды обеспечивают преимущественное развитие одного вида или группы микроорганизмов и менее пригодны или даже совсем не пригодны для развития других. Элективные среды применяют главным образом на первом этапе выделения микроорганизмов из естественных субстратов, т.е. для получения накопительных культур (например, среда Эшби является элективной для рода Azotobacter). Дифференциально-диагностические среды дают возможность быстро отличить одни виды микроорганизмов от других или выявить некоторые их особенности. Примером индикаторной среды для выявления бактерий из группы кишечной палочки в естественных субстратах может служить агаризованная среда Эндо. Бактерии рода Escherichia на этой среде образуют малиновые колонии с металлическим блеском. При определении видовой принадлежности бактерий часто используют рН-индикаторные среды в состав которых входит один из индикаторов – нейтральный красный (0,0005%), феноловый красный (0,005%) или бромтимоловый синий (0,0005%). Если развитие микроорганизма сопровождается образованием кислоты или щелочи, цвет индикатора меняется. Индикаторные среды особенно часто применяются в санитарной и медицинской микробиологии. По физическому состоянию среды могут быть жидкими, полужидкими, твердыми (плотными) и сыпучими. Жидкие среды широко применяют для выявления физиолого-биохимических особенностей микроорганизмов, накопления биомассы или продуктов обмена, а также поддержания и хранения многих микроорганизмов, плохо развивающихся на плотных средах. Полужидкие среды получают добавлением к жидким средам 0,5 % агара и используют для специальных целей, например культивирования анаэробных микроорганизмов. Сыпучие (сухие) питательные среды приобретают все большее практическое значение. Стандартность, простота хранения, транспортировки и изготовления делают их весьма удобными для работы. В микробиологическом производстве используются разваренное пшено, отруби. В клинической микробиологии нашли применение дифференциально-диагностические среды — среда Эндо, сухая желчь, среда Леффлера и т.д. Они представляют собой светло-желтые гигроскопичные порошки без комков с влажностью до 10 %. В сухом месте в хорошо закупоренной посуде их можно хранить длительное время. Они хорошо растворяются в воде при комнатной температуре в концентрации 1,5 — 6,0%. Плотные среды используют в микробиологической практике со времен Р. Коха. Они необходимы для выделения чистых культур микроорганизмов, в диагностических целях, для количественного учета микроорганизмов, хранения культур и в ряде других случаев. Уплотняющими агентами являются агар, желатин, силикагель. Агар используют для уплотнения особенно часто. Он представляет собой сложный полисахарид, в состав которого входят агароза и агаропектин. Кроме того, агар включает небольшое количество легкоассимилируемых веществ и различные соли. Агар получают из некоторых морских водорослей и выпускают в виде стебельков, пластин или порошка. Агар удобен тем, что большинство микроорганизмов не используют его в качестве субстрата для роста. В воде он образует гель, который плавится примерно при 100°С и затвердевает при температуре около 45 °С, поэтому на агаризованных средах можно культивировать значительную часть известных микроорганизмов. Чаще всего агар добавляют к средам в количестве 2 %, реже — 1,5 (более влажная среда) или 3 % (более сухая среда). Необходимо учитывать, что агар сохраняет свои свойства только при рН, близком к нейтральному. Агар всегда содержит органические и неорганические примеси, поэтому для приготовления сред строго определенного состава агар предварительно очищают, «выщелачивают». Экстракцию примесей проводят в течение 2 — 3 нед водопроводной водой при 30 — 37 °С со сменой воды через 1 — 2 сут. Процедуру прекращают, когда вода перестанет мутнеть. «Выщелоченный» агар помещают в двойной марлевый мешок и 2 — 3 сут промывают в проточной водопроводной воде. Затем агар высушивают и используют в количестве 1,5 — 2,0% (табл. 3.1).
Желатин — белок, получаемый из костей, хрящей и кожи животных. Образуемый им гель плавится при температуре 24 — 26 °С, которая ниже обычной температуры инкубации многих микроорганизмов (30 — 37 °С). К тому же многие микроорганизмы образуют протеолитические ферменты, разлагающие желатин. Поэтому желатин главным образом используют для определения протеолитической активности микроорганизмов с целью их идентификации (табл. 3.1). Кремнекислый гель (силикагелъ) применяют как твердую основу для синтетических сред строго определенного состава, поскольку он является веществом неорганической природы. Для получения силикагеля к соляной кислоте (плотность 1,1) добавляют при перемешивании равный объем жидкого стекла (раствор Na2SiO3 или К2SiO3 той же плотности). Смесь разливают по чашкам Петри по 25 — 30 мл в каждую и оставляют в покое для образования геля. Затем чашки помещают в стеклянный сосуд и промывают гель проточной водой для удаления хлоридов. Наличие хлоридов проверяют качественной реакцией с AgNO3. Завершают процедуру промыванием силикагеля горячей дистиллированной водой (табл. 3.1). В качестве уплотняющего средства в микробиологическую практику входит каррагинан — подобный агару полисахарид, экстрагируемый из красных водорослей. Каррагинан не используется большинством видов микроорганизмов. Для получения устойчивого при 45 и 60 °С геля используют соответственно 2,0 и 2,4 % каррагинана.
Таблица 3.1 Основные характеристики веществ, употребляемых для уплотнения питательных сред
Для некоторых специальных исследований, например для получения хорошо видимых в толще среды изолированных колоний анаэробных микроорганизмов, применяют осветленные среды. Прозрачные среды получают несколькими способами. Наиболее простой способ осветления — фильтрование среды через ватный фильтр. Если этого бывает недостаточно, среды осветляют с помощью белков куриного яйца. Для осветления 500 мл среды достаточно одного яйца. Белок отделяют от желтка и встряхивают с равным объемом воды до образования сплошной пены. Взбитый белок выливают в предварительно расплавленную и остуженную до 45 — 50 °С среду. Перед внесением белка проверяют рН и, если необходимо, доводят его до 7,0 — 7,3. Среду с белком тщательно перемешивают и прогревают при 100 °С в автоклаве в течение часа. Белок свертывается и адсорбирует все взвешенные в среде частицы. Когда свернувшийся белок поднимается на поверхность или опускается вниз, среду быстро отфильтровывают в горячем виде через вату. При этом удобно пользоваться специально подогреваемыми подставками для воронок, благодаря которым предотвращается застывание среды во время фильтрования. Синтетические агаризованные среды, в которые вносить белок нежелательно, осветляют следующим образом. Среду наливают в химический стакан, автоклавируют и оставляют после стерилизации в закрытом автоклаве на 10— 12 ч, обычно на ночь. При таком медленном остывании все взвешенные частицы оседают на дно. Застывшую агаризованную среду извлекают из стакана, верхнюю (прозрачную часть) срезают, помещают в колбу и вновь стерилизуют.
Стерилизация фильтрованием.
Фильтрованием стерилизуют синтетические среды строго определенного состава, которые содержат легкоразрушающиеся или летучие компоненты — витамины, аминокислоты (цистеин и цистин), белки, ароматические углеводороды, антибиотики и др. Фильтрование жидкостей осуществляют через мелко -пористые материалы, легко адсорбирующие клетки микроорганизмов: асбест, целлюлозу, фарфор, каолин и т.д. Стерилизующими фильтрами теоретически считают такие, размер пор которых не превышает 0,7 мкм. В практике же пригодность фильтров для стерилизации устанавливают путем пробной фильтрации через них суспензии какого-нибудь мелкого микроорганизма, например Serratia marcescens. Для проверки на стерильность фильтрат в большом количестве высевают на питательную среду. Если в течение 5 сут тест-организм не вырастет, фильтры могут быть использованы для стерилизации. Широкое распространение получили мембранные фильтры. Это диски разного размера, диаметра, напоминающие бумажные. Их готовят на основе нитроцеллюлозы. Мембранные фильтры в зависимости от величины пор применяют для фильтрования и стерилизации. Для стерилизации используют фильтры с номера 1 до номера 4 фирмы «Владипор» (Россия), фильтры с номера 5 до номера 10 фирмы «СИНПОР» (Чехия) и марок VF, VM, VC, SLGS, SLHA, DA фирмы «МИЛЛИПОР» (США). Плотные диски, изготовленные из смеси асбеста с целлюлозой, называются фильтрами Зейтца. В зависимости от диаметра пор они обозначаются разными индексами: ЕК — поры диаметром 1,5 — 1,8 мкм; ЕКS — 1,2—1,5; ЕКS-1 — 1,0— 1,2; ЕКР — 0,8— 1,0 мкм. В России выпускают асбестовые фильтры марок Ф2 и СФ. Стерилизующими являются СФ-3 и СФ-4. Асбестовую пластинку помещают в специальный держатель, который обычно изготавливают из нержавеющей стали, и крепко зажимают винтами между верхней (цилиндрической) и нижней (воронкообразной) частями держателя. Трубка нижней части держателя через резиновую пробку проходит в колбу Бунзена. Нередко весь этот прибор в собранном виде называют фильтром Зейтца.
Для стерилизации используют стеклянные пористые фильтры, а также изготовленные из каолина с примесью кварцевого песка — «свечи» Шамберлана и из инфузорной земли — «свечи» Беркефельда. Пористость первых обозначается буквой L с цифрами от 1 до 13 соответственно уменьшению диаметра пор фильтра от 9 до 1,2 мкм. Мелкопористые «свечи» обозначаются маркой В, крупнопористые - F. Фильтры Беркефельда обозначают буквами V, N, W, что соответствует следующим размерам пор (мкм): 8—12, 5 — 7, 3 — 4.
Мембранные фильтры стерилизуют автоклавированием при 1 ати 15 мин или длительным кипячением. Держатель вместе с резиновой пробкой заворачивают в бумагу и автоклавируют при 1 ати 20 — 30 мин. Фильтры Зейтца автоклавируют в собранном виде. «Свечи» стерилизуют вместе с резиновыми пробками в автоклаве. Колбу Бунзена закрывают ватной пробкой, в отводную трубку вставляют тампон и стерилизуют горячим воздухом — сухим жаром. СТЕРИЛИЗАЦИЯ ИНСТРУМЕНТОВ И ПРИБОРОВ Мелкие металлические инструменты: петли, иглы, пинцеты, ножницы, шпатели — стерилизуют прокаливанием в пламени (т.е. нагреванием докрасна) непосредственно перед использованием. На пламени кратковременно обжигают предметные и покровные стекла, стеклянные шпатели и палочки, фарфоровые ступки и пестики, горлышки колб, пробирок, бутылок, а также ватные пробки при пересевах культур и разливах сред. В пламени погибают и вегетативные клетки, и споры микроорганизмов. Наряду со стерильными одноразовыми шприцами в лабораторной практике широко распространены традиционные шприцы многократного использования. Их лучше всего стерилизовать сухим жаром при 160 °С в собранном либо в разобранном виде. В первом случае длительность стерилизации 75 мин, во втором —60 мин. Собранные шприцы вместе с иглой стерилизуют в пробирке, закрытой ватной пробкой, разобранные заворачивают в бумагу или ткань. Можно стерилизовать шприцы и в автоклаве при 1 ати в течение 15 — 20 мин. Автоклавируют их только в разобранном виде, иначе они повреждаются. Прокаливать шприцы нельзя, так как от этого они портятся. Термостойкие приборы для культивирования микроорганизмов, а также детали к этим приборам, резиновые пробки и шланги стерилизуют в автоклаве. При этом емкости завертывают в бумагу. Режим автоклавирования выбирают в соответствии с термостойкостью материала, из которого сделан прибор. Некоторые предметы (металлические инструменты, мелкие стеклянные детали, мембранные фильтры) иногда стерилизуют длительным (в течение 20 — 30 мин) кипячением в дистиллированной воде. Металлические и стеклянные предметы лучше всего кипятить в специальных закрытых сосудах — стерилизаторах. Можно использовать для этой цели и металлическую посуду. Мембранные фильтры обычно кипятят в колбе или химическом стакане, закрытых ватными пробками. Однако этим способом стерилизации в микробиологической практике пользуются редко в связи с тем, что длительное кипячение может повредить обрабатываемый материал, а сокращение времени кипячения может не обеспечить стерильность, так как споры некоторых микроорганизмов способны сохранять жизнеспособность даже после длительного кипячения. Надежность стерилизации при кипячении может быть увеличена внесением в воду какого-либо бактерицидного средства: 2%-го формальдегида, 1%-й бриллиантовой зелени или 0,1%-й сулемы. Но в этом случае возможно загрязнение биоцидами стерилизуемых предметов.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 810; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.53.209 (0.021 с.) |

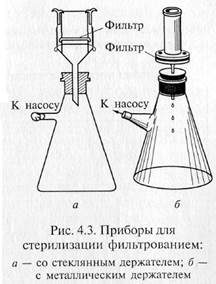
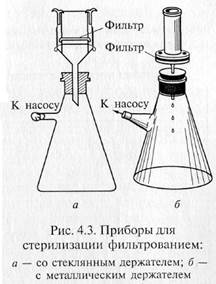
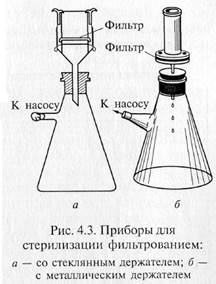


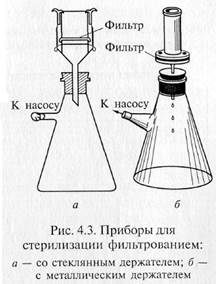
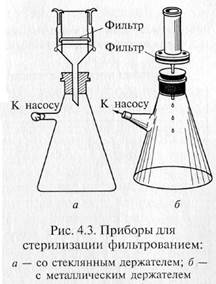 «Свечи» и специальные держатели с закрепленными в них асбестовыми фильтрами герметически соединяют с колбой Бунзена для фильтрации в вакууме (рис. 4.3). Перед употреблением фильтры, их держатели и приемник фильтрата должны быть простерилизованы.
«Свечи» и специальные держатели с закрепленными в них асбестовыми фильтрами герметически соединяют с колбой Бунзена для фильтрации в вакууме (рис. 4.3). Перед употреблением фильтры, их держатели и приемник фильтрата должны быть простерилизованы.


