Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 1. Визначення металу за його еквівалентною масою
Для визначення металу по його еквівалентній масі використовують прилад, зображений на мал. 1. Перед початком досліду прилад, закріплений у штативі (5), випробують на герметичність. Для цього піднімають лійку (3) на деяку висоту, при цьому рівень води в бюретці (2) повинний фіксуватися на визначеному рівні. Якщо прилад герметичний, можна приступити до виконання досліду.
Мал. 1. Прилад для визначення еквівалентної маси металу.
В один відросток склянки Оствальда (1) поміщають наважку металу (відомої маси і валентності). В інший відросток акуратно наливають 3-4 мл кислоти. Обережно з'єднують склянку Оствальда з бюреткою, щільно закривають пробкою і перевіряють герметичність приладу, як зазначено вище. Записують початковий рівень води в бюретці а1. Відлік роблять по нижньому меніску з точністю до 0,1 мл. Нахиливши склянку Оствальда, доливають кислоту до наважки металу. Спостерігають виділення водню і витіснення води з бюретки. Після закінчення реакції дають склянці охолонути, щоб газ у приладі прийняв кімнатну температуру. Приводять воду в бюретці і лійці, що з'єднані гумовою трубкою (4), до однакового рівняопусканням лійки, тобто скидають гідростатичний тиск. Записують рівень води в бюретці а2. Обчислення: Визначають об¢єм водню, що виділився: Визначають парціальний тиск водню:
де Р( Визначають температуру: Т = 273 + t0C. Приводять об¢єм водню до нормальних умов, користаючись об'єднаним газовим законом:
Обчислюють еквівалентну масу металу за законом еквівалентів:
За валентністю металу розраховують атомну масу металу : А(Ме) = mе (Ме)×в Використовуючи періодичну систему елементів Д.І. Менделєєва, розраховують теоретичне значення еквівалентної маси даного металу й обчислюють відносну погрішність експерименту:
Домашня підготовка до заняття за темою: “Квантова теорія будови атомів. Закономірності у зміні властивостей елементів ПС по групах та періодах”. 1. Визначте атому якого хімічного елемента відповідає електрона формула 1s22s22p63s23p64s1. 2. Складіть електронні формули і скорочені електронні формули: а) атома хлору; б) іона Сl─ ; в) атома кальцію; г) іона Са2+.
3. Назвіть елемент і складіть його повну електронну формулу, якщо значення квантових чисел валентних електронів в ньому такі: n = 4‚ l = 2 ‚ ml = - 2‚ s = + 1/2 n = 4‚ l = 2 ‚ ml = - 1‚ s = + 1/2 n = 4‚ l = 2 ‚ ml = 0‚ s = + 1/2 n = 4‚ l = 2 ‚ ml = +1‚ s = + 1/2 n = 5‚ l = 0 ‚ ml = 0‚ s = + 1/2. 4. Поясніть, які орбіталі атома заповнюються раніше: 4s чи 3d? 5s чи 4d? 5. Знайдіть в періодичній системі хімічних елементів Д.І. Менделєєва елементи – електронні аналоги Оксигену. Запишіть їх скорочені електронні формули. Визначить їх ступені окислення в сполуках? 6. Дайте характеристику змінам властивостей оксидів елементів ІІІ періоду. 7. Що називають ступенем окислення? Визначити ступінь окислення елементів в таких сполуках: KMnO4‚ K2MnO4‚ MnO2‚ K2Cr2O7‚ K2CrO4‚ Cr2O3.
Лабораторне заняття № 4
Тема: КВАНТОВА ТЕОРІЯ БУДОВИ АТОМІВ. ЗАКОНОМІРНОСТІ У ЗМІНІ ВЛАСТИВОСТЕЙ ЕЛЕМЕНТІВ ПС ПО ГРУПАХ ТА ПЕРІОДАХ. Мета: засвоєння квантової теорії будови атомів і її основних закономірностей у зміні властивостей елементів періодичної системи по групах і періодах. Контрольні запитання та задачі: 1. Які елементи називають електронними аналогами? Назвіть електронні аналоги карбону. 2. Що називають ступенем окиснення? Скласти електронну формулу атома хлору та графічну схему заповнення електронами валентних орбіталей в нормальному та збудженому станах. Вказати можливі ступені окиснення хлору. 3. Чому хлор і манган розміщують в одній групі періодичної системи хімічних елементів, але в різних підгрупах? 4. Структура валентного електронного шару елемента виражається формулою: а) 5s25p4; б) 3d54s1. Визначити порядковий номер та назву елемента, написати повну електронну формулу. Які значення квантових чисел (n, l, ml, ms) характеризують валентні електрони? 5. Написати електронні формули іонів: а) Sn2+, б) Sn4+, в) Mn2+, г) Cu2+, д) Cr3+, е) S2-. 6. Яка з наведених електронних конфігурацій нормального стану атома є правильною: а) d
б) d
в) d
г) d
7. Як змінюються окисні та відновні властивості атомів в періодах та групах?
Лабораторна робота
Дослід 1. Утворення одноатомних іонів металів. В процесі взаємодії атомів металів з окиснювачем кількість електронів у електронному шарі їх атомів зменшується. Утворюються заряджені позитивно частинки – іони. В п’ять пробірок налити по 10 крапель розчину купрум сульфату (ІІ). До першої пробірки внести залізні ошурки, до другої – гранулу цинку, до третьої – свинцю, до четвертої – олова, до п’ятої – магнієвої стружки. Через 10 хвилин оглянути поверхню металів і відзначити зміни забарвлення розчину купрум сульфату. Скласти рівняння реакцій і електронні формули атомів металів і їх одноатомних іонів. Зазначити розподіл електронів за квантовими комірками. Які значення квантових чисел (n, l, ml, ms) відповідають атомним орбіталям валентних електронів в атомах цих металів?
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 283; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.69.152 (0.015 с.) |

 = а2 - а1 (мл).
= а2 - а1 (мл). = Ратм – Р(
= Ратм – Р( ) (мм рт ст.),
) (мм рт ст.), Þ
Þ  ;
;  .
. =
=  Þ
Þ  =
= 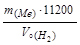 .
. .
.







 s
s