
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первичная кристаллизация металловСтр 1 из 8Следующая ⇒
Методы современной металлургии позволяют получать большинство металлов, даже тугоплавких, в жидком (расплавленном) состоянии. Для изготовления фасонных отливок или слитков жидкий металл разливают в формы или изложницы, в которых и происходит его кристаллизация. Температура кристаллизации (температура плавления при нагреве) при постоянном давлении для данного металла — величина постоянная. В табл. 1 указаны температуры плавления некоторых металлов. Таблица 1
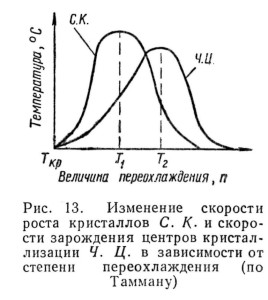
Процесс нагрева (охлаждения), при котором металл переходит из одного агрегатного состояния в другое, связан с поглощением или выделением тепла. По второму закону термодинамики все превращения, самопроизвольно протекающие в природе, вызываются стремлением системы к переходу из неустойчивого состояния в более устойчивое, с меньшим запасом свободной энергии. С изменением внешних условий, например, с повышением или понижением температуры, свободная энергия системы изменяется различно для веществ, находящихся в жидком и твердом состоянии. В системе координат свободная энергия — температура (рис. 12) изменение свободной энергии в жидком состоянии характеризуется кривой Fж, а в твердом состоянии — кривой Fкр. При температуре Ткр, являющейся температурой плавления при нагреве и температурой кристаллизации при охлаждении, Гж = т. е. жидкий и твердый металл находятся в равновесии. Процесс кристаллизации (плавления) возможен только при наличии разности свободных энергий ΔF. Для начала кристаллизации металла необходимо, чтобы этот процесс сопровождался уменьшением его свободной энергии. Из кривых, приведенных на рис. 12, видно, что кристаллизация возможна в том случае, когда жидкий металл будет охлажден ниже температуры Ткр — переохлаждение; в этом случае кривая Fкр расположена ниже кривой Fж. Аналогично обратный переход металла из твердого состояния в жидкое возможен только при нагреве выше температуры Тпл — перенагревании. Степень переохлаждения n характеризуется разностью теоретической Tкр и фактической Tп температур кристаллизации, которая у некоторых металлов может достигать значительной величины (рис. 11). Кривые охлаждения металла, полученные при реальном процессе кристаллизации (с переохлаждением) (рис. 11, в, г), отличаются от кривых теоретического процесса (рис. 11, а). Явление переохлаждения имеет большое практическое значение как при первичной, так и при вторичной кристаллизации металлов и сплавов, Д. К. Чернов впервые указал на то, что процесс кристаллизации жидкого металла состоит из двух стадий: образования центров кристаллизации и роста кристаллов из этих центров. Позднее Г. Тамман исследовал процесс образования центров кристаллизации и роста кристаллов. На основании исследования 156 кристаллизующихся жидкостей им была установлена зависимость между числом центров кристаллизации Ч. Ц. скоростью роста кристаллов С. К. и величиной переохлаждения n. Графически эта зависимость показана на рис. 13, из которого следует, что при температуре кристаллизации Tкр, когда переохлаждение отсутствует, число образовавшихся центров кристаллизации и скорость роста кристаллов весьма малы (практически равны нулю). При увеличении степени переохлаждения n число центров кристаллизации Ч. Ц. и скорость роста кристаллов С. К. увеличиваются; при каком-то значении степени переохлаждения они достигают максимального значения и понижаются снова до нуля при большем переохлаждении. Величины Ч. Ц. и С. К. могут быть определены количественно. Размеры образующихся кристаллов зависят от числа возникших центров кристаллизации и скорости их роста; при большом числе возникающих центров кристаллизации и малой скорости их роста (температура T2) образуются мелкие кристаллы и, наоборот, при большой скорости кристаллизации и малом числе центров (температура T1) — крупные кристаллы. До недавнего времени считали, что жидкости по своему внутреннему строению ближе к газам, чем к твердым телам. Однако исследования, проведенные В. И. Даниловым, применившим рентгено-структурный анализ к изучению внутреннего строения жидких металлов, показали наличие в последних, при температурах близких к температуре кристаллизации, группировок атомов ближнего порядка. Эти группировки атомов являются основой для зарождения в металле центров кристаллизации. Таким образом, для образования центров кристаллизации наличие их в жидком металле необходимо.
Изменение свободной энергии жидкого и кристаллического веществ На реальный процесс кристаллизации металла и размеры получаемых кристаллов в большой степени влияет наличие в жидком металле мельчайших посторонних частиц (неметаллических включений: оксидов, нитридов и др. в стали), состояние стенок изложницы или литейной формы, температура жидкого металла в момент разливки, вибрационные и ультразвуковые колебания и другие факторы. Регулируя указанные факторы, можно изменять величину получаемых кристаллов и, следовательно, механические свойства литых металлов. Проведенные опыты и практика показали, что образование центров кристаллизации в основном зависит от наличия в металле примесей и инородных включений. На влиянии примесей на процесс кристаллизации основано широко применяемое в металлургии и литейном производстве модифицирование стали, чугуна, силумина, магниевых и других сплавов. Модифицирование состоит в том, что в жидкий металл (сплав) вводят мельчайшие дисперсные частицы других металлов или небольшое количество поверхностно активных добавок. Модифицирование способствует интенсивному развитию кристаллизации, получению мелкозернистой структуры и улучшению механических свойств литых металлов и сплавов. Большое значение при кристаллизации металлов (так же как и при многих других процессах, протекающих в металлах в твердом состоянии) имеет диффузия. Рост кристаллов происходит путем диффузии частиц кристаллизующегося металла к центрам кристаллизации; этим объясняется зависимость скорости кристаллизации от величины переохлаждения (см. рис. 13). Уменьшение скорости кристаллизации при большом переохлаждении обусловлено замедлением диффузии при низких температурах.
Изменение скорости роста кристаллов Степень переохлаждения влияет не только на величину кристаллов, но и на их форму. При ничтожно малых степенях переохлаждения образуются кристаллы правильной геометрической формы. При несколько больших степенях переохлаждения кристаллы приобретают форму дендритов, рост их имеет преимущественное направление, соответствующее главным осям кристаллической решетки. При значительных степенях переохлаждения (которые удается реализовать, например, для ряда солей) образуются кристаллы лучистого сфероидального строения. Для металлических слитков и отливок характерна дендритная форма кристаллов. Схема дендрита, впервые изображенная Д. К. Черновым, приведена на рис. 14. Однако дендритное строение кристаллы получают только в условиях их свободного роста или в том случае, когда не хватает металла для заполнения междуосного пространства. Такое строение имеют, например, кристаллы, образующиеся на поверхности или в усадочной раковине слитка.
Схема образования дендрита В большинстве же случаев дендритные кристаллы, возникающие из разных центров, при росте сталкиваются друг с другом, в результате чего превращаются в кристаллические образования, называемые кристаллитами, или зернами. Только применяя особые способы кристаллизации, можно искусственно получить монокристалл металла. Обычно же технические металлы состоят из большого числа различно ориентированных зерен и являются поликристаллическими телами. Величина зерна составляет доли миллиметра: в 1 см³ металла содержатся десятки тысяч зерен. Строение металлов можно наблюдать уже при их наружном осмотре; более ясно оно выявляется при рассмотрении шлифов под микроскопом. Например, при рассмотрении под микроскопом технического железа (рис. 15) видно, что оно состоит из отдельных светлых зерен, по границам которых располагаются примеси и неметаллические включения, имеющие темный цвет. Примеси и неметаллические включения разделяют зерна и, как правило, ухудшают механические свойства металлов.
Микроструктура технического железа. х100 По последним данным, полученным при помощи электронно-микроскопического анализа, зерна представляют кристаллические образования — фрагменты, а фрагменты состоят из блоков мозаики — кристаллических образований размером 10·10-4-1·10-6 см, сдвинутых относительно друг друга на угол величиной от нескольких минут до нескольких градусов. Фрагменты и блоки мозаики получили название «тонкой» структуры металла. Исследования показывают, что наибольшее количество дефектов кристаллического строения сконцентрировано по границам зерен, фрагментов и блоков мозаики.По современным представлениям, на границах зерен металлов, вследствие их разной ориентировки, имеются области шириной в несколько атомных диаметров, строение которых характеризуется многими нарушениями геометрически правильного расположения атомов; эти несовершенства кристаллического строения называют поверхностными. Несовершенства кристаллического строения на границах зерен, а также величина фрагментов, блоков мозаики и степень их разориентировки оказывают большое влияние на структурно-чувствительные свойства металлов. 5.ПОЛИМОРФНЫЕ ПРЕВРАЩЕНИЯ Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как их назы-вают, в разных полиморфных модификациях. В результате ПОЛИморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа. Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой а, а при более высокой — β, затем γ и т. д.
Известны полиморфные превращения для металлов: Feα Fe⇔γ, Tiα ⇔ Tiβ, Mα⇔ Μ β ⇔ n γ ⇔ Μnδ,Snα ⇔ Snβ, а также для Са, Li, Те, Na, Cs, Sr, Те, Zr, большего числа редко-земельных металлов и дрn n Μ. Полиморфное превращение протекает вследствие того, что образование новой модификации сопровождается уменьшением энергии Гиббса. В условиях равновесия полиморфное превращение протекает при постоянной температуре (критическая точка) и сопровождается выделением теплоты, если превращение идет при охлаждении, или поглощением теплоты в случае нагрева (рис. 28, а). Как и при кристаллизации из жидкой фазы, чтобы полиморфное превращение протекало, нужно некоторое переохлаждение (или перенагрев) относительно равновесной температуры для возникновения разности энергий Гиббса между исходной и образующейся новой модификациями. В твердом металле в отличие от жидкого возможно достижение очень больших степеней переох-лаждения. Полиморфное превращение по своему механизму — кристаллизационный процесс, осуществляемый путем образования зародышей и последующего их роста (рис. 28, б). При полиморфном превращении кристаллы (зерна) новой полиморфной формы растут в результате неупорядоченных, взаимно связанных переходов атомов через границу фаз. Отрываясь от решетки исходной фазы (например, β), атомы по одиночке или группами присоединяются к решетке новой фазы (α), и, как следствие этого, граница зерна α-модификации передвигается в сторону зерна β-модификации, «поедая» исходную фазу. Зародыши новой модификации наиболее часто возникают на границах зерен исходных кристаллитов. Вновь образующиеся кристаллы зако-номерно ориентированы по отношению к кристаллам исходной модификации. В результате полиморфного превращения образуются новые кристаллические зерна, имеющие другой размер и форму, по-этому такое превращение также называют перекристаллизацией. Полиморфное превращение сопровождается скачкообразным из-менением всех свойств металлов или сплавов: удельного объема, теплоемкости, теплопроводности, электрической проводимости, магнитных свойств, механических и химических свойств и т. д.
6.Механические свойства материалов Механические свойства характеризуют способность материалов сопротивляться действию внешних сил. К основным механическим свойствам относятся прочность, твердость, ударная вязкость, упругость, пластичность, хрупкость и др. Прочность — это способность материала сопротивляться разрушающему воздействию внешних сил. Твердост ь — это способность материала сопротивляться внедрению в него другого, более твердого тела под действием нагрузки.
Вязкостью называется свойство материала сопротивляться разрушению под действием динамических нагрузок. Упругость — это свойство материалов восстанавливать свои размеры и форму после прекращения действия нагрузки. Пластичностью называется способность материалов изменять свои размеры и форму под действием внешних сил, не разрушаясь при этом. Хрупкость — это свойство материалов разрушаться под действием внешних сил без остаточных деформаций. При статических испытаниях на растяжение определяют величины, характеризующие прочность, пластичность и упругость материала. Испытания производятся на цилиндрических (или плоских) образцах с определенным соотношением между длиной
Деформация характеризует изменение размеров образца под действием нагрузки, %:
где: При испытаниях стоится диаграмма растяжения, представляющая Предел упругости Предел текучести
Рис. 1. Статические испытания на растяжение: a- схема испытания; 6 - диаграмма растяжения Предел прочности (или временное сопротивление) Относительное удлинение после разрыва
где Относительным сужением после разрыва
где Твердость металлов измеряется путем вдавливания в испытуемый образец твердого наконечника различной формы. Метод Бринелля основан на вдавливании в поверхность металла Метод Роквелла основан на вдавливании в испытуемый образец В методе Виккерса применяют вдавливание алмазной четырехгранной пирамиды с углом при вершине 136°. Число твердости по ВиккерсуHVопределяется отношением приложенной нагрузки к площади поверхности отпечатка. Ударная вязкость определяется работойA, затраченной на
Испытания проводятся ударом специального маятникового копра. Для испытания применяется стандартный надрезанный образец, 7.КОМПОНЕНТЫ И ФАЗЫ В СИСТЕМЕ ЖЕЛЕЗО — УГЛЕРОД Железо — металл сероватого цвета. Атомный номер 26, атомная масса 55,85, атомный радиус 0,127 нм. Чистое железо, которое может быть получено в настоящее время, содержит 99,999 % Fe, технические сорта 99,8—99,9 % Fe. Температура плавления железа 1539 °С. Железо имеет две полиморфные модификации α и γ. Модификация «-железа существует при температурах ниже 910 °С и выше 1392 °С (рис. 82). В интервале температур 1392—1539 °С α-железо нередко обозначают как δ-железо. Кристаллическая решетка α-железа — объемно центрированный куб с периодом решетки 0,28606 нм. До температуры 768 °С α-железо магнитно (ферромагнитно). Температуру 768 °С, соответствующую магнитному превращению, т. е. переходу из ферромагнитного состояния в парамагнитное, называю)? точкой Кюри и обозначают A 2. Плотность α-железа 7,68 г/см3. γ-железо существует при т емпературе 910— 1392 °С; оно парамагнитно. Кристаллическая решетка γ-железа гранецентриро-ванная кубическая (a = 0,3645 нм при 910 °С). Критическую точку превращения α ⇔ γ (рис. 82) при 910 °С обозначают соответственно Ас 3 (при нагреве) и Аr 3 (при охлаждении). Критическую точку перехода γ5α при 1392 °С обозначают Ас 4 (при нагреве) и Ас 4 (при охлаждении) 1. Углерод является неметаллическим элементом II периода IV группы периодической системы, атомный номер 6, плотность 2,5 г/см3, температура плавления 3500 °C, атомный радиус 0,077 нм. Углерод полиморфен. В обычных условиях он находится в виде модификации графита, но может существовать и в виде метаста бильной модификации алмаза. Углерод растворим в железе в жидком и твердом состояниях, а также может быть в виде химического соединения — цементита, а в высокоуглеродистых сплавах и в виде графита. В системе Fe—C различают следующие фазы: жидкий сплав, твердые растворы — феррит и аустенит, а также цементит и графит. Феррит (Ф) — твердый раствор углерода и других примесей в α-железе. Различают низкотемпературный α-феррит о растворимостью урлерода до 0,02 % и высокотемпературный δ-феррит с п р едельной растворимостью углерода 0,1 %. Атом углерода располагается в решетке феррита в центре грани куба, где помещается сфера радиусом 0,29 атомного радиуса железа, а также в вакансиях, на дислокациях и т. д. Под микроскопом феррит выявляется в виде однородных полиэдрических зерен (см. рис. 82, б). Феррит (при 0,06 % С) имеет примерно следующие механические свойства: σB = 250 МПа, σ0,2 = 120 МПа, δ 50 %, ψ 80 %, 80—90 НВ. ≅≅ Аустенит (А) — твердый раствор урлерода и других примесей в γ-железе. Предельная растворимость углерода в γ-железе — 2,14 %. Атом углерода в решетке γ-железа располагается в центре элементарной ячейки (см. рис 29, б), в которой может поместиться сфера радиусом 0,41 R (R — атомный радиус железа) и а дефектных областях кристалла. Различные объемы элементарных сфер в ОЦК и ГЦК решетках и предопределили значительно большую растворимость углерода в γ-железе по сравнению с растворимостью в α-железе. Аустенит обладает высокой пластичностью, низкими пределами текучести и прочности. Микроструктура аустенита — полиэдрические зерна (рис. 82, в). Цементит (Ц) — это химическое соединение железа с углеродом — карбид железа Fe3C В цементите содержится 6,67 % С Цементит имеет сложную ромбическую решетку с плотно й упаковкой атомов. Температура плавления цементита точно не определена в связи с ВОЗМОЖНОСТЬЮ его распада. До температуры 210 °С, обозначаемой А 0, цементит ферромагнитен. К характерным особенностям цементита относятся высокая твердость 1000 HV и очень малая пластичность. Цементит является метастабильной фазой. В условиях равновесия в сплавах с высоким содержанием углерода обра з уется графит. Графит имеет гексагональную слоистую (см. рис. 88, а) кристаллическую решетку. Межатомные расстояния в решетке небольшие и составляют 0,142 нм, расстояние между плоскостями равно 0,340 нм. Графит мягок, обладает низкой прочностью и электрической проводимостью. В сплавах Fe—С существуют две высокоуглеродистые фазы: метастабильная — цементит и стабильная — графит. Поэтому различают две диаграммы состояния — метастабильную Fe— Fe3C и стабильную Fe—С (графит).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 654; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.151.153 (0.047 с.) |



 и диаметром
и диаметром  . Образец растягивается под действием приложенной силы P (рис.I,а) до разрушения. Внешняя нагрузка вызывает в образце напряжение и деформацию. Напряжение
. Образец растягивается под действием приложенной силы P (рис.I,а) до разрушения. Внешняя нагрузка вызывает в образце напряжение и деформацию. Напряжение  -это отношение силы P к площади поперечного сечения F, МПа:
-это отношение силы P к площади поперечного сечения F, МПа: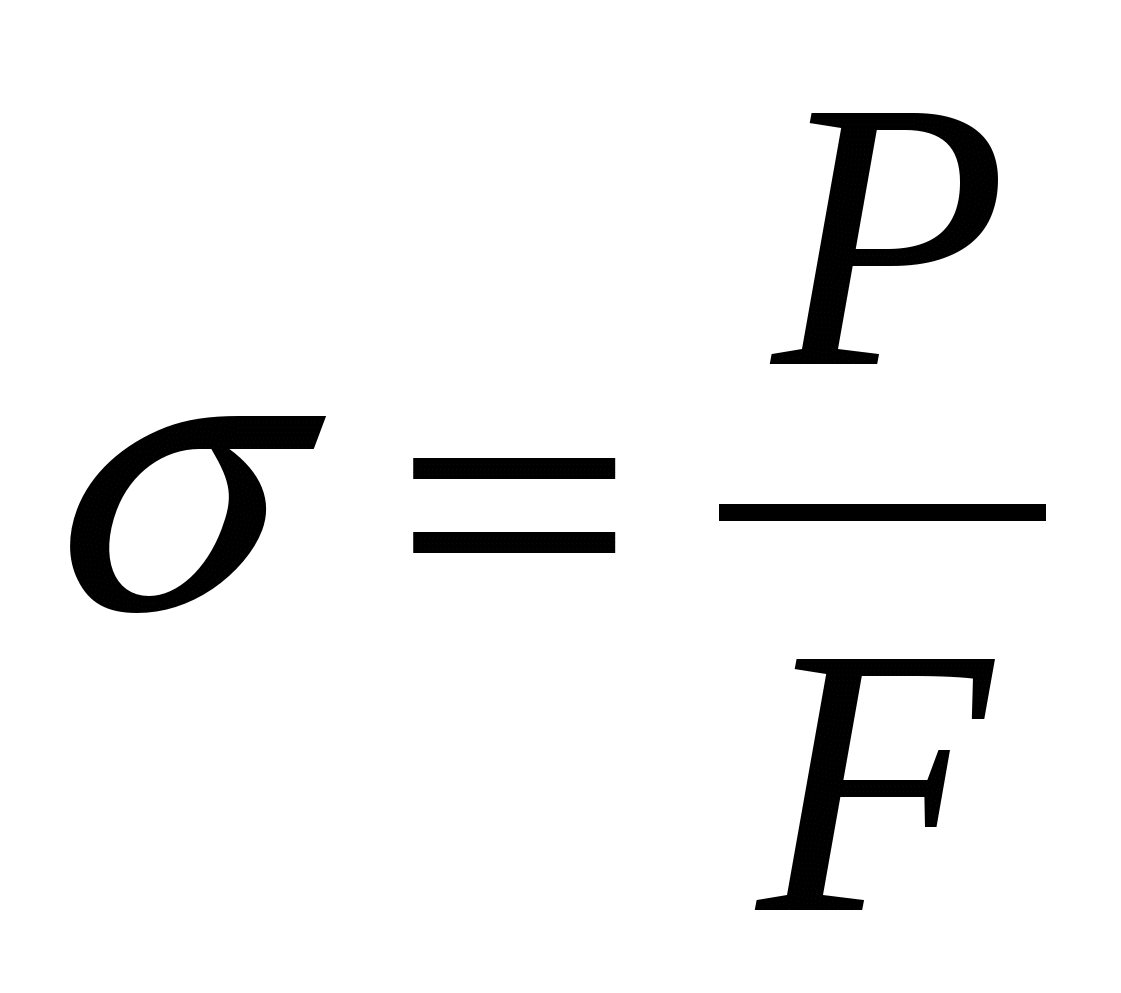

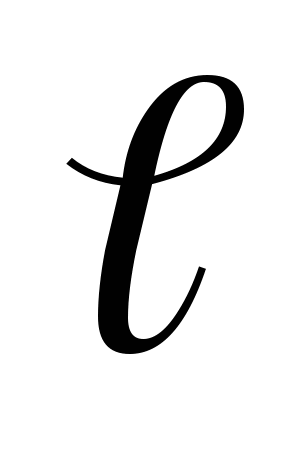 - длина растянутого образца. Деформация может быть упругой (исчезающей после снятия нагрузки) и пластической (остающейся после снятия нагрузки).
- длина растянутого образца. Деформация может быть упругой (исчезающей после снятия нагрузки) и пластической (остающейся после снятия нагрузки). - это максимальное напряжение, при котором в образце не возникают пластические деформации.
- это максимальное напряжение, при котором в образце не возникают пластические деформации.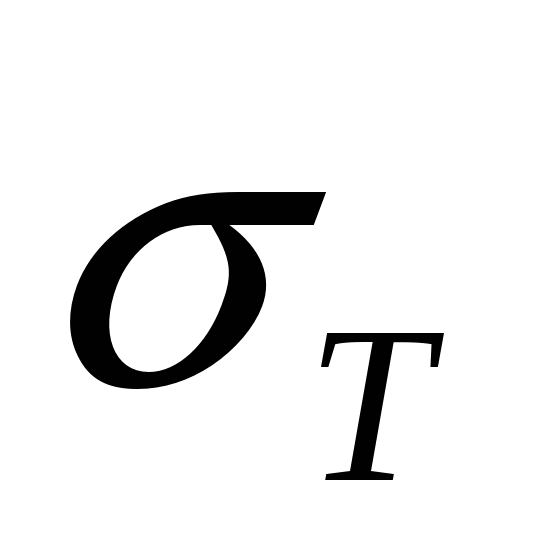 - это напряжение, соответствующее
- это напряжение, соответствующее — напряжение, вызывающее пластическую деформацию, равную 0.2%.
— напряжение, вызывающее пластическую деформацию, равную 0.2%.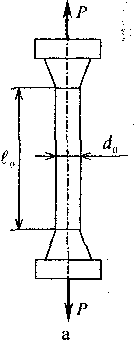

 - это напряжение, отвечающее максимальной нагрузке, которую выдерживает образец при испытании.
- это напряжение, отвечающее максимальной нагрузке, которую выдерживает образец при испытании.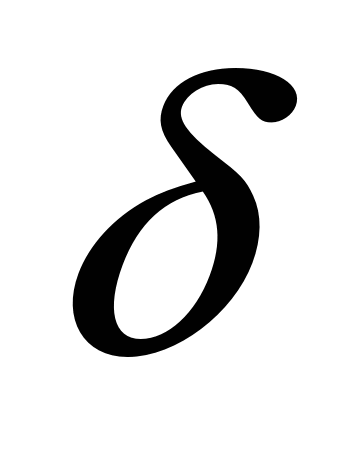 — отношение приращения длины образца при растяжении к начальной длине
— отношение приращения длины образца при растяжении к начальной длине  , %:
, %:
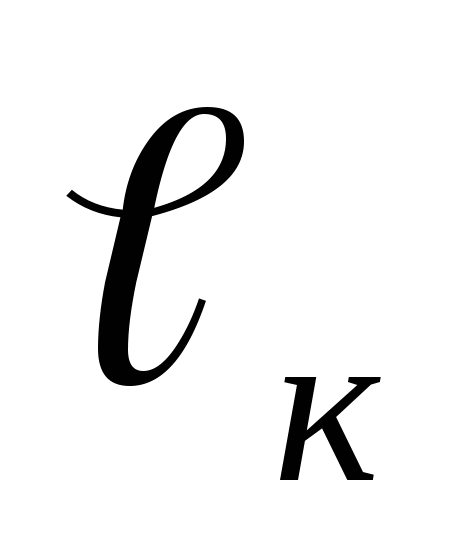 - длина образца после разрыва.
- длина образца после разрыва.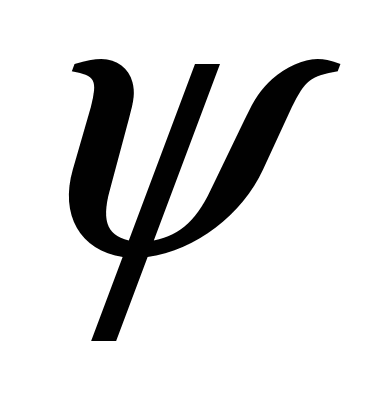 - называется уменьшение площади поперечного сечения образца, отнесенное к начальному сечению образца, %:
- называется уменьшение площади поперечного сечения образца, отнесенное к начальному сечению образца, %:
 - площадь поперечного сечения образца в месте разрыва. Относительное удлинение и относительное сужение характеризуют пластичность материала.
- площадь поперечного сечения образца в месте разрыва. Относительное удлинение и относительное сужение характеризуют пластичность материала.



