
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос. Первое начало термодинамики.
Данное уравнение показывает распределение энергии термодинамической системы. Допустим газ, заключённый под поршнем обладает внутренней энергией
Вопрос. Работа газа. Рассмотрим газ, находящийся под поршнем.
Р – давление, S – площадь поршня.
Полную работу, совершаемую газом, при изменении его от V1 до V2 найдем проинтегрировав
Данное выражение справедливо при любых изменениях объёмов жидких, газообразных. Работу совершённого газа также можно изобразить графически.
То есть работа совершённая газом определяется площадью заштрихованной фигуры.
Вопрос. Теплоемкость. Различают удельную и молярную теплоемкость.
Удельная теплоемкость показывает какое количество теплоты необходимо для нагревания одного килограмма вещества на один кельвин.
Различают также теплоемкости при постоянном объеме и при постоянном давлении когда процессе нагревания эти параметры остаются переменными (P=const V=const) Первое начало термодинамики для одного моля газа с учетом молярной теплоемкости.
Если газ нагревают при постоянном объеме то работа внешних сил равна 0 и сообщаемая газу теплота идет только на увеличение внутренней энергии.
Молярная теплоемкость при изохорном процессе. Если газ нагревается при постоянном давлении то первое начало термодинамики в виде.
Учитывая что что при нагревании газа P=const требуется дополнительное количество теплоты на совершение работы, так как постоянство давления обеспечивается увеличением объема. Выражение для Отношение
Вопрос. Изобарный процесс. Изобарный процесс подчиняется закону Гей-Люссака. См вопрос №2 При изобарном процессе газом совершается работа на увеличение объема.
Используя уравнение Клаперона-Менделеева для выбранных двух произвольных состояний
В изобарном процессе газу сообщается количество теплоты
Вопрос. Изохорный процесс. Подчиняется закону Гей-Люссака. (См вопрос №2) При изохорном процессе газ не совершает роботы над внешними силами.
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 286; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.175.182 (0.007 с.) |
 , получил некоторое количество теплоты Q и, перейдя в новое состояние, характеризуется внутренней энергией
, получил некоторое количество теплоты Q и, перейдя в новое состояние, характеризуется внутренней энергией  . При этом система (газ) совершил работу над внешней средой, то есть против внешних сил. Количество теплоты считается положительным, если оно подводится к системе, а работа положительная, когда система совершает ее против внешних сил. В соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии будет всегда одинаковым
. При этом система (газ) совершил работу над внешней средой, то есть против внешних сил. Количество теплоты считается положительным, если оно подводится к системе, а работа положительная, когда система совершает ее против внешних сил. В соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии будет всегда одинаковым  и равным разности между количеством теплоты Q полученном системой и работа А, совершённой системой против внешних сил
и равным разности между количеством теплоты Q полученном системой и работа А, совершённой системой против внешних сил  или в другой форме записи
или в другой форме записи  . Данное выражение является первым началом термодинамики и показывает что теплота сообщенной системе расходуется на изменение ее внутренней энергии и на совершение ею работой против внешних сил. Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии
. Данное выражение является первым началом термодинамики и показывает что теплота сообщенной системе расходуется на изменение ее внутренней энергии и на совершение ею работой против внешних сил. Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии  . Тогда согласно первому началу термодинамики
. Тогда согласно первому началу термодинамики  , то есть вечный двигатель первого рода невозможен, так как он совершал бы большую работу, чем сообщенная ему извне энергия.
, то есть вечный двигатель первого рода невозможен, так как он совершал бы большую работу, чем сообщенная ему извне энергия. Если газ расширяясь передвигает поршень на малое расстояние то он производен над ним работу
Если газ расширяясь передвигает поршень на малое расстояние то он производен над ним работу ,
,
 .
.

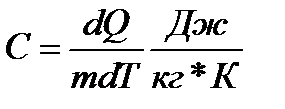



 Согласно формуле
Согласно формуле 

 не зависит от вида процесса определяется лишь температурой и всегда равна
не зависит от вида процесса определяется лишь температурой и всегда равна  . А также дифференцировав уравнение Клаперона-Менделеева
. А также дифференцировав уравнение Клаперона-Менделеева  получим
получим  данное выражение называется уравнением Майера и показывает что
данное выражение называется уравнением Майера и показывает что  на газовую постоянную (для молярной теплоёмкости). Это объясняется тем
на газовую постоянную (для молярной теплоёмкости). Это объясняется тем можно представить в виде
можно представить в виде 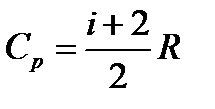 . Удельные теплоемкости.
. Удельные теплоемкости.  .
. называется показателем а
называется показателем а  адиабаты.
адиабаты.

 .
.
 .
. первое начало термодинамики.
первое начало термодинамики. и
и  .
. . Первое начало термодинамики для данного процесса имеет вид
. Первое начало термодинамики для данного процесса имеет вид  то есть вся теплота сообщаемая газу идет на увеличение его внутренней энергии
то есть вся теплота сообщаемая газу идет на увеличение его внутренней энергии  . Для произвольной массы газа
. Для произвольной массы газа  .
.


