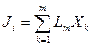Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Массы веществ, которые вступают в реакцию и образуются в результате реакции, пропорциональны их эквивалентным массам.
Лекция 2 ОСНОВЫ ТЕРМОДИНАМИКИ И БИОЭНЕРГЕТИКИ Термодинамика - наука о наиболее общих свойствах макроскопических материальных систем, находящихся в различных состояниях относительно термодинамического равновесия, и о процессах переходов между этими состояниями. К настоящему времени термодинамика содержит два основных раздела: 1. 1. Равновесная термодинамика (термодинамика изолированных систем) В основном разработана в середине 19-го – начале 20-го века и содержит три закона – три «Начала»: - -в середине 19-го века Ю. Р. Майером, Дж. Джоулем и Г. Гельмгольцем был сформулирован первые закон термодинамики - «Первое начало термодинамики». - - в 1850 году Р. Клаузиусом, и независимо от него в 1851 году У. Томсоном было сформулировано «Второе начало термодинамики». - -в 1906 году В. Нернст сформулировал «Третье начало термодинамики». 2. 2. Неравновесная термодинамика (термодинамика открытых систем) Разработана в 20-м веке. Содержит два основных подраздела: - -слабо неравновесную термодинамику, основы которой разработаны в 1931 Л. Онсагером; - -сильно неравновесную термодинамику, в основном разработанную Г. Хакеном, И. Пригожиным и Р. Томом в середине 20-го века. Первой работой в области неравновесной термодинамики в биологии является опубликованная в 1935 году книга Э.Бауэра «Теоретическая биология», в которой был сформулирован «Всеобщий закон биологии». 1.2. Основные термины и положения термодинамики Система – это совокупность материальных объектов (тел), ограниченных каким-либо образом от окружающей среды. В зависимости от характера взаимодействия с окружающей средой термодинамические системы делятся на три типа: 1) изолированная – система, которая не обменивается с окружающей средой ни веществом, ни энергией; 2) замкнутая – система, которая может обмениваться с окружающей средой лишь энергией и не может обмениваться веществом; 3) открытая – система, которая обменивается с окружающей средой и энергией, и веществом. Живые организмы являются открытыми системами: организм человека за 40 лет жизни потребляет в среднем 40 т воды, 6 т пищи и около 12 млн л кислорода.
Состояние любой термодинамической системы характеризуется двумя группами параметров: Интенсивными термодинамическими параметрами (давление, температура и др.), не зависящими от массы или числа частиц в системе; Экстенсивными термодинамическими параметрами (общая энергия, энтропия, внутренняя энергия), зависящими от массы или числа частиц в системе. Изменение параметров термодинамической системы называется термодинамическим процессом. Различают изотермические, изобарные, изохорные и адиабатические процессы. Многие химические реакции протекают без каких-либо внешних воздействий, т.е. без поступления энергии извне. Такое течение реакций называют самопроизвольным, но есть реакции, которые без внешнего энергетического воздействия не протекают (обжиг известняка, синтез углеводов в хлоропластах листьев растений, разложение воды), такие реакции называют несамопроизвольными – вынужденными. Для любой системы переход из любого произвольно выбранного состояния в другое в одном направлении будет самопроизвольным, а в противоположном – вынужденным. Вопрос о том, в каком направлении процесс будет протекать самопроизвольно, а в каком нет – один из основных вопросов прикладной химии (например, биологической химии). Энергию системы (W) можно представить как совокупность двух частей: зависящую от движения и положения системы как целого (W ц) и не зависящую от этих факторов (U).
Вторую составляющую этой совокупности U называют внутренней энергией системы. Она включает энергию теплового движения частиц, а также химическую и ядерную энергию, определяющую поступательное, колебательное и вращательное движение молекул, внутримолекулярное взаимодействие и колебание атомов, энергию вращения электронов. Внутренняя энергия в свою очередь разделяется на свободную энергию и связанную энергию. Свободная энергия (G) – та часть внутренней энергии, которая может быть использована для совершения работы. Связанная энергия (W св) – та часть энергии, которую нельзя превратить в работу.
Потоки и Термодинамические силы. В термодинамических системах, в которых имеются градиенты температуры, концентраций компонентов, химических потенциалов, возникают необратимые процессы теплопроводности, диффузии, химических реакций. Эти процессы характеризуются тепловыми и диффузионными потоками, скоростями химических реакций и т.д. Они называются общим термином «потоки» и обозначаются Ji, а вызывающие их причины (отклонения термодинамических параметров от равновесных значений) — термодинамическими силами (Хк). Связь между Ji и Хк, если термодинамические силы малы, записывают в виде линейных уравнений:
где i = 1, 2, …, m
|
|||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 222; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.102.225 (0.005 с.) |
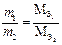 - это математическая запись закона эквивалентов, где т1 и m 2 - массы веществ; М(Э1) и М(Э2) – эквивалентные массы этих веществ. Эквивалент является важной количественной характеристикой элемента или вещества.
- это математическая запись закона эквивалентов, где т1 и m 2 - массы веществ; М(Э1) и М(Э2) – эквивалентные массы этих веществ. Эквивалент является важной количественной характеристикой элемента или вещества.