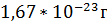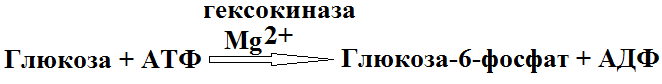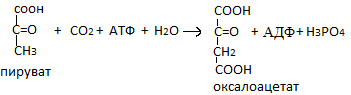Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Углеводы в биологических системахСтр 1 из 5Следующая ⇒
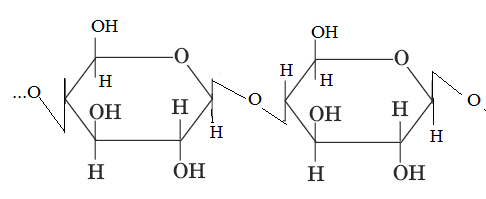
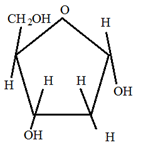
Важные гомополисахариды. Наиболее важный растительный полисахарид – крахмал. Крахмал является неоднородным веществом, он является смесью двух основных фракций: 1. Амилоза Молекулы амилозы имеют длинные не разветвленные цепи, состоящие из остатков α-Д-глюкозы. Они содержат от 1000 до 6000 остатков. Молекулярный вес от 160000 до 1млн. Амилоза растворима в воде, но растворы ее не стойкие, т.е. при стоянии выпадают в осадок.
При гидролизе амилозы образуется мальтоза. 2. Амилопектин Представляет собой разветвленные цепи, состоящие из остатков α-Д-глюкозы.
Точки ветвления повторяются через 25-30 глюкозных остатков. Молекулярный вес амилопектина значительно выше В большинстве случаев содержание амилозы в крахмале составляет 10-205, а амилопиктинов 80-90%. Гидролиз крахмала может быть кислотный или ферментативный. Гликоген (животный крахмал) – запасной полисахарид. Его много содержится в печени (до 20%), в мышцах (до 4%). Молекула гликогена построена аналогично молекуле амилопектина, но отличается большей ветвистостью, она более плотная и наружние ветви более короткие. Точки ветвления повторяются через 10-18 глюкозных остатков. Молекулярный вес свыше 4 млн. с йодом гликоген дает винно-красное окрашивание. С йодом амилоза дает синее окрашивание, а амилопектин – фиолетовое. Клетчатка (целлюлоза) – наиболее распространенный на земле полисахарид растительного происхождения, принадлежит к разряду внеклеточных веществ, выполняет структурную функцию. Целлюлоза обладает механической и химической прочностью, ее молекула представляет собой длинные полимерные цепи, имеющие линейное строение.
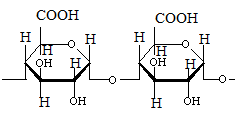
Мономером является β-Д-глюкоза. При гидролизе целлюлозы образуется дисахарид, который называется целлобиоза. Молекулы целлюлозы соединены в пучки, состоящие из параллельных цепей, связанных поперечными водородными связями. Целлюлоза – основной структурный компонент клеточных стенок растений. Общее количество глюкозных остатков в ее молекуле 6000-12000. Молекулярная масса 1-2 млн. Гемицеллюлозы Вместе с пектином, легнином и целлюлозой эти полисхариды входят в состав матрикса клеточных стенок растений.
Гемицеллюлозы делят на 3 группы: ü Ксиланы ü Маннаны ü Галактаны Есть еще арабаны Ксиланы содержатся в древесине, смоле, входят в состав клеточных стенок, образованы остатком β-Д-ксилозы соединенными 1,4-гликозидными связями.
Это низкомолекулярный полисахарид. В клеточных стенках растений он связан с пектиновыми веществами гликозидной связью. Маннаны состоят из остатков β-Д-монозы. Галактаны из β-Д-галактозы. Арабаны из β-Д-арбинозы.
Пектиновые вещества – это группа высокомолекулярных полисахаридов, также входящих в состав клеточных стенок растений. Основным структурным компонентом является галактуроновая кислота, из которой состоит основная цепь. Часть галактуроновых групп этерифицированы метиловым спиртом, а часть существует в виде солей.
В зависимости от количества метаксильных групп и степени полимеризации различают высоко и низко этерифицированные пектины. У высоко этерифицированных пектинов более 50% карбоксильных групп этерифицировано, а у низко этерифицированных менее 50%. Различают также пектиновые кислоты и их соли – пкетинаты. Также различают пектовые кислоты и их соли пектаты. Кроме того к пектиновым веществам относится вещество сложного строения протопектин, который представляет собой комплекс пектиновых веществ с другими полисахаридами. Он не растворим в воде. При технологической обработке плодов и овощей протопектин переходит в растворимое состояние. Пектиновые вещества состоят в ягодах, плодах, фруктах. Важной особенностью является способность к желированию в присутствии сахара 60-70% и в кислой среде. Пектиновые вещества способны образовывать гелий в присутствии перекиси водорода, кислот и сахара, а также солей кальция. Камеди и слизи. В их состав входят сахара такие как арбиноза, галактоза, ксилоза, а также галактуроновая и глюкороновая кислоты. Камеди при набухании в воде образуют вязкие гели или клейкие растворы. Слизи в контакте с водой образуют слизистые массы. Молекулы этих полисахаридов длинные и частично разветвленные. Эти вещества выполняют в растениях защитную функцию, некоторые из них образуются в ответ на повреждение тканей растений.
Азотосодержащие соединения. 1. Аминокислоты как мономеры белков 2. Классификация и функции белков 3. Связи в белковой молекуле 4. Пространственная структура белковой молекулы 5. Физико-химические свойства белков 1. Аминокислоты – это структурные компоненты белков, их мономеры. В результате гидролиза белковые вещества расщепляются до аминокислот. Аминокислоты являются органическими соединениями, содержащими аминогруппу и карбоксильную группу.
Наличием этих двух функциональных групп объясняется разнообразие физико-химических свойств аминокислот и разнообразие реакций в которых они участвуют. В природных соединениях встречаются α-аминокислоты. 23 аминокислоты входят в состав белков и называются протеиногенными. Другое свойство аминокислот входящих в состав белков связано сих оптической активностью. Все они являются L-изомерами. Название аминокислот сохраняются традиционные, часто ионии называются по источнику из которого были выделены. Первые аминокислоты были получены в 19веке. В настоящее время общеупотребительными являются их краткие названия. Аминокислоты – это твердые вещества, выделяемые в виде белого порошка, хорошо растворимы вводе и полярных растворителях. Аминокислоты отличаются большим структурным разнообразием, содержат различные функциональные группы, поэтому способны образовывать самые разные химические связи в молекуле. Аминокислоты обладают кислотно-основными свойствами и в зависимости от рН среды имеют положительный или отрицательный заряд, или же являются амфотерными соединениями. Основные химические свойства аминокислот. 1) Образование солей
2) Реакция со спиртами с образованием эфиров
3) Реакция с азотистой кислотой
По количеству выделившегося азота определяют содержание аминокислоты в растворе. Эта реакция лежит в основе количественного определения аминокислот по методу Ван-Сляйка. 4) Реакция с формальдегидом
В результате образуется кислота которую можно оттитровать щелочью.
По количеству щелочи, пошедшей на титрование, судят о количестве аминокислот в растворе. Эта реакция лежит в основе количественного определения аминокислот по методу Зёренсена.
Классификация аминокислот Аминокислоты, входящие в состав белков делят на 6 групп: 1. Моноаминомонокарбоновые кислоты В водяной среде эти кислоты электронейтральны, т.к образуют внутренние соли.
2. Диаминомонокарбоновые кислоты Содержат 2 амино группы и 1 карбоксильную. В водной среде проявляют основные свойства
3. Моноаминодикарбоновытые кислоты В водных растворах проявляют кислые свойства.
4. Диаминодикарбоновые кислоты В водной среде электронейтральны
5. Гомоциклические (ароматические) Имеют в своем составе фенильную группу
6. Гетероциклические аминокислоты Являются производными гетероциклических соединений
В качестве функциональных групп входящих в состав радикалов аминокислот могут быть представлены: гидроксильные группы, сульфгидрильные.
Аминокислоты обладают очень важной биологической функцией, они способны поддерживать определенные буферные свойства клеточного содержимого, т.к. содержат функциональные группы, ионизирующиеся при различных значениях рН.
Чтобы рассчитать значения буферов образуемых аминокислотами и их солями необходимо знать функциональные группы этих аминокислот. При определенном значении рН суммарный заряд аминокислот может равняться 0, такое состояние аминокислот называется изоэлектрической точкой. Важнейшая роль аминокислот в том, что они предшественники многих предшествующих молекул белков, пептидов, углеводов, липидных компонентов, гетероциклов и многих молекул биорегуляторов. Некоторые аминокислоты не способны синтезироваться в организме человека и должны поступать с пищей, такие аминокислоты называют незаменимыми: валин, лейцин, излейцин, триптофан, фенилаланин, лизин, аргенин, метеанин и треонин. 2. Белки – это высокомолекулярные природные полимеры, состоящие из аминокислот, соединенных пептидными связями.
Пептиды с низким молекулярным весом и с содержанием аминокислот менее 50% известны под названием просто пептидов. Юолее длинные пептиды – это белки. Пептиды являются биологически активными соединениями, среди них имеются антибиотики, гормоны, нейромедиаторы, токсины и различные яды. Размеры белковых молекул в среднем составляют 5-6 нанометров, а молекулярная масса 5000-500000 Да (дальтон). Белки в воде образуют коллоидные растворы, на поверхности коллоидных мицелл образуется гидратная оболочка, состоящая из молекул воды. В зависимости от аминокислотного состава белки несут определенный состав, и при определенном значении рН, их заряд становится равен 0, этот заряд соответствует изоэлектрической точке. В этой точке белки неустойчивы и выпадают в осадок. Классификация белков. По составу различают белки простые, которые состоят только из аминокислот и сложные, в состав которых входят и другие компоненты. Сложные белки делят на группы в зависимости от небелкового компонента, называемого простетической группой. 1. Липопротеиды – белки, образующие комплекс с жироподобными веществами. Это нестойкие вещества, легко разрушаются при замораживании и оттаивании. 2. Гликопротеиды – белковый компонент, связанный с кислым полисахаридом ионной связью. Плохо растворимы в воде, встречаются в опорных тканях. 3. Металлопротеиды –в состав молекулы входит металл, связанный непосредственно с белковым компонентом. В основном относятся ферменты.
4. Нуклепротеиды – в состав входят нуклеиновые вещества. Эти белки находятся в клеточном ядре. 5. Хромопротеиды – объединяют все окрашенные белки. В ней выделяют 2 подгруппы: 1) гомопротеиды – входят белки, содержащие группу гемм. К ним относится гемоглобин, миоглобин, окислительно-восстановительные ферменты: пероксидаза, каталазе. Группа гемм представляет собой производные протопорферина с атомами железа в центре молекулы.
2) флавопротеиды – белки ферменты, окрашенные в желтый цвет. В качестве простетической группы, они содержат витамин В2 (рибофлавин). По строению белковые молекулы делят на группы: · Глобулярные (ферменты, гемоглобин) · Фибриллярные (коллаген, кератин) Простые белки классифицируются по растворимости: 1. Альбумины (водорастворимые белки) 2. Глобулины (солерастворимые белки) 3. Проламины (растворимы в 60-70% растворе этилового спирта) 4. Глютелины (растворимы в 0,2% растворе NaOH) 5. Гистоны и протамины (белки с небольшой молекулярной массы, они щелочные и локализованы в ядрах клеток и рибосомах) 3. В состав белков входит большое количество аминокислот с различными функциональными группами, поэтому внутри нативной молекулы белки образуют ряд связей. Эти связи соответствуют двум типам: прочным и слабым. Прочная связь не может быть нарушена при беспорядочном тепловом движении. Скелет молекулы белка скреплен такими связями. К числу прочных связей относятся ковалентная связь, в том числе пептидная. Ее частота соответствует числу молекулярных остатков. Пептидная связь образуется при взаимодействии аминогрупп одной аминокислоты с кислотным остатком другой. Доказательством существования в белках пептидной связи является биуретовая реакция. Следующая прочная связь: дисульфидная. АК цистеин выполняет особую роль, т.к. при ее окислении боковые цепи молекулы белка соединяются и образуется дисульфидная связь. Для многих белков эта связь является решающим структурным фактором. Расщипление этой связи возможно только при восстановлении сульфгидрильных групп, но при этом белки теряют свои нативные свойства. Значение этой связи заключается в том, что она фиксирует пространственную конфигурацию в полипептидной цепи.
Эта связь может образовываться между полипептидными цепями между разных молекул. Слабые связи. Среди них наибольшее значение имеет водородная связь. Природа этой связи проста. Группа ковалентно связанных атомов –ОН, -NH имеют большие дипольные моменты. В области ядра водорода находится избыточный положительный заряд. Так как плотности электрона вокруг ядра выше и так как водород имеет только один электрон, отрицательно заряженные группы других молекул могут приблизиться к протону вплотную при этом возникает электростатическое взаимодействие называемое водородной связью. Биологическое значение этой связи заключается в том что в больших молекулах содержится большое количество групп способных образовывать водородную связь, в этом случае она обладает большой силой. Водородные связи обладают вторичной и третичной структурой.
Ионная связь. Молекула белка находясь в растворе содержит большое количество ионизированных групп Гидрофобные взаимодействия аминокислот имеющие гидрофобные боковые цепи находятся большей частью внутри молекулы белка, в то время как полярные аминокислоты находятся на поверхности. Такое расположение гидрофобных групп обусловлено силами Вандервальса. Гидрофобные группы сближаясь могут образовывать такую фазу молекулярного масштаба, в которой молекулы воды совершенно не могут проникнуть. За счет гидрофобных взаимодействий происходит искажение и других связей: тиоэфирные и др. 4. Белки способны самопроизвольно формировать и удерживать определенную пространственную структуру. Обычно рассматривают 4 организации структуры молекулы: vПервичная – представляет собой последовательность аминокислотных остатков в молекуле белка. Она иодируется структурным геном белка. vВторичная – представляет собой пространственное расположение атомов главной цепи молекулы белка на отдельных ее участках. Существует два вида вторичной структуры: 1. α-спираль – при ее образовании пептидная цепь закручивается вокруг оси. Стабилизация спирали обеспечивается водородной связью. 2. β-структура (складчатый слой) – пептидные цепи располагаются параллельно друг другу образуя пространственную структуру напоминающий складчатый лист гармошкой. Иногда встречается третий тип: беспорядочный клубок, он представляет собой чередование α и β структур. vТретичная структура – под ней понимают распределение в пространстве всех атомов в белковой молекуле и не учитывается взаимодействие этой молекулы с соседними. Третичная структура основа функциональности белка. Она зависит от всей суммы ковалентных и нековалентных связей белковой молекулы. vЧетвертичная – это ассоциация нескольких полипептидных цепей, которая образуется посредством нековалентных связей. Каждая полипептидная связь образованная четвертичной структурой называется субъединицей.
5. Физико-химические свойства белков 1. Денатурация (свертывание) – это существенное изменение вторичной, третичной и четвертичной структуры белка сопровождающиеся нарушением системы нековалентных взаимодействий. При денатурации первичная структура белка не изменяется. Денатурация может быть вызвана различными факторами: ü Высокая температура. Белки животного происхождения имеют температуру денатурации t=40-50C, растительного 50-60С, микробного происхождения выше 70С. Температура денатурации зависит от присутствии в среде других веществ, например, многие белки стабилизируются ионами Ca. ü рН среды ü механическое воздействие (перемешивание, встряхивание) ü различного рода излучения, токи высокой частоты, высокое давление ü из химических факторов денатурацию вызывают соли тяжелых металлов, ПАВ обладающие полярными молекулами. В результате денатурации белки утрачивают функциональные свойства. 2. Гидрофильность белков. Белки как и аминокислоты являются амфотерными электролитами, т.е. они могут иметь определенный суммарный заряд при определенном рН среды. Для каждого белка существует такое значение рН среды, при котором его молекула электронейтральна, такое состояние называется изоэлектрической точкой и зависит от числа и природы заряженных групп в молекуле. В изоэлектрической точке белок обладает наименьшей растворимостью и наибольшей вязкостью. Изоэлектрическая точка одна из характерных констант белка. Если довести раствор до изоэлектрической точки то сам по себе белок не выпадает в осадок, это объясняется гидрофильностью белковой молекулы. Если удалить эту оболочку, то молекулы начинают агрегировать под действием собственной силы тяжести и выпадают в виде осадка. Удалить водную оболочку можно с помощью солей щелочных, щелочноземельных металлов и органических растворителей.
Ферменты 1. Механизм действия и особенности ферментов как биологических катализаторов 2. Строение ферментов 3. Влияние различных факторов среды на ферментативную активность 4. Классификация и номенклатура 1. Ферменты – это биологические катализаторы, имеющие белковую природу. Они обладают белковыми свойствами: · Это самые эффективные из всех известных катализаторов. В присутствии ферментов реакции в клетке протекают в миллион раз быстрее. · Большинство ферментов обладает специфичностью действия. Различают специфичность субстрата и реакции. Специфичность бывает абсолютная, групповая и оптическая (стереохимическая) · Действие большинства ферментов регулируются, т.е. они способны переходить из состояния с низкой активность к состоянию с высокой и обратно. Механизм действия. Общие черты ферментативного катализа можно представить в рамках теории индуцированного соответствия, разработанная Кошландом. Основные стадии ферментативной реакции можно записать в виде схемы.
Е – энзим (фермент) S – субстрат ES – ферментсубстратный комплекс Р – продукт реакции В 60-е годы XX века общераспространенной теорией описывающей механизм действия ферментов была теория Фишера, в которой фермент подходит субстрату как ключ к замку. Кошланд усовершенствовал эту теорию, в современной теории говорится о том, что фермент в момент взаимодействия индуцируется субстратом, т.е изменяется таким образом что его активный центр соответствует по его пространственной структуре субстрату. Энергия активации – это количество энергии, которое необходимо сообщить молекулам реагирующих веществ, чтобы перевести их в активное состояние соответствующее вершине активационного барьера. Сущность действия ферментов заключается в том, что биологический катализатор, снижая энергию активации направляя реакцию обходным путем, что позволяет молекулам преодолевать активационный барьер на более низком уровне.
2. Ферменты могут представлять собой простые или сложные белки. В каждом ферменте имеется особый участок молекулы белка, с которым может связываться субстрат или несколько с образованием субстрат-ферментного комплекса. Этот участок называется активным центром ферментов. Активный центр построен из нескольких аминокислотных остатков. Эти остатки сближены, но часто в белковой молекуле они далеко отстоят друг от друга. Многие ферменты для проявления каталитической активности нуждаются в присутствии некоторых органических веществ небелковой природы а так же ионом металлов. Ферменты делят на однокомпонентные и двухкомпонентные, в состав которых входит небелковая часть. Небелковые компоненты ферментов называют коферментами или кофакторами. Коферменты – органические соединения, чаще всего витамины, участвуют в переносе функциональных групп субстрата, входят в состав активного центра ферментов. У ряда ферментов коферментами являются витамины: В1, В2, В6, В12, РР, пантотеновая кислота. Кофакторы – чаще всего неорганические вещества, обычно металлы. Многие металлы оказывают на ферменты активирующее действие. 1/3 фермента или содержит ионы металлов или активируется ими. Активный центр фермента имеет сложное строение, состоит из каталитического центра и пространственно ограниченного центра связывания. Каталитический центр отвечает за природу катализируемой реакции, а центр связывания за сродство субстрату. В состав центра входят карбоксильные, аминные и сульфгидрильные группы аминокислот. Ферменты в состав которых входит сульфгидрильная группа – тиоловые ферменты. 3. Единица активности фермента – это такая активность, при которой 1 мкмоль субстрата превращается в продукт в единицу времени. Скорость ферментативной реакции зависит от температуры среды и от концентрации реагирующих веществ. Эти факторы приводят к увеличению частоты и энергии реагирующих молекул. Для ферментов белков характерна предельная температура выше которой они денатурируют. Оптимальная температура действия фермента зависит от природы фермента. Температура, при которой происходит денатурация фермента называется инактивацией. Следующий фактор рН среды. Для большинства ферментов оптимальный рН находится в нейтральной и слабокислой областях. Давление оказывает незначительное влияние на скорость ферментативной реакции. Ингибиторы и активаторы. Некоторые катионы и анионы могут активировать ферменты, но особая роль в регуляции ферментативной активности принадлежит ингибиторам. Ингибиторы – молекулы, которые связываясь с ферментом блокируют какую-либо стадию ферментативной реакции, они бывают обратимыми и необратимыми. Необратимые связываются с ферментом необратимо и действие их не регулируется. Обратимые ингибиторы делят на конкурентные, неконкурентные и бесконкурентные. Конкурентный ингибитор – молекула на столько похожа по своей структуре на субстрат, что фермент не может их различить, в результате связывания конкурентного ингибитора с активным центром фермента, падает концентрация ферментсубстратных комплексов и следовательно, уменьшается скорость реакции. Неконкурентный ингибитор – молекула связывающаяся не с активным центром фермента а с каким-либо другим его участком. Такой тип реакции называется аллостерическая регуляция. Бесконкурентный ингибитор – молекула, которая связывается только с ферментсубстратным комплексом и не может связываться со свободным ферментом. 4. Традиционно все названия ферментов отражают их функцию и фермент называют или по субстрату или по реакции добавляя окончание –аза (гидролаза, декарбоксилаза). Современная номенклатура и классификация ферментов основана на типах реакции, которые они катализируют. Все ферменты делят на 6 классов: 1) Оксидоредуктазы – катализируют о.в. реакции. К ним относятся оксидазы, редуктазы, дегидрогиназы. 2) Трансферазы – катализируют перенос групп (например метильных, аминных, фосфатных) от одного соединения к другому. 3) Гидролазы – ферменты катализирующие гидролиз химических связей (эфирных, пептидных). Пример: амилазы, липазы. 4) Лиазы – катализируют отщепление групп от субстрата с образованием двойных связей или наоборот присоединение групп по двойным связям. 5) Изомиразы – катализируют взаимное превращение изомеров. 6) Лигазы (синтетазы) – катализируют синтез молекул, сопряженный с гидролизом пирофосфатных связей в молекулах АТФ. Нуклеиновые вещества 1. Нуклеозиды и нуклеотиды 2. ДНК 3. РНК
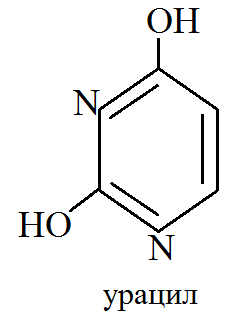
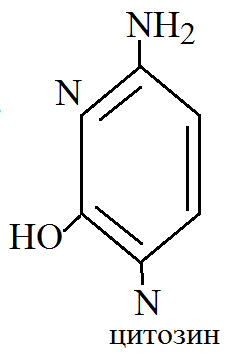
1. Все типы клеток содержат вещества, состоящие из 3 компонентов: гетероциклического основания, углевода и фосфорной кислоты. Они получают название нуклеиновых веществ. Эти вещества образуют значительную группу коферментов и являются составной частью высокомолекулярных природных полимеров нуклеиновых кислот. Нуклеиновые вещества содержат 2 типа гетероциклических оснований: пуриновые и пиримидиновые. Среди пиримидиновых оснований наибольшее значение имеют урацил, тимин и цитозин.
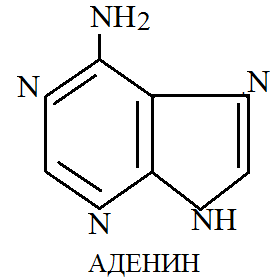
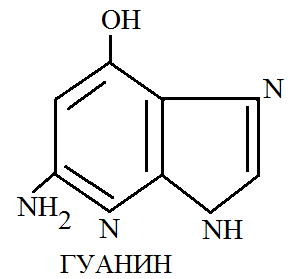
Среди пуриновых оснований наибольшее значение имеют аденин и гуанин.
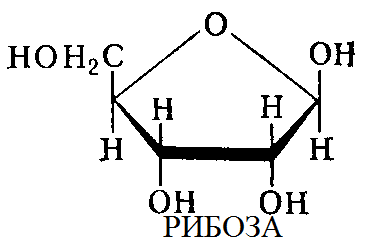
Второй компонент представлен углеводами двух типов: рибозы и дизоксирибозы.
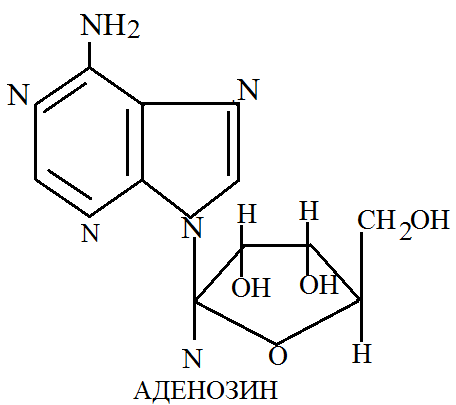
В зависимости от того какая из пентоз входит в состав нуклеотидов и полинуклеотидов их различают: дизоксирибонуклеиновая и рибонуклеиновая. Продукты неполного гидролиза нуклеиновых кислот, состоящие из углевода и азотистого основания называют нуклеозиды.
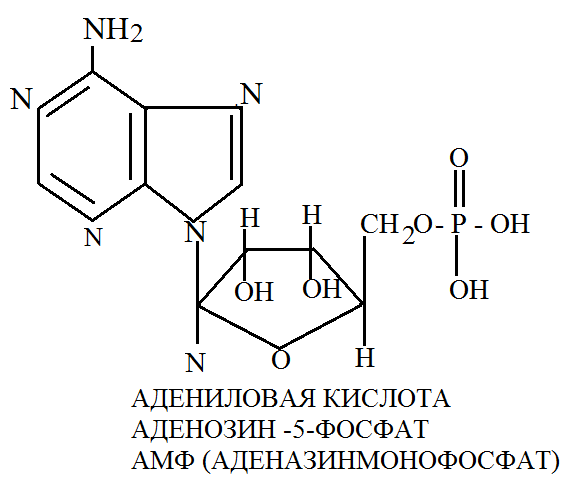
Пуриновые нуклеозиды называют по основанию добавляя к корню его названия «озин»: аденозин. Перемединовые нуклеозиды называют по основанию прибавляя окончание «идин»: уридин, цитидин. Нуклеотиды. Имеют сложное строение и при гидролизе распадаются на азотистое основание, пентозу и фосфорную кислоту. Нуклеотиды представляют собой свободные соединения, находящиеся в клетках и тканях организмов, а также являющиеся продуктами гидролиза нуклеиновых кислот. В основу номенклатуру нуклеотидов положено 2 принципа: они обозначаются или по своему основанию (адениновая кислота) или по своему нуклеозиду и при этом указывается замещение через фосфат.
Одним из важнейших соединений нуклеотидной природы является аденазин-3-фосфат или АТФ. Это соединение содержит 3 остатка фосфорной кислоты.
Нуклеотиды выполняют особые функции в биологических системах. АМФ, АДФ и АТФ представляют собой систему адениловых кислот, которая участвует в энергетическом обмене благодаря способности атомов фосфора в фосфатной группе АТФ присоединять электрон, поэтому при расщеплении пирофосфатной связи и передачи фосфатной группы на другое вещество выделяется значительное количество энергии, трансформируемой в организме на разнообразные энергетические нужды. При гидролизе освобождается 40-60кДж/моль химической энергии в зависимости от локализации реакции в клетке. Обратный процесс или синтез АТФ и АДФ и неорганического фосфора сопровождается потреблением энергии.
Подобная реакция называется реакцией фософорилирования. 2. ДНК Нуклеиновые кислоты – это важнейшие биополимеры, осуществляющие хранение и передачу генетической информации в живой клетке. Доказано, что содержание ДНК в любой клетке постоянно и не зависит от условий внешней среды. Количество ДНК увеличивается по мере нарастания сложности клеток. Каждый вид имеет свой специфический нуклеотидный состав ДНК. Каждый организм содержит участки ДНК сходные с участками ДНК его родителей, но ДНК каждого индивидуального существа уникально. Мономерами молекулы ДНК являются нуклеотиды. В ее составе из углеводов содержатся только дизоксирибоза, а большую часть оснований составляют гуанин, тимин, цитозин и аденин. Полная структура ДНК была установлена американскими учеными Уотсоном и Криком в 1953 году. Основные черты модели ДНК 1) Молекула ДНК построена из 2 полинуклеотидных цепей ориентированных антипараллельно и на всем протяжении связанных водородными связями друг с другом. 2) Водородные связи между цепями образуются за счет специфического взаимодействия аденилового остатка одной цепи с тиминовым остатком другой, гуанилового с цитозиновым. Основания образовавшейся пары комплементарны. 3) Первичная структура одной цепи молекулы ДНК комплементарна первичной структуре другой цепи. 4) Обе цепи закручены в спираль, имеющую ось и могут быть разделены только путем раскручивания. Пуриновые и пиримидиновые основания обращены внутрь спирали, их плоскости перпендикулярны оси абсцисс и параллельны друг другу. Между основаниями возникают гидрофобные взаимодействия, стабилизирующие двойную спираль более чем водородные связи. Кроме того существуют закономерности в строении молекулы ДНК, которые называются правилом Чаргаффа: 1. В молекуле ДНК сумма пуриновых оснований равна сумме пиримидиновых. 2. Содержание аденина равно содержанию тимина, а содержание гуанина равно содержанию цитозина. 3. В зависимости от преобладания пары оснований различают: аденин-тиминовый тип или гуанин-цитозиновый. Первичная структура это последовательность нуклеотидных остатков. Вторичная структура представляет собой двойную спираль, которая может быть 4-х типов: А, В, С, Z. Форма спирали зависит от степени гидратации молекулы. А форма -кристаллическая существует при содержании воды не более 40%. В форма – паракристаллическая, воды не более 40%. В метаболически активных тканях преобладает В форма. В живых клетках у эукариот ДНК сосредоточено в ядре, а так же в метохондриях и хлоропластах. В ядре ДНК соединено с белками и этот комплекс называется хромотином и представляет собой основу генетического материала хромосом. У прокариот ДНК имеет кольцевую форму, содержит мало белков и связано с металлами и аминами образуя рассеянное ядерное вещество. Молекулы ДНК имеет длину до 10нм и массу 3. Различают 3 основных типа РНК. РНК обычно содержат углевод – рибозу, а из оснований присутствует аденин, гуанин, цитозин, урацил. Кроме того содержатся некоторые метелированные производные оснований. Содержание пуриновых и пиримидиновых оснований в РНК неодинаково, исключения составляют транспортные РНК. Виды РНК: · Рибосомные РНК (РРНК) – сосредоточены в рибосомах цитоплазмы. Предполагается что она выполняет структурную функцию. Встречается в различных формах и образует с белком сложный надмолекулярный комплекс, в котором происходит биосинтез белка. На долю РНК приходится свыше 80% всей клетки. · Матричное или информационное РНК. Она выполняет роль матрицы при синтезе белка, по своему нуклеотидному составу соответствует ДНК той же клетки. Существует столько различных информационных РНК, сколько белков в организме. В информационных РНК около 2% всей РНК клетки. · Транспортное РНК (ТРНК). Ее молекула выполняет функцию акцептора активированной аминокислоты и адаптера для переноса ее к месту синтеза молекулы белка на матрице информационной РНК. ТРНК обеспечивает размещение каждой аминокислоты на соответствующем участке полипептидной цепи. ТРНК имеет сложную структуру, ее молекула может иметь участки односпиральные, а также двухспиральные за счет присутствия комплементарных нуклеотидных пар. Как правило, ТРНК представляет собой 4 спирализованных участка и 3 или 4 одноцепочечных петли.
Другие типы РНК представляют собой одноцепочечные молекулы. РНК локализованы в ядре и цитоплазме клетки, ТРНК находится в цитоплазме в растворенном виде. Основой генетического кода являются нуклеотиды. Генетический код представляет собой совокупность нуклеотидов ДНК функционирующих в виде кодонов, по 3 нуклеотида в каждом. Код универсален, у всех животных один и тот же код, т.е. каждая аминокислота кодируется вполне определенными кодонами на стадии биосинтеза белка у всех организмов одинаково. Каждая аминокислота кодируется не одним кодоном.
Обмен углеводов 1. Фосфорилирование глюкозы 2. Глюконеогенез 3. Гликолиз 4. Цикл Кребса 5. Петозофосфатный цикл 6. Синтез и превращение углеводов 1. Все клетки способны к превращениям глюкозы и содержат фермент гексакиназу. Глюкоза во всех клетках может вступать лишь в одну реакцию фосфорилирования.
Фермент гексакиназа не специфичен и проявляет способность катализировать также образование фосфорных эфиров фруктозы, галактозы и т.д. Важным свойством этого фермента является ингибирование продуктами реакции глюкозы-6-фосфат. В клетках всегда присутствует еще один фермент, который катализирует, который катализирует эту реакцию – глюкокиназа. Этот фермент не ингибируется продуктами. 2. Глюконеогенез – это процесс образования нового сахара из неуглеводных предшественников среди которых наибольшее значение имеют пировиноградная кислота (пируват) и молочная кислота (лактат). Глюконеогенез это анаболический путь. Пируват в организме частично превращается в глюкозу через цикл Кори. Этот цикл включает 2 стадии: 1) Карбоксилирование пирувата, она включает в себя 7 реакций.
1. 2. 3. 4. 5.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 622; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.126.74 (0.16 с.) |
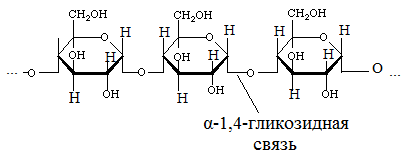
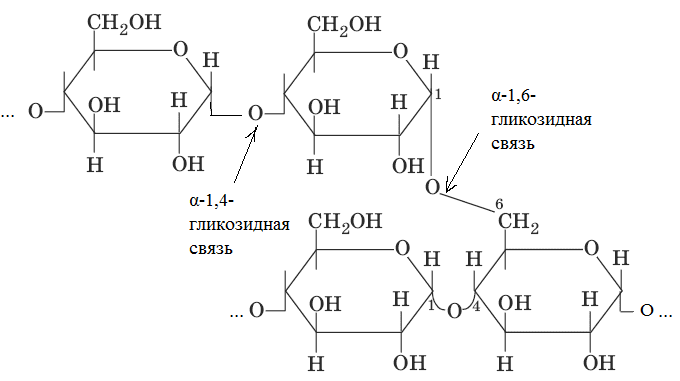
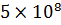 . С горячей водой амилопектин образует клейстер. Если рассмотреть под микроскопом, крахмал представляет собой зерна, они могут иметь разную форму, размеры, слоистость.
. С горячей водой амилопектин образует клейстер. Если рассмотреть под микроскопом, крахмал представляет собой зерна, они могут иметь разную форму, размеры, слоистость.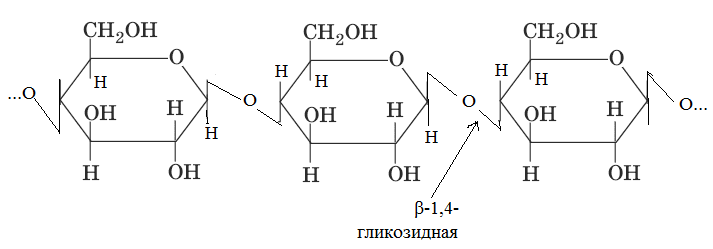





















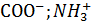 . В каждой определенный момент времени часть этих групп полностью ионизирована, поэтому протоны переходят от одной группы к другой что приводит к флуатации дипольного момента, который индуцирует диполи в соседних молекулах. Электростатические силы, возникшие при этом, называют ионными силами.
. В каждой определенный момент времени часть этих групп полностью ионизирована, поэтому протоны переходят от одной группы к другой что приводит к флуатации дипольного момента, который индуцирует диполи в соседних молекулах. Электростатические силы, возникшие при этом, называют ионными силами.



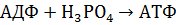
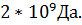 1Да=
1Да=