
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зміст лабораторного практикумуСтр 1 из 20Следующая ⇒
Ардашев В.О., П’ятак, О.В.
ТЕПЛОТЕХНІКА
Лабораторні роботи
Херсон 2003
УДК 621.036 А 79 ББК 31.3
Ардашев В.О., П’ятак, О.В. А 79 Теплотехніка. Лабораторні роботи: Навчальний посібник. - Херсон, ОЛДІ-плюс, 2003 - 142 c.
ISBN 5-7763-0029-0
Наведені 10 лабораторних робіт з курсу “Теплотехніка”, які охоплюють термодинаміку, теплопередачу і промислову теплотехніку. Даються методичні вказівки до проведення робіт, розрахунків та оформлення лабораторних звітів. Навчальний посібник призначений для студентів технічних і технологічних спеціальностей.
Рецензенти: Михайлик В.Д., д.т.н., завідувач кафедри екології і БЖД Херсонського державного технічного університету
Грицак В.Т., к.т.н., доцент Херсонського відділення Європейського університету
Рекомендовано Міністерством освіти і науки України лист № 14/18.2-800 від 15.04.2002 р. ББК 31.3
ISBN 5-7763-0029-0 © В.О.Ардашев, О.В.П’ятак, 2003 © "ОЛДІ-плюс", 2003 ВСТУП Лабораторія теплотехніки Лабораторні роботи по курсу “Теплотехніка” охоплюють три основні частини дисципліни: термодинаміку, теплопередачу і промислову теплотехніку. Вони проводяться у спеціальній лабораторії на діючих лабораторних установках. Кількість лабораторних установок дозволяє виконувати 9 і більше лабораторних робіт. На деяких установках можливе проведення 2-3 робіт. Основним джерелом виділення теплоти є електричне нагрівання при проходженні струму по провіднику. Як теплоносій використовується повітря. Частина установок дозволяє досліджувати термодинамічні процеси, друга частина – процеси теплопередачі і третя відноситься до теплотехнічного обладнання.
Зміст лабораторного практикуму
В залежності від спеціальності лабораторний практикум проводиться на чотирьох або дев’яти лабораторних роботах. На виконання роботи відводиться 4 години. В кожній роботі даються теоретичні викладки, тому практикум може проходити паралельно з прослуховуванням лекційного матеріалу. Кожна робота складена за єдиним планом: мета і задача роботи, теоретичні викладки, хід виконання роботи, проведення експерименту, обробка результатів, оформлення звіту по роботі, контрольні питання.
Лабораторний практикум закріплює знання по таких питаннях курсу: теплоємність газів, побудова процесів водяної пари і вологого повітря в діаграмах і-s i І-d, цикли холодильних установок, термодинамічні процеси вологого повітря, процеси теплопередачі через циліндричну та плоску стінки, процеси конвективного теплообміну по тепловіддачі, визначення зольності і вологості палива та показників якості води. Принципи складання лабораторних установок І найбільш поширене лабораторне обладнання, Оформлення лабораторних робіт і Складання звітів по роботі Кожна лабораторна робота оформлюється у вигляді звіту. Зразок оформлення титульного листа показаний на стор.5. В кінці методичних вказівок до кожної лабораторної роботи є форма складання звіту. Тому на наступних аркушах звіту записуються всі ті розділи, що позначені у формі. Лабораторні роботи виконуються студентами побригадно. Кількість студентів у бригаді залежить від кількості лабораторних робіт, що виконуються згідно з навчальним планом. Нумерація і назва робіт: 1. Визначення теплоємності повітря. 2. Побудова термодинамічних процесів водяної пари в і-s діаграмі. 3. Побудова термодинамічних процесів вологого повітря в І-d діаграмі. 4. Дослідження термодинамічних процесів вологого повітря. 5. Визначення ефективності роботи парокомпресійної холодильної установки. 6. Визначення коефіцієнтів тепловіддачі при вимушеному руху повітря у трубі. 7. Визначення коефіцієнтів теплопередачі через багатошарову циліндричну стінку. 8. Визначення показників якості води. 9. Визначення вологості і зольності палива. 10. Визначення коефіцієнтів тепловіддачі при вільному руху повітря у трубі.
Кожна бригада виконує свій номер лабораторної роботи. На наступне заняття бригада готує канву звіту і вивчає матеріали другої за номером роботи.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ХЕРСОНСЬКИЙ ДЕРЖАВНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ Кафедра обладнання хімічних виробництв і підприємств будівельних матеріалів
ЛАБОРАТОРНА РОБОТА №….
(назва роботи)
Виконав студент гр. (прізвище та ініціали)
Перевірив (прізвище та ініціали викладача)
Херсон – (рік)
Лабораторна робота № 1 ВИЗНАЧЕННЯ ТЕПЛОЄМНОСТІ ПОВІТРЯ
МЕТА І ЗАДАЧА РОБОТИ Мета роботи – закріплення теоретичних знань по розділах: “І закон термодинаміки” та “Термодинамічні процеси”. Задача роботи – здобуття навичок у проведенні калориметричного досвіду та експериментальне визначення теплоємності повітря.
ЛАБОРАТОРНА УСТАНОВКА
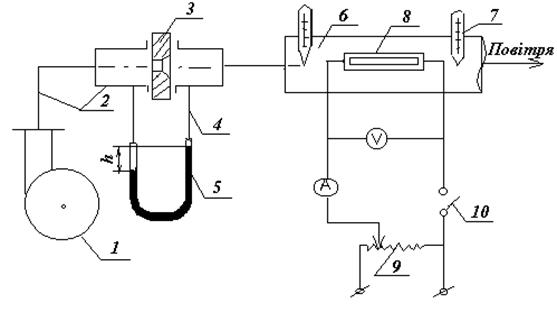
Рис. 1.1. Схема експериментальної установки
Установка складається з вентилятору 1, який обертається електродвигуном. Вентилятор подає повітря по повітроводу 2 на звужуючий пристрій, за допомогою якого визначається витрата повітря. Звужуючий пристрій складається з діафрагми 3, імпульсних трубок 4 та U-подібного дифманометру 5. Діафрагма являє собою диск з отвором, центр якого співпадає з центром диску та віссю повітроводу 2. У залежності від товщини диску діафрагму виготовляють або з кінцевим розширенням у бік виходу потоку, або без нього. Отвір з боку входу потоку має гостру кромку. Імпульсними трубками служать гумові шланги, які з’єднують отвори в повітроводі до та після діафрагми із скляними трубками дифманометру. Як U-подібний дифманометр використовується стандартний дифманометр ДТ-50. При русі повітря через місцевий опір – діафрагму на ній утворюється перепад тисків, який урівноважується висотою стовпа рідини в дифманометрі. Висота стовпа рідини Dh вимірюється по шкалі дифманометру. Чим більш витрата повітря, тим більш висота стовпа та навпаки. Після звужуючого пристрою повітря надходить до проточного калориметру, який складається з труби 6 з діаметром, який дорівнює діаметру повітроводу, термометрів 7 та електропідігрівача 8. Початкова і кінцева температура повітря вимірюється термометрами, встановленими до і після електронагрівача по напрямку руху повітря. Напруга та сила струму на підігрівачі вимірюється амперметром та вольтметром. Потужність електронагрівача регулюється лабораторним автотрансформатором (ЛАТР) 9. Електронагрівач вмикається перемикачем 10.
ПОРЯДОК ВИКОНАННЯ РОБОТИ 4.1. Увімкнути вентилятор. 4.2. Увімкнути перемикач 10, який подає напругу на електронагрівач. 4.3. Поворотом ручки ЛАТРу встановити задану викладачем величину сили струму у мережі електронагрівача. Величина сили струму контролюється по амперметру. 4.4. На протязі 10-15 хвилин відбувається підігрів повітря в установці. За даний час установка виходить на стаціонарний режим роботи, при якому показники термометрів не змінюються. 4.5. У стаціонарному режимі роботи виміряти: напругу – по вольтметру, силу струму – по амперметру, температуру повітря до та після нагрівання – по термометрам, висоту урівноваженого стовпа рідини – по дифманометру. Результати вимірів записуються у таблицю 1.2. 4.6. Після запису показань приладів ручкою ЛАТРу встановити інше значення сили струму, перечекати вихід на стаціонарний режим роботи, а потім зробити запис нових вимірювань. Дослід повторюється в інших умовах. Кількість дослідів встановлюється викладачем. 4.7. Після проведення дослідів ручкою ЛАТРу знімається напруга у мережі нагрівача, вимикається перемикач 10 та через 5 хвилин вимикається вентилятор.
ФОРМА ПОДАННЯ ЗВІТУ Звіт по лабораторній роботі подається на подвійному аркуші учнівського зошиту. На першій сторінці оформлюється титульний лист. На інших сторінках розміщається: 1. Мета та задача роботи 2. Схема установки та короткий опис її роботи 3. Таблиця 1.1 – вимірювання дослідних даних 4. Таблиця 1.2 – розрахункових значень теплоємності 5. Таблиця 1.3 – розрахункових значень параметрів ізобарного процесу та похибки досліду 6. Висновки по роботі Звіт складається та пред’являється студентом до захисту індивідуально.
КОНТРОЛЬНІ ПИТАННЯ ДЛЯ САМОПЕРЕВІРКИ 7.1. Ціль та задачі роботи. 7.2. Дати визначення масової, мольної та об’ємної теплоємності. 7.3. Взаємозв’язок між видами теплоємності. 7.4. Середня та істина теплоємності. 7.5. Ізобарна та ізохорна теплоємності. 7.6. Рівняння Майєра. 7.7. Формула для визначення середньої масової ізобарної теплоємності. 7.8. Схема лабораторної установки та її робота. 7.9. Визначення витрати повітря. 7.10. Порядок проведення роботи. 7.11. Обробка експериментальних даних. 7.12. Розрахунок параметрів ізобарного процесу. 7.13. Звужуючий пристрій та проточний калориметр.
Л І Т Е Р А Т У Р А 8.1. Кириллин В.А., Сычев В.В., Шейндлин А.Е. Техническая термодинамика. - М.: Наука, 1979. - 512 с. 8.2. Нащекин В.В. Техническая термодинамика и теплопередача. - М.: Высшая школа, 1960. - 469 с. 8.3. Кириллин В.А., Шейндлин А.Е. Основы экспериментальной термодинамики. - М.: Наука, 1967. 8.4. Преображенский В.П. Теплотехнические измерения и приборы. - М.: Энергия, 1976. - 704 с. 8.5. Андрианова Т.Н., Дзампов Б.В., Зубарев В.Н., Ремизов С.А. Сборник задач по технической термодинамике. - М.: Энергоиздат, 1981. - 240 с. 8.6. Рабинович О.М. Сборник задач по технической термодинамике. - М.: Машиностроение, 1973. - 344 с. Лабораторна робота № 2 ПОБУДОВА ПРОЦЕСІВ ВОДЯНОЇ ПАРИ В І-S ДІАГРАМІ
МЕТА І ЗАДАЧА РОБОТИ Мета роботи – отримання практичних навичок роботи з і-s діаграмою. Задача роботи – побудова і розрахунок термодинамічних процесів водяної пари в і-s діаграмі.
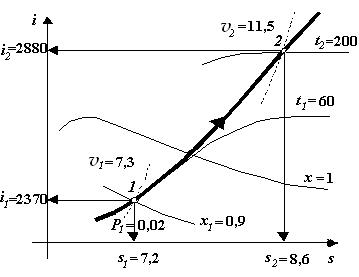
Ізобарний процес В ізобарному процесі тиск не змінюється: Р = const. Розглянемо побудову процесів на прикладах. Нехай початковий стан водяної пари задається ізобарою Р 1=0,02 МПа і х = 0,9. Пара ізобарно підігрівається до температури t 2 = 200 оС. Для побудови процесу знаходимо в діаграмі точку перетину ізобари Р 1 і лінії ступеню сухості х 1, рис. 2.2, що дає початкову точку процесу 1. Опустимось з цієї точки на координату s і визначимо раніше невідому нам ентропію s 1 = 7,2 кДж/(кг×К); опустившись на координату і, визначимо ентальпію і 1 = 2370 кДж/кг. Піднявшись по ізобарі до лінії х = 1 визначимо t 1 = 60 оС. Через точку 1 проходить ізохора v 1 = 7,3 м3/кг. Точка 1 знаходиться між ізохорами 5 м3/кг та 10 м3/кг. Величина v 1 визначається по правилу пропорції. З точки 1 рухаємось по лінії ізобари Р 1 = 0,02 МПа до точки перетину з ізотермою t 2 = 200 оС і отримуємо кінцеву точку процесу 2. У цій точці раніше невідомі параметри s 2 = 8,59 кДж/(кг×К), і 2 = 2880 кДж/кг, v 2 = 11,5 м3/кг, задані параметри Р 2 = 0,02 МПа, t 2 = 200 оС. Лінію ізобарного процесу 1-2 наводимо більш товстою лінією. Процес побудований.
Кількість теплоти, підведеної до 1 кг пари в ізобарному процесі, кДж/кг q p = i 2 – i 1 Робота ізобарного процесу, кДж/кг l p = P 1(v 2 - v 1). Якщо у процесі пара нагрівається, то по лінії Р = const рухаються уверх, якщо охолоджується, то вниз. У точці 1 пара волога насичена, а у точці 2 – перегріта.
Рис. 2.2. Ізобарний процес
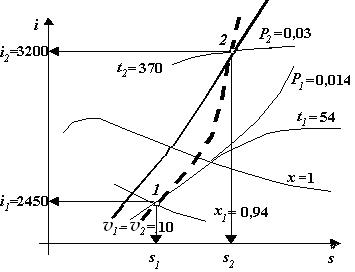
Ізохорний процес В ізохорному процесі питомий об’єм пари не змінюється: v = const = v 1 = v 2. Нехай початковий стан пари задається ізобарою Р 1 = 0,014 МПа та ізохорою v 1 = 10 м3/кг. До пари в ізохорному процесі підводиться теплота, пара нагрівається і в кінці нагрівання тиск стає Р 2 = 0,03 МПа. Початкову точку процесу знаходимо в місці перетину ізобари Р 1 і ізохори v 1, рис. 2.3. У цій точці задані параметри Р 1 і v 1, визначаємо раніше невідомі параметри. Через точку 1 проходить лінія ступеню сухості х 1 = 0,94. Опустившись на осі координат, визначаємо ентальпію і 1 = 2450 кДж/кг, ентропію s 1 = 7,6 кДж/(кг×К). Піднявшись по ізобарі до лінії х = 1 визначаємо t 1 = 54 оС. Із точки 1 рухаємось по ізохорі v 1 = 10 м3/кг уверх до точки перетину з ізобарою Р 2 = 0,03 МПа і отримуємо кінцеву точку процесу 2. Визначаємо невідомі параметри цієї точки, це будуть лінії, які проходять через точку 2: і 2 =3200 кДж/кг, s 2 =9,04 кДж/(кг×К), t 2 = 370оС. Лінію ізохорного процесу 1-2 наводимо більш товстою лінією. Процес побудований.
Рис. 2.3. Ізохорний процес
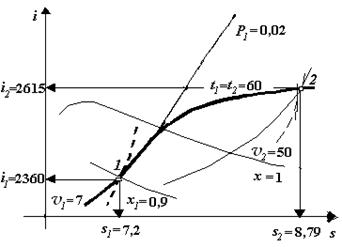
Кількість теплоти, підведеної в ізохорному процесі q J = D U = i 2 – i 1 - v (P 2 – P 1), де D U – зміна внутрішньої енергії. Робота ізохорного процесу lv = 0. Якщо теплота до пари підводиться, то по ізохорі рухаються уверх, якщо відводиться – униз. У точці 1 пара волога насичена, а у точці 2 – перегріта. Ізотермічний процес В ізотермічному процесі температура не змінюється t 1= t 2 = const. Нехай початковий стан пари задається тиском Р 1 = 0,02 МПа і ступіню сухості пари х 1 = 0,9. Пара ізотермічно розширяється так, що в кінці процесу її тиск стає Р 2 = 0,003 МПа, рис. 2.4. В місці перетину ізобари Р 1 = 0,02 МПа і лінії ступеню сухості х 1 = 0,9 знаходимо початкову точку процесу. З точки 1 опустившись на осі і, s, визначаємо і 1= 2615 кДж/кг, s 1=7,2 кДж/(кг×К). Через точку 1 проходить ізохора v 1 = 7 м3/кг. В області вологої насиченої пари, де лежить точка 1, ізобари співпадають з ізотермами, тому з початкової точки 1 спочатку рухаємось по ізобарі уверх до точки перетину з лінією ступеню сухості х = 1 і визначаємо ізотерму, яка приходить у цю точку, це t 1= 60 оС. Далі рухаємось по цій ізотермі до точки перетину з ізобарою Р 2= 0,003 МПа і визначаємо кінцеву точку процесу – точку 2. Опустившись на осі визначаємо і 2 = 2615 кДж/кг, s 2 = 8,79 кДж/(кг×К). Через цю точку проходить ізохора v 2 = 50 м3/кг, температура у цій точці t 2 = t 1 = 60 оС. Лінію ізотермічного процесу 1-2 наводимо більшою по товщині. Процес побудований. Точка 1 знаходиться в області вологої насиченої пари, тому пара там волога насичена, точка 2 знаходиться в області перегрітої пари, тому пара там перегріта.
Рис. 2.4. Ізотермічний процес
Кількість теплоти в ізотермічному процесі, кДж/кг q т = T (s 2 – s 1), Адіабатний процес В адіабатному процесі постійною величиною є ентропія s 1 = s 2 = const, тому процес іде по лінії s = сonst. Нехай початковий стан пари задається тиском Р 1 = 0,2 МПа і температурою t 1 = 460 оС. Пара адіабатно розширюється до тиску Р 2 = 0,002 МПа. В місці перетину ізобари Р 1 і ізотерми t 1 знаходимо початкову точку процесу 1. Опустившись на осі, визначаємо невідомі раніше параметри пари у точці 1: і 1=3400кДж/кг, s 1= s 2=8,4 кДж/(кг×К). Через точку 1 проходить ізохора v 1 = 1,7 м3/кг. Із точки 1 рухаємось по ізоентропі s = const до точки перетину з ізобарою Р 2 = 0,002 МПа і отримуємо кінцеву точку процесу 2. У цій точці параметри пари: і 2 = 2435 кДж/кг, s 2 = 8,4 кДж/кг, t 2 = 18 оС. Для визначення температури піднімаємось по ізобарі Р 2 = 0,002 МПа до лінії х = 1 і визначаємо, яка ізотерма приходить у цю точку, t 2 = 18 оС. Через точку 2 проходить лінія ступеню сухості х 2 =0,96. Лінія 1-2 визначає теоретичний адіабатний процес розширення водяної пари, який проходить без тертя. Для адіабатного теоретичного процесу теплота q s = 0. Робота процесу l s = q - D U = (і 1 – Р 1 v 1) – (і 2 – Р 2 v 2) Процеси розширення ідуть зверху вниз, від точки 1 до точки 2, а стискування знизу уверх. У точці 1 пара перегріта, а у точці 2 – волога насичена.
Рис. 2.5. Адіабатний процес Реальні процеси розширення пари такі, наприклад, як витікання через сопла, або розширення на робочих лопатках парової турбіни, через наявність сил тертя між струминами газу та газом і стінкою каналу відхиляються від вертикальної лінії: s = const. Виділена теплота тертя приводить до збільшення ентропії і вихідної ентальпії. Дійсний процес розширення відповідає політропному процесу лінії 1-2 д. Якщо відома величина зменшення ентальпії D і = і 2д – і 2, то точку 2 д знаходять у місці перетину ізоентальпії і 2д = і 2 + D і, і ізобари Р 2. Нехай для нашого прикладу D і = 80 кДж/кг, тоді і 2д = 2435 + 80 = 2515 кДж/кг. Точку 2 д знаходимо у точці перетину ізоентальпи і 2д = 2515 кДж/кг і ізобари Р 2 = 0,002 МПа. Ентропія в точці 2 д s 2д = 8,67 кДж/(кг×К). Точка 2 д лежить в області вологої насиченої пари. Теоретичній та дійсний процеси наводимо товстими лініями. Незворотність процесу характеризується внутрішнім відносним к.к.д.
Процес дроселювання Явище пониження тиску при проходженні парою місцевого опору без виконання роботи називається дроселюванням. Процес дроселювання ідеального газу характеризується величиною і = const. Дійсний процес дроселювання – процес незворотній, він умовно зображається пунктирною лінією і = const.
Рис. 2.6. Дроселювання пари
Нехай початковий стан пари задається тиском Р 1 = 0,22МПа і ступеню сухості пари х 1 = 0,95 (рис.2.6.) Пара дроселюється до тиску Р 2 = 0,003 МПа. Початкову точку процесу знаходимо у місці перетину ізобари Р 1 і лінії ступеню сухості х 1=0,95. Опустившись на осі визначаємо і 1 = 2600 кДж/кг, s 1 = 6,82 кДж/(кг×К). Через точку 1 проходить ізохора v 1 = 0,75 м3/кг. Піднявшись по ізобарі Р 1 до лінії х = 1 визначаємо ізотерму, яка приходить у цю точку, це t 1 = 125оС. Із точки 1 по лінії і 1 = і 2 = const рухаємось вправо до перетину з ізобарою Р 2 = 0,003 МПа і визначаємо кінцеву точку процесу 2. У цій точці і 2 = і 1= 2600 кДж/кг, Р 2= 0,003 МПа, s 2= 8,76 кДж/кг, t 2=54 оС, v 2 = 50 м3/кг. У точці 1 пара знаходилась у стані вологої насиченої, а у точці 2 перегрітої. В процесі дроселювання лінія і = const перетинає лінію ступеню сухості пари х = 1, точка А. У цієї точці пара суха насичена і їй відповідає тиск Р А. Таким чином, при дроселюванні можна отримати суху, вологу і перегріту пари, якщо пара дроселюється з області вологої насиченої. Якщо процес дроселювання буде починатися в області перегрітої пари, то, частіше всього, в кінці дроселювання отримують перегріту пару, особливо тоді, коли точка лежить дещо вище лінії х =1. ПОРЯДОК ВИКОНАННЯ РОБОТИ 3.1. Користуючись методичними вказівками та і-s діаграмою студенти вивчають та засвоюють лінії діаграми та принцип побудування процесів. 3.2. Для оволодіння методикою користування діаграмою вирішуються задачі на побудування термодинамічних процесів водяної пари в діаграмі. 3.3. Розбирається умова задачі і визначається вид процесу, а також якими параметрами задається початкова та кінцева точки. 3.4. Коротко умова задачі записується у звіт з лівого боку листа. Вихідні дані беруться з таблиці після умови задачі. 3.5. Будується процес в діаграмі. 3.6. З діаграми схематично переноситься побудований процес у звіт і замальовується з правого боку листа навпроти умови задачі. 3.7. Проводяться необхідні розрахунки. 3.8. Вирішується чотири задачі згідно із своїм варіантом і для них проводяться необхідні розрахунки.
ФОРМА ЗВІТУ ПО РОБОТІ Звіт по роботі включає: 6.1. Мету і задачу роботи. 6.2. Короткий запис умови задачі і схематичний рисунок, що відповідає рішенню задачі. 6.3. Параметри пари у початковій та кінцевій точці. 6.4. Розрахунки теплоти і роботи процесу.
КОНТРОЛЬНІ ПИТАННЯ ДЛЯ САМОПЕРЕВІРКИ 7.1. Опишіть і-s діаграму водяної пари. 7.2. Назвіть принцип побудови процесу в діаграмі. 7.3. Дайте визначення видам та ступеню сухості пари. 7.4. Побудова процесів: ізобарного, ізохорного, ізотермічного, адіабатного, дроселювання. 7.5. Запишіть формули для кожного процесу. Л І Т Е Р А Т У Р А 8.1. Кириллин В.А., Сычев В.В., Шейндлин А.Е. Техническая термодинамика. - М.: Наука, 1979. - 512 с. 8.2. Нащекин В.В. Техническая термодинамика и теплопередача. - М.: Высшая школа, 1960. - 469 с. 8.3. Швец И.Т. Толубинский В.Я. и др. Теплотехника. - К.: Вища школа, 1976. – 517 с.
Лабораторна робота № 3 МЕТА І ЗАДАЧІ РОБОТИ Мета роботи – отримання практичних навичок роботи з І-d діаграмою. Задача роботи – побудова і розрахунок термодинамічних процесів вологого повітря в І-d діаграмі.
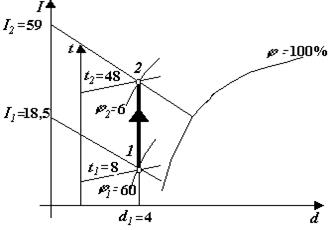
Характерні лінії процесів Нагрівання і охолодження повітря – проходить по лінії d = const, нагрівання – уверх, охолодження – вниз. Адіабатне зволоження (осушення) – проходить по лінії І = const, зволоження – вправо і вниз, осушення – вліво і уверх. Ізотермічне зволоження (осушення) – проходить по лінії t = const, зволоження – вправо, осушення – вліво. Змішування повітря – зображається прямою лінією, яка з’єднує точки змішування потоків повітря. Точка, яка характеризує параметри суміші, лежить на цій лінії і визначається по правилу важеля. Початкова точка процесу 1 знаходиться в місці перетину ліній двох початкових параметрів. Із цієї точки рухаються по характерній лінії процесу до перетину з лінією кінцевого параметру і отримують кінцеву точку процесу 2. Всі інші лінії, які проходить через точку 1 або 2 визначають невідомі нам раніше параметри стану в початковій і кінцевій точках процесу. Початкова точка процесу може бути задана комбінацією любих двох параметрів із чотирьох. 2.3. Процеси вологого повітря в І-d діаграмі Нагрівання повітря При нагріванні повітря в поверхневих теплообмінниках (калориферах) незмінним параметром є вологовміст, лінія d = const. Розглянемо побудову процесу на прикладі. Нехай перед входом у підігрівач повітря має параметри t 1 = 8оС, d 1 = 4 г вол/(кг сух.пов). Повітря нагрівається у підігрівачі і виходить з нього, маючи температуру t 2 = 48оС. Для побудови процесу знаходимо у діаграмі точку перетину ліній: ізотерми t 1= 8оС і вологовмісту d 1= 4 г вол/(кг сух.пов). Ця точка перетину характеризує початкову точку процесу 1. Піднявшись по лінії І = const, яка проходить через точку 1, до координати І, визначимо ентальпію у точці 1, І = 18,5 кДж/(кг сух.пов.), через точку 1 проходить лінія відносної вологості j 1 = 60%. З точки 1 піднімаємось по лінії d = 4 г.вол/(кг сух.пов.) до перетину з ізотермою t 2 = 48 оС, точка перетину характеризує кінцеву точку процесу 2. Через точку 2 проходять лінії, які визначають раніше невідомі нам параметри повітря: І 2 = 59 кДж/(кг.сух.пов.), j2 = 6%, d 2 = d 1= 4 г вол/(кг сух.пов.). Лінію процесу нагрівання 1-2 наводимо більш товстою лінією.
Рис. 3.2. Нагрівання повітря
Кількість теплоти, яка витрачається на нагрівання повітря, визначається за формулою Q = I 2 – I 1, кДж/(кг сух.пов) (3.5) де І 2 – ентальпія у кінці процесу нагрівання; І 1 – ентальпія на початку процесу нагрівання. Охолодження повітря Охолодження повітря в поверхневих теплообмінниках також характеризується лінією d = const. Нехай повітря перед входом у теплообмінник має температуру t 1 =50 oC i j 1= 20%. Повітря охолоджується так, що його температура знижується до t 2 = 15oC. Знаходимо в І-d діаграмі точку перетину ліній: ізотерми t 1 = 50oC i лінії j 1 = 20%, це початкова точка процесу 1. Піднявшись по лінії І = const, визначаємо ентальпію в початковій точці І 1=90кДж/(кг.сух.пов.), опустившись на координату d, визначаємо вологовміст d 1= 15,4 г.вол./(кг.сух.пов). Із точки 1 опускаємось по лінії d = 15,4 г.вол./(кг.сух.пов.) до перетину з лінією кінцевого параметру, в даному випадку це ізотерма t 2 = 15oC. При цьому можливі два варіанти. Перший – точка перетину з лінією кінцевого параметру лежить над лінією j = 100%. Другий – опускаючись по лінії d = const, перетинаємо лінію j = 100%, а лінії кінцевого параметру ще не досягли, точка 2 на рис. 2.3. У цій точці t 2 = 22оС, І 1 = 60 кДж/(кг сух.пов.). В такому випадку далі процес буде йти по лінії j = 100% до точки перетину з ізотермою t = 15оС (лінія 2-3). Загальний процес охолодження – це лінія 1-2-3, яку і наводимо більш товстою лінією. У процесі 1-2 повітря тільки охолоджується, а у процесі 2-3 воно охолоджується та ще й висушується. При цьому з повітря випадає вологи D d = d 3 – d 2. (3.6) Кількість теплоти, відведеної від повітря у процесі охолодження,кДж/кг сух.пов. Q = I 3 – I 1, (3.7) де І 3 – ентальпія у кінці процесу охолодження; І 1 – ентальпія на початку процесу охолодження. Параметри повітря у точці 2: t 2 = 22оС: j 2 = 100%; І 2 = 60кДж/кг.сух.пов.; d 2 = 15,4г.вол./кг.сух.пов.; у точці 3 – t 3 = 15оС; j 3 = 100%; І 3 = 42кДж/кг.сух.пов.; d 3 = 10,6г.вол./кг.сух.пов.
Рис. 3.3. Охолодження повітря
Змішування потоків повітря Змішується два потоки повітря – один з параметрами t 1= 20оС, j 1= 10%, другий з параметрами t 2= 40оС, j 2 = 55%. Маси потоків m 1= 100 кг/с, m 2= 200 кг/с. Потрібно визначити параметри суміші. Для цього на діаграмі знаходимо точку 1, яка відповідає стану першого потоку і точку 2, яка відповідає стану другого потоку. Точка 1 знаходиться в місці перетину ізотерми t 1= 20 оС і лінії j 1= 10%. Рухаючись по лінії І = const до осі І визначаємо І 1 = 24 кДж/кг.сух.пов. і по лінії d = const до осі d визначаємо d 1 = 1,3 г.вол./кг.сух.пов. В місці перетину ізотерми t = 40оС і лінії j 2 = 55% знаходимо точку 2, через неї проходять лінії: І 2 = 106,5 кДж/кг.сух.пов. і d 2 = 25,8 г.вол./кг.сух.пов. Лінійкою на діаграмі визначаємо довжину відрізку l 1-2 = 203 мм. Точка К, що характеризує параметри утвореної суміші, лежить на відрізку l 1-2 і розділяє його на частини, відношення яких дорівнює відношенню мас потоків, що змішуються: m 1/ m 2 = n. Для визначення на лінії 1-2 положення точки К складаємо пропорцію: відношення маси суміші m сум = m 1 + m 2 до відомої довжини відрізка l 1-2 дорівнює відношенню маси другого потоку m 2 до невідомої довжини відрізку l 1-K
З цієї пропорції визначається довжина l 1-k
Відкладаємо на діаграмі від точки 1 по лінії 1-2 довжину відрізка l 1-k і отримуємо точку К, яка характеризує утворену суміш. Через точку К проходять лінії, які визначають раніше невідомі параметри суміші: t 2 = 33,5oC, j 2 = 54%, I 2 = 78,5 кДж/кг.сух.пов., d k = 17,8 г.вол./кг.сух.пов. Якщо точка К буде знаходитись нижче лінії j = 100%, то параметри суміші визначаються у точці, яку отримують шляхом пересування точки К по лінії І = const на лінію j = 100%.
Рис. 3.6. Змішування потоків повітря
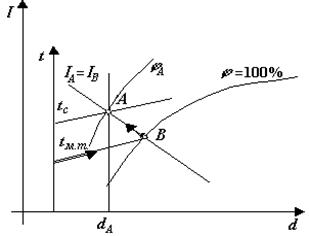
Рис. 3.7. Визначення температури мокрого термометру і точки роси
Для визначення точки в діаграмі необхідно на осі t знайти ізотерму t м.т. і рухатись по ній до точки перетину з лінією j =100%, точка В, а з точки В рухатись по лінії I =const до точки перетину з ізотермою t с (точка А). Наприклад, відомі значення t м.т.=19оС, t с=25оС. Виконуємо побудову і знаходимо точку А на діаграмі, для неї j А = 56%, d А = 11,1 г.вол./кг.сух..пов., t А = 25оС, І А = 48 кДж/кг.сух.пов.
Рис. 3.8. Визначення точки в діаграмі по відомим tс і tм.т. ПОРЯДОК ВИКОНАННЯ РОБОТИ 3.1. Керуючись методичними вказівками та І-d діаграмою, студенти вивчають і засвоюють лінії діаграми та принцип побудування процесів. 3.1. Для оволодіння методикою користування діаграмою вирішуються задачі на побудування термодинамічних процесів вологого повітря в діаграмі. 3.2. Розбирається умова задачі, визначається вид процесу і його характерна лінія, а також параметри, які задають початкову і кінцеву точку процесу. 3.3. Коротко умова задачі записується у звіт з лівого боку аркушу. Вихідні дані беруться із таблиці після умови задачі. 3.4. Будується процес в діаграмі. 3.5. З діаграми схематично переноситься побудований процес у звіт і замальовується з правого боку аркушу, напроти умови задачі. 3.6. Вирішується чотири задачі згідно зі своїм варіантом і проводяться необхідні розрахунки. ФОРМА ЗВІТУ ПО РОБОТІ Звіт по роботі включає: 6.1. Мету і задачу роботи. 6.2. Короткий запис умови задачі і схематичний рисунок, який відповідає рішенню задачі. 6.3. Параметри повітря у початковій і кінцевій точках. 6.4. Розрахунки згідно з умовою задачі.
КОНТРОЛЬНІ ПИТАННЯ ДЛЯ САМОПЕРЕВІРКИ 7.1. Опишіть діаграму І-d вологого повітря. 7.2. Назвіть принцип побудови процесу в діаграмі. 7.3. Дайте визначення видам вологого повітря. 7.4. Дайте визначення та запишіть формули по параметрам стану вологого повітря. 7.5. Побудова процесів: нагрівання, охолодження, ізотермічного та адіабатного насичення, змішування. 7.6. Запишіть формули для визначення теплоти і кількості вологи на теплові та зволожуючі процеси.
Л І Т Е Р А Т У Р А 8.1 Кириллин В.А., Сычев В.В., Шейндлин А.Е. Техническая термодинамика. - М.: Наука, 1979. - 512 с. 8.2. Нащекин В.В. Техническая термодинамика и теплопередача. - М.: Высшая школа, 1960. - 469 с. 8.3. Швец И.Т. Толубинский В.Я. и др. Теплотехника. - К.: Вища школа, 1976. – 517 с.
Лабораторна робота № 4 ДОСЛІДЖЕННЯ ТЕРМОДИНАМІЧНИХ ПРОЦЕСІВ ВОЛОГОГО ПОВІТРЯ
МЕТА І ЗАДАЧІ РОБОТИ Мета роботи – засвоєння теоретичних знань по розділу термодинаміки “Вологе повітря”. Задача роботи – експериментальне дослідження процесів нагрівання і зволоження повітря, розрахунок процесів і їх побудова в I-d діаграмі.
Параметри вологого повітря Вологе повітря, як робоче тіло, застосовується в багатьох технологічних процесах: сушіння, зволоження матеріалів, пневмотранспорт, кондиціювання та ін. Для розрахунку процесів вологого повітря необхідно знати його параметри. Вологе повітря - це суміш сухого повітря з водяною парою, яка найчастіше перебуває у повітрі в перегрітому стані, тому вологе повітря являє собою суміш ідеальних газів. Згідно з законом Дальтона тиск суміші газів дорівнює сумі парціальних тисків його компонентів. Для вологого повітря закон Дальтона записується:
Р б = Р n + Р с.n., (4.1)
де Р б - барометричний тиск, Па; Р n - парціальний тиск водяної пари, Па; Р с.п - парціальний тиск сухого повітря, Па. Кількість водяної пари, яка знаходиться в 1 м3 вологого повітря називається абсолютною вологістю
Абсолютна вологість чисельно дорівнює густині водяної пари. Максимальна абсолютна вологість відповідає стану повітря, при якому незначна добавка водяної пари в нього приводить до утворення крапель рідини і їхньому випаданню з повітря. Такий стан називають ще станом насичення. Відношення абсолютної вологості до максимальної абсолютної вологості називають відносною вологістю.
де r n - абсолютна вологість пари, кг/м3; r н - максимальна абсолютна вологість, кг/м3; Р н - тиск насичення водяної пари, Па. Відносна вологість змінюється від 0 до 100%. Відношення маси водяної пари до маси абсолютно сухого повітря називається вологовмістом.
де m n - маса водяної пари, кг; m с.n. - маса сухого повітря, кг. Сумісне рішення рівнянь (4.3) і (4.4) дає рівняння, яке зв¢язує вологовміст і відносну вологість.
При визначенні максимального тиску Р mах можливі два випадки: 1. Якщо температура вологого повітря нижча або дорівнює температурі насичення водяної пари при даному тиску, то Р mах= Р н. 2. Якщо температура вологого повітря вища за температуру насичення, що відповідає тиску вологого повітря, то Р mах= Р сум. З рівняння (3.5) випливає, що в області, де температура вологого повітря вища за температуру насичення водяної пари при Р сум.= Р mах, відносна вологість залежить тільки від вологовмісту і при d =соnst являє собою вертикальну пряму в I-d діаграмі, а в області, де температура нижча за температуру насичення, це криві лінії. Густина вологого повітря може бути визначена за двома рівняннями: r в.п. = r п + r с.п. (4.6)
де r в.п - густина вологого повітря, кг/м3; r п - густина водяної пари, кг/м3; Т в.п. - температура вологого повітря, K.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 130; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.166.98 (0.183 с.) |




 . (3.9)
. (3.9)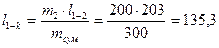 мм.
мм.

 (4.2)
(4.2) (4.3)
(4.3)
 (4.4)
(4.4) (4.5)
(4.5) (4.7)
(4.7)


