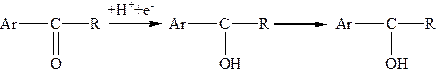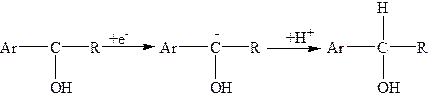Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кількісний полярографічний аналіз
Кількісний полярографічний аналіз ґрунтується на залежності граничного дифузійного струму від концентрації деполяризатора, що виражається рівнянням Ільковича: Ід = 605×n×C×D1/2×m2/3×τ1/6 (6) де Ід — сила граничного дифузійного струму, мкА; n — число електронів, що беруть участь в електродній реакції; D — коефіцієнт дифузії, см2/с; m — швидкість витікання ртуті, мг/с; τ — період крапання, с; С — концентрація деполяризатора, ммоль/л. Добуток m2/3×τ1/6 називають характеристикою капіляра, оскільки його величина залишається постійною для одного і того ж капіляра при незмінній величині напору ртутного стовпа (висоті підняття напірної посудини із ртуттю). Коефіцієнт дифузії D залишається незмінним при постійному складі розчину. Таким чином, в одному і тому ж фоновому розчині при постійному напорі ртуті добуток 605×n×D1/2×m2/3×τ1/6 = const (7) залишається постійним, а залежність висоти полярографічної хвилі від концентрації деполяризатора С виражається рівнянням прямої лінії: h = K×C (8), де К — коефіцієнт пропорційності, який враховує постійну величину (7) та перехід від мкА до мм на графіку. Кількісне визначення речовини можна здійснювати різними способами, маючи на увазі, що величина граничного дифузійного струму Ід або висота полярографічної хвилі h є лінійною функцією концентрації. У всіх випадках використовують стандартні розчини, склад яких повинен бути максимально близьким до складу досліджуваного розчину. Умови полярографування досліджуваних і стандартних розчинів повинні бути ідентичними. Розрахунковий метод. Знімають полярограму досліджуваного розчину і визначають величину граничного дифузійного струму Ід. Експериментально визначають швидкість витікання ртуті m (мг/с) і період крапання τ (с). Невідому концентрацію Сх обчислюють за рівнянням Ільковича (6). Необхідною умовою для використання цього методу є знання точного значення коефіцієнта дифузії Д. Коефіцієнт дифузії можна визначити, полярографуючи розчин відомої концентрації. Метод калібрувального графіка. Одержують полярограми досліджуваного і серії стандартних розчинів, будують калібрувальний графік у координатах h – С, за допомогою якого для знайденого значення hх визначають Сх.
Метод стандартів. Полярографують розчини невідомої концентрації і стандартний розчин (один або два), концентрація якого близька до концентрації досліджуваного. Для одних і тих же умов існує рівність:
де Сх і Сст — концентрації досліджуваного і стандартного розчинів; hх і hст — висоти хвиль на полярограмах цих розчинів. Метод добавок. Цим методом користуються в тому випадку, коли зовсім невідомий склад досліджуваного розчину. Спочатку полярографують певний об’єм Vх досліджуваного розчину, концентрація якого Сх (не відома) і вимірюють висоту хвилі hх. Після цього в електролізер добавляють певний і невеликий об’єм стандартного розчину Vст, концен-трація якого Сст. Необхідно, щоб Сст > Cx, Vст << Vх і висота хвилі зросла приблизно вдвічі. Вимірюють на полярограмі висоту хвилі hх+ст для розчину, одержаного змішуванням досліджуваного і стандартного розчинів. Концентрацію Cx обчислюють за формулою, яка виводиться з рівняння Ільковича з врахуванням розбавлення обидвох розчинів внаслідок їх зливання: Cx = Сст
ЛАБОРАТОРНА РОБОТА № 2 5.1. Визначення йонів плюмбуму або кадмію методом постійно-струмової полярографії
Метою роботи є кількісне визначення плюмбуму або кадмію в розчині. Для визначення невідомої концентрації деполяризатора в розчині можна скористатися одним з методів, заснованих на рівнянні (8), наприклад, методом калібрувального графіка. Для побудови калібрувального графіка необхідно записати полярограми декількох стандартних розчинів визначуваної речовини (йона). Стандартні розчини можна готувати безпосередньо в електролізері шляхом розведення вихідного стандартного розчину з відомою концентрацією Со. Наступні стандартні розчини (С1, С2,... СN) готують додаванням в електролізер фонового електроліту. Очевидно, при цьому: СN = СоVo/VN (11), де N = 1, 2, 3... — номер розчину; Со — концентрація вихідного стандартного розчину, моль/л; Vo — об’єм вихідного стандартного розчину, мл; СN — концентрації приготовлених стандартних розчинів, моль/л; VN — об’єми приготовлених стандартних розчинів, мл. Об’єми стандартного та фонового розчинів повинні бути точно відміряні піпеткою або з бюретки.
Реактиви, посуд та прилади 1. Вихідний стандартний 4∙10–3 М розчин CdSO4 на фоні 1 М KCl. 2. Вихідний стандартний 2∙10–3 М розчин PbCl2 на фоні 0.1 М НCl. 3. Фонові електроліти: 1 М розчин KCl або 0.1 М НCl. 4. 0.1 %-й розчин желатину. 5. Піпетки на 10 і 5 мл. 6. Електролізер — стаканчик на 40–50 мл. 7. Електроди НКЕ та РКЕ на штативі. 8. Електролітичний місток, заповнений насиченим розчином KCl. 9. Полярограф. Методика виконання роботи Роботу можна виконувати на приладах з візуальним або автоматичним способом запису полярограм у наступній послідовності: 1. Ввімкнути та підготувати прилад до вимірювання за методикою, описаною в інструкції для приладу. 2. Одержати у викладача завдання на визначення невідомої концентрації розчину (CdSO4 або PbCl2). 3. Внести в електролізер піпеткою 10 мл вихідного стандартного розчину солі кадмію або плюмбуму. У випадку визначення плюмбуму в електролізер додають 5–6 крапель розчину желатину. Опустити в розчин електроди та сольовий місток, відреґулювати період крапання ртуті. 4. Зняти полярограму вихідного стандартного розчину з Со при чутливості ґальванометра, що забезпечує максимально можливу висоту полярографічної хвилі. 5. Розвести вихідний стандартний розчин відміряним піпеткою на 5 мл фоновим електролітом, добре перемішати розчин і зняти полярограму наступного стандартного розчину (С1) при тих же значеннях потенціалів на РКЕ. 6. Послідовно розбавляючи розчин в електролізері наступними порціями фонового електроліту (напр., 10; 15 мл), аналогічним чином зняти полярограми для С2, С3... СN. 7. Одержати у викладача розчин з невідомою концентрацією, точно відміряти 2...5 мл і внести його в електролізер. Зняти останню полярограму цієї суміші розчинів. Результати розбавлення та значення потенціалів і виміряної сили струму записати в табл. 3. Таблиця 3
8. Про закінчення вимірювань повідомити викладача, опустити резервуар з ртуттю вниз до опору. Розчин з відпрацьованою ртуттю із стаканчика-електролізера вилити в стакан (банку) для зливу ртуті, закривши її годинниковим склом чи кришкою. РКЕ, сольовий місток і стаканчик-електролізер промити дистильованою водою, яку вилити в посудину з відпрацьованою ртуттю. Сольовий місток помістити в стакан з розчином KCl. РКЕ залишити в стаканчику-електролізері, наливши в нього дистильованої води, або закріпити електрод на штативі нижнім кінцем вгору, якщо це передбачено конструкцією установки. Обробка одержаних даних та складання звіту За даними табл. 3 на міліметровому папері побудувати графіки полярограм для всіх концентрацій розчинів на одному рисунку. На полярограмах виміряти і записати величину висот полярографічних хвиль hо, h1, h2, h3, hзаг (способом, показаним на рис. 1) і побудувати калібрувальний графік залежності висоти хвилі hі від Сі, де і = 0, 1, 2, 3 — номер по порядку стандартних розчинів і відповідних їм висот хвиль. За цим графіком визначити загальну концентрацію Сзаг розчину, одержаного внаслідок домішування досліджуваного розчину. Концентрацію досліджуваного розчину Сх розрахувати з рівняння:
Сзаг∙Vзаг = СN∙VN + Cx∙Vx (12) Звіт повинен містити назву роботи, короткий опис способу досягнення поставленої мети, методику безпосереднього виконання роботи, результати спостережень (табл. 3) та обробки експериментальних даних (графіки полярограм, калібрувальний графік). Точки на графіках повинні бути чітко позначені. У висновках звіту повинен бути вказаний кінцевий результат дослідження (Сх). ЛАБОРАТОРНА РОБОТА № 3 5.2. Визначення ацетофенону або бензофенону методом постійно-струмової полярографії
Об’єктами полярографічного аналізу можуть бути не лише неорганічні речовини, але й багато з органічних речовин, які здатні до електрохімічних перетворень. В електродній реакції відновлення органічної речовини переважно беруть участь йони водню. R + nH+ + ne– ® RHn (13) Саме тому аналіз проводять в буферних розчинах з достатньо великою буферною ємкістю. До полярографічно активних фраґментів органічних речовин належать, наприклад, альдегідна, кетонна, азо-, нітро-, пероксигрупи та багато інших, які в умовах полярографічного аналізу легко відновлюються в межах зміни потенціалу РКЕ від 0 до –2,7 В і можуть бути визначені. Органічні речовини, які електрохімічно окиснюються важче від ртуті, тобто при потенціалах, більших +0,4 В, можуть бути визначені з застосуванням платинового електрода. Так аналізують органічні кислоти (малеїнову, фумарову) та деякі ефіри. Оскільки багато з органічних речовин нерозчинні або погано розчинні у воді, то для підвищення їх розчинності до води додають органічні розчинники, наприклад, метанол, етанол, діоксан, оцтову кислоту, диметилформамід, гліколь, моногліколеві ефіри і т.п. Механізм відновлення кетонів, у тому числі ацетофенону та бензофенону, значною мірою залежить від рН середовища. При рН = 5 відновлення проходить в дві стадії. 1-ша стадія відповідає відновленню протоґенованої карбонільної групи
2-га стадія — відновленню кетильного радикала до карбінолу
Обом стадіям на вольтамперній кривій відповідають хвилі при різних значеннях потенціалу. При рН > 5 відновлення йде також через дві стадії, одначе процеси протікають значно швидше, і на полярограмах фіксується одно-, двоелектронна хвиля відновлення кетону до карбінолу. Метою роботи є кількісне визначення ацетофенону або бензофенону в розчині методом калібрувального графіка.
Реактиви, посуд та прилади 1. Вихідний стандартний 4∙10–3 М розчин ацетофенону (або бензофенону). 2. Фоновий електроліт — розчин, що містить 1 М NH4OH i 1 M NH4Cl в 50%-му етанолі. 3. Сульфіт натрію кристалічний (для зв’язування розчиненого кисню). 4. Бюретки на 25 мл — 2 шт. 5. Стаканчик місткістю 50–70 мл, що служить електролізером. 6. Електроди НКЕ та РКЕ. 7. Електролітичний місток, заповнений насиченим розчином KCl і загущений аґар-аґаром. 8. Полярограф. Методика виконання роботи Роботу можна виконувати на приладах з візуальним або автоматичним способом запису полярограм у наступній послідовності: 1. Ввімкнути та підготувати прилад до вимірювання за методикою, описаною в інструкції для приладу. 2. Одержати у викладача завдання на визначення невідомої концентрації розчину ацетофенону (або бензофенону). 3. В сухий стаканчик з бюретки налити Vо = 15 мл вихідного стандартного розчину ацетофенону (або бензофенону) і додати туди ~ 1 г сульфіту натрію. Стаканчик встановити на штатив з електродами, занурити РКЕ в розчин і замкнути коло між досліджуваним розчином в стаканчику та НКЕ сольовим містком з насиченим розчином KCl. Підняти напірну посудину з ртуттю та відреґулювати період крапання. 4. Зняти полярограму вихідного стандартного розчину з Со при чутливості ґальванометра, що забезпечує максимально можливу висоту полярографічної хвилі. 5. Добавити у вихідний стандартний розчин порцію фонового електроліту V = 5 мл, яку додають з бюретки, тримаючи її в руках над стаканчиком. Зняти полярограму стандартного розчину з С1 при тих же значеннях потенціалу на РКЕ. 6. Послідовно розбавляючи розчин в електролізері новими порціями фонового електроліту (напр., 10 і 15 мл), аналогічним чином зняти полярограми для наступних стандартних розчинів, концентрації яких знаходять за формулою (11): СN = СоVo/VN. 7. Одержати у викладача розчин з невідомою концентрацією, відібрати піпеткою 2...5 мл і внести його в електролізер. Зняти останню полярограму для суміші розчинів (Сзаг). Всі полярограми повинні бути зняті з одним і тим же капіляром, при одній і тій же чутливості ґальванометра та постійному напорі ртутного стовпа. Результати розбавлення та значення потенціалів і виміряної сили струму записати в табл. 4. Таблиця 4
8. Про закінчення вимірювань повідомити викладача, опустити резервуар з ртуттю вниз до опору. Розчин з відпрацьованою ртуттю із стаканчика-електролізера вилити в стакан (банку) для зливу ртуті, закривши її годинниковим склом чи кришкою. РКЕ, сольовий місток і стаканчик-електролізер промити дистильованою водою, яку вилити в посудину з відпрацьованою ртуттю. Сольовий місток помістити в стакан з розчином KCl. РКЕ залишити в стаканчику-електролізері, наливши в нього дистильованої води, або закріпити електрод на штативі нижнім кінцем вгору, якщо це передбачено конструкцією установки.
Обробка одержаних даних та складання звіту За даними табл. 4 на міліметровому папері побудувати графіки полярограм для всіх концентрацій розчинів на одному рисунку і способом, показаним на рис. 1, виміряти і записати величини висоти полярографічних хвиль (hо, h1, h2, h3, hзаг). За одержаними даними побудувати калібрувальний графік залежності висоти хвилі hі від Сі, де і = 0, 1, 2, 3 — номер точки (розчину). За висотою хвилі hзаг, користуючись калібрувальним графіком, визначити загальну концентрацію Сзаг розчину, одержаного додаванням досліджуваного розчину. Концентрацію досліджуваного розчину Сх розраховуємо з рівняння (12): Сзаг∙Vзаг = СN∙VN + Cx∙Vx Звіт повинен містити назву роботи, коротку характеристику досліджуваних речовин, методику безпосереднього виконання роботи, результати спостережень (табл. 4) та обробки експериментальних даних (графіки полярограм, калібрувальний графік). Точки на графіках повинні бути чітко позначені. У висновках звіту повинен бути вказаний кінцевий результат дослідження — концентрація досліджуваного розчину.
ЛАБОРАТОРНА РОБОТА № 4
|
|||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 327; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.205.223 (0.05 с.) |
 (9),
(9), (10)
(10)