
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кулонометричні методи аналізу
4.4.1. Закони електролізу. Кулонометричні методи аналізу грунтуються на вимірюванні кількості електрики, яка витрачається на електрохімічну реакцію. В електрохімічній реакції бере участь або визначувана речовина (пряма кулонометрія), або утворюється речовина, яка кількісно реагує з визначуваною речовиною (кулонометричне титрування). Основою кулонометрії є закони Фарадея. Згідно І-го закону Фарадея, маса речовини, що виділяється на електроді, прямо пропорційна кількості електрики, яка витратилась на електроліз:
де m(A) - маса речовини A, г; Q - кількість електрики, Кл, k - коефіцієнт, електрохімічний еквівалент речовини, г/Кл. За ІІ-м законом Фарадея електрохімічний еквівалент речовини пропорційний її хімічному еквіваленту:
де M(A) - молярна маса речовини, г/моль; n - кількість електронів, які беруть участь в реакції; F - число Фарадея (F = 96500 Кл/моль). Об’єднана формула законів Фарадея:
Необхідні умови використання електрохімічної реакції в кулонометриному аналізі: 1) Електрохімічне перетворення речовини повинно перебігати із 100% виходом за струмом, тобто повинні бути відсутні побічні електродні реакції. При наявності побічних реакцій маса речовини, яка дійсно прореагувала на електроді, буде менша за масу речовини, розрахованої за формулою 4.39. Відношення цих мас називається виходом за струмом (h):
Побічні реакції відбуваються при наявності в розчині домішок, які окиснюються або відновлюються на електроді із значенням потенціалу при якому відбувається електроліз. Тому, для забезпечення 100% виходу за струмом необхідна відсутність речовин, які електроактивні при потенціалі електроду, або потенціал електроду повинен бути нижчим, ніж потенціал розкладу домішок. 2) Необхідно, щоб момент закінчення електрохімічної реакції можна було достатньо точно встановити. 3) Повинен існувати спосіб точного вимірювання кількості електрики, яка витрачається на електрохімічну реакцію. Кулонометричний аналіз проводиться на кулонометричній установці (рис. 4.12), яка складається з джерела постійного електричного струму (1), електролізера (2), прилада для вимірювання кількості електрики (3).
Джерело електричного струму є або батареєю акумуляторів чи гальванічних елементів, або випрямлячем змінного струму з регульованою вихідною напругою чи струмом.
Електролізер складається з двох камер в яких знаходяться індиферентні електроди (8), зазвичай платинові. Камери з’єднуються пористою скляною перегородкою (4) або електролітичним містком. Досліджувана речовина вміщається в робочу камеру (5) з робочим електродом, допоміжна камера (6) заповнюється розчином відповідного електроліта. В робочій камері розташована магнітна мішалка (7), робочий електрод має велику поверхню. Якщо електроліз проводиться при постійній в часі силі струму (I, А) і можна точно виміряти час електролізу (t, с), кількість електрики визначається за формулою: Q = It (I = Const). (4.43) Якщо сила струму під час електролізу змінюється, цією формулою користуватися не можна і кількість електрики визначити складніше:
Для цього використовуються інтегратори струму або хімічні кулонометри. Це електролізери, у яких в умовах 100 % виходу за струмом утворюється певна речовина, точна кількість якої визначається або зважуванням, або визначенням об’єму газу, або титруванням. Переважно використовують водяний (Н2О) або йодидний (KJ) кулонометри.
4.4.2. Пряма кулонометрія. Пряма потенціостатична кулонометрія проводиться при постійному потенціалі робочого електрода. Склад електроліту робочої камери і потенціал робочого електроду вибираються такими, щоб забезпечити 100 % вихід за струмом. В цих умовах у процесі електролізу кількість носіїв заряду зменшується, а значить, зменшується електрична провідність розчину, що при постійному потенціалі призводить до зменшення сили струму (рис. 4.13).
Рис. 4.13. Зміна сили струму при потенціостатичній кулонометрії.
При дифузійному режимі електролізу в робочій камері спадання струму описується формулою: It = I 0 e-Kt, (4.45) де I 0 та It - сила струму на початку і в момент часу t; K - константа швидкості електролізу. Константа K залежить від розмірів робочої камери і властивості розчинника:
де D - коефіцієнт дифузії; S - площа поверхні робочого електрода;
V - об'єм розчину в робочій камері; d - товщина дифузійного шару. При перемішуванні електроліту товщина дифузійного шару зменшується, що прискорює електроліз. Теоретично електроліз завершується при безмежному часі електролізу, але, якщо зупинити електроліз при силі струму 0,01(I0) або 0,001(I0), буде забезпечена відносна точність результату – 1 або 0,1 %, відповідно. Кількість електрики можна визначити з допомогою кулонометрів чи інтеграторів струму або розрахунковим шляхом, виходячи з формул 4.44 і 4.45:
K і I0 можна розрахувати з параметрів прямої лінії, побудованої в координатах ln It - t. При наявності в розчині двох електроактивних речовин, потенціали розкладу яких суттєво відрізняються, можливе їх послідовне визначення при різних потенціалах робочого електрода. Незручність методу потенціостатичної кулонометрії полягає в порівняно складному визначенні кількості електрики. Пряма амперостатична кулонометрія проводиться, коли джерело постійного струму забезпечує регульовану, постійну в часі силу струму не залежно від характеристики електролітичної комірки. Амперостатична кулонометрія не використовується, якщо визначуваний іон знаходиться в розчині. У цьому випадку в процесі електролізу концентрація носіїв заряду зменшується, що призводить до зменшення електричної провідності і, при забезпеченні постійності сили струму, до збільшення потенціалу електрода (рис. 4.14).
Рис. 4.14. Зміна потенціалу при амперостатичній кулонометрії.
Зростання потенціала призводить до збільшення ймовірності побічних реакцій електролізу інших іонів розчину або розчинника. Внаслідок цього практично неможливо забезпечити 100 % вихід за струмом і одержати точні результати. Якщо ж визначувана речовина знаходиться на електроді у твердому вигляді (наприклад, метал, оксиди металів), потенціал електроду практично не змінюється, тому що активнісь твердої фази не змінюється до повнго її зникнення. Після повного розчинення твердої речовини, яка вкриває електрод, потенціал електрода різко збільшується до величини, яка відповідає розчиненню іншої твердої фази, матеріалу електрода або потенціалу розкладу інших іонів в розчині або розчинника. Цей стрибок потенціалу дозволяє зафіксувати час розчинення визначуваної речовини і розрахувати кількість електрики за формулою 4.43. Амперостатична кулонометрія може використовуватися і для аналізу іонів в розчині, якщо вони попередньо електровідновлюються або окиснюються на електроді з утворенням твердої сполуки на поверхні електрода, з наступним розчиненням її при постійній силі струму. Цей метод застосовується для визначення товщини металічних покрить або оксидних плівок на різних поверхнях.
4.4.3. Кулонометричне титрування. Кулонометричне титрування полягає в тому, що в розчин з речовиною, яку аналізують (A), додають допоміжний електроліт (Z), який при певних умовах піддається електролізу з утворенням проміжного реагента (T), який реагує з досліджуваною речовиною. Z + e = T на електроді A + T = B в розчині Коли вся досліджувана речовина прореагує (точка еквівалентності), електроліз припиняють і визначають кількість електрики, яка пішла на електроліз за цей період. Особливістю кулонометричного титрування є відсутність розчину титранта. Речовина, яка вступає в реакцію титрування з визначуваною речовиною утворюється (генерується) в розчині на робочому електроді.
Кулонометричне титрування здійснюється, переважно, амперостатично, і кількість електрики визначається за формулою 4.43, де t - час, який пройшов від момента початку електролізу до момента, який відповідає точці еквівалентності. 100 % вихід за струмом забезпечують, беручи концентрацію допоміжного електроліта в 100 - 1000 разів більшу, ніж потрібно за стехіометрією реакції титрування. В результаті до точки еквівалентності концентрація електроліта практично не змінюється і не призводить до підвищення потенціалу електрода та проходження побічних реакцій, як в прямій амперостатичній кулонометрії. Точка еквівалентності в кулонометричному титруванні може бути визначена або хімічним методом (з допомогою хімічних індикаторів), або фізико-хімічними методами (електрохімічними або фотометричними). Визначувані речовини можуть бути як неелектроактивними, так і електроактивними. У випадку електроактивних визначуваних речовин можливий наступний перебіг реакцій: Z + e = T на електроді A + e = B на електроді A + T = B + Z в розчині У цьому випадку кількість електрики, яка проходить через електрод, витрачається на реакцію з визначуваною речовиною і допоміжним електролітом, але, внаслідок швидкого і повного проходження реакції в розчині (реакція титрування), сумарна кількість визначуваної речовини, що прореагувала, точно відповідає кількості електрики, яка проходить через електрод. Реакція в розчині призводить до регенерації допоміжного реактива (Z), концентрація якого до точки еквівалентності не змінюється і можна не давати його великого надлишку. Як хімічні реакції між визначуваною речовиною і проміжним реагентом можуть використовуватися будь-які реакції, які використовуються в титруванні. Приклади використання різних реакцій титрування Реакція осадження використовується для визначення іонів галогенів титруванням іонами срібла електрогенерованими з срібного електрода: Hal - + Ag - e = AgHal ↓ на аноді, Ag - e = Ag + на аноді, Hal - + Ag + = AgHal ↓ в розчині. Точку еквівалентності зручно встановити потенціометрично за зміною потенціала срібного індикаторного електрода. Реакція комплексоутворення зазвичай використовується з участю комплексону: H 2 Y 2- + Hg - 2 e = HgY 2- + 2 H + на аноді,
Hg - 2 e = Hg 2+ на аноді, H 2 Y 2- + Hg 2+ = HgY 2- + 2 H + в розчині. Точку еквівалентпості зручно визначити кондуктометрично. До точки еквівалентності електрична провідність різко збільшується через зростання в розчині рухливих іонів водню, після точки еквівалентності електропровідність збільшується повільніше через меншу рухливість іонів ртуті. Реакція окиснення-відновлення. Для визначення Ce4+ у розчин додають Fe3+, на платиновому катоді відбуваються реакції: Ce 4+ + e = Ce 3+ Fe 3+ + e = Fe 2+ Ce 4+ + Fe 2+ = Ce 3+ + Fe 3+ в розчині. Точка еквівалентності визначаеться потенціометрично з платиновим індикаторним електродом. Реакція кислотно-основної взаємодї. У водних розчинах допоміжною речовиною є розчинник - вода, яка при електролізі на катоді або на аноді генерує відповідно H+ та OH-. Наприклад, на катоді: 2 H + +2 e = H 2 ↑ 2 H 2 O + 2 e = H 2↑ + 2 OH - з відповідною реакцією в розчині: H + + OH - = H 2 O Точку еквівалентності можна визначити з допомогою відповідних кислотно-основних індикаторів або потенціометрично зі скляним індикаторним електродом. Визначеня різних неелектроактивних органічних сполук (оксинів, амінів, фенолів, нафтолів, хінолінів) можна здійснити електрогенерованим Br2 з броміду на Pt аноді: 2 Br - - 2 e = Br 2, з наступною реакцією в розчині: C 6 H 5 OH +3 Br 2 = C 6 H 2 Br 3 OH + 3 Br - + 3 H + Точку еквівалентності визначають потенціометрично або йодометрично. Масу визначуваних речовин розраховуюь за формулою 4.39, де n - кількість електронів, яка еквівалентна молекулі визначуваної речовини з урахуванням стехіометрії реакцій, які відбуваються на електроді і в розчині. В останньому прикладі f(C6H5OH) = 1/6. Кулонометричне титрування більш чутливе ніж інші титриметричні методи і при визначенні малих кількостей речовини суттєвою стає систематична індикаторна помилка фіксування точки еквівалентності. Тому, крім визначення часу електролізу до кінцевої точки титрування, проводять холостий дослід, який здійснюють в тих самих умовах тільки без досліджуваної речовини. Для одержання точних результатів від часу електролізу визначуваної речовини віднімають час фіксування точки еквівалентності холостого досліду. Переваги кулометричноо титування: 1. Виключається необхідність приготування і стандартизації розчину титранту. 2. Можливість використання для титрування речовин, стандартні розчини яких нестабільні (Cl2, Br2, Ag+, Cu2+, Ti3+, Sn2+ та інші). 3. Розчин в процесі титрування не розбавляється. 4. В одному і тому ж розчині допоміжного електроліту можливе проведення титрування декількох зразків. 5. Титування може бути повністю автоматизоване. 6. Можна визначати в одному розчині кілька речовин.
Питання для самоконтролю. 20. На чому грунтуються кондуктометричні методи аналізу? 21. Електрична провідність розчинів електролітів – питома, еквівалентна, рухливість. 22. Принципова схема кондуктометричної установки. 23. Прямий кондуктометричний аналіз, його переваги і недоліки. 24. Кондуктометричне титрування, його можливості.
25. Закон Фарадея. 26. Вихід за струмом. 27. Потенціостатична кулонометрія. 28. Амперостатична кулонометрія. 29. Кулонометричне титрування.
|
|||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 546; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.61.142 (0.053 с.) |
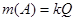 , (4.39)
, (4.39) , (4.40)
, (4.40) . (4.41)
. (4.41) . (4.42)
. (4.42)
 (I = f(t)) (4.44)
(I = f(t)) (4.44)
 , (4.46)
, (4.46)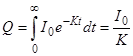 (4.47)
(4.47)



