
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Деякі загальні подання про взаємодію металів з газами
Взаємодія металів з газами при зварюванні та споріднених технологіях викликає утворення пір, зниження тривалої міцності сполук зі сталей і сплавів, зниження тендітної міцності. Для розробки оптимального технологічного процесу необхідне знання характеру взаємодії металів з газами взагалі. Гази, що поглинаються металами, можуть рівномірно розподілятися по об'єму або концентруватися в поверхні. Поглинання газів поверхнею називається адсорбцією. Об'ємне поглинання газів називають абсорбцією або оклюзією. Поглинання газів і поверхнею, і об'ємом (обома способами) називається сорбцією. Поглинання газів металами може бути також пов'язане з утворенням поверхневих плівок, хімічних сполук (окислів, нітридів і ін.). На поверхні гази втримуються силами хімічної природи - процес хемосорбції або більше слабкими силами - процес фізичної адсорбції. Поглинання металами газів являє собою складний процес, що складається з ряду елементарних процесів. До їхнього числа ставляться: 1) підхід молекули газу до поверхні металу; 2) адсорбування газу на поверхні металів; 3) дисоціація молекул газу на атоми під впливом атомів поверхневого шару металу; 4) іонізація атомів; 5) перехід атомів газу через границю газ – метал і нагромадження їхньому поверхневому шарі металу; 6) дифузія газу (масопереніс атомів газу) через об'єм металу; 7) розчинення атомів газу в металах; 8) утворення хімічних сполук газів з металами; 9) розчинення хімічних сполук у металах. Перераховані елементарні процеси в різних умовах можуть протікати й одночасно, в деякій послідовності. У той же час молекули газу можуть не тільки адсорбовуватися, розчинятися, але й десорбуватися з поверхні виробу, тобто процес може йти у зворотному напрямку, зокрема при охолодженні виробу. У багатостадійному процесі взаємодії газу з металом масопереніс атомів газу в об'ємі розплавленого металу не обмежується швидкістю розподілу азоту й водню між металом і газовою фазою. Загальна швидкість насичення металу краплі газами визначається швидкістю підходу атмосферного повітря до металу, тобто адсорбцією й переходом газу через границю газ-метал. У той же час, протікання таких етапів, як адсорбція й дисоціація газових молекул, їхнє нагромадження в поверхневому шарі залежить від структури й властивостей самого поверхневого шару, а значить і від наявності в металі поверхнево активних елементів.
Але, крім властивостей поверхні металу, на швидкість насичення й виділення газів буде впливати й здатність самих газів до адсорбції, тому що в кожному із цих двох процесів однієї із проміжних стадій є адсорбція газів у поверхневому шарі металу. При цьому чим вище буде здатність газу до адсорбції, тобто чим вище буде його активність, тим легше повинне відбуватися й поглинання й виділення газу металом. А) Насичення металу газами, і в першу чергу азотом, воднем і киснем, призводить до зміни механічних властивостей металу й до порушення щільності сполуки. Наприклад, наявність азоту в металі, хоча призводить до підвищення міцності стали, але знижує пластичність через утворення нітридів. Досить значний негативний вплив водню на якість металу та з’єднання металів. При наявності водню знижується пластичність, втомлювальна і тривала міцність. Спостерігається фізична і хімічна дія водню. Фізична дія пов'язана зі створенням підвищеного тиску водню в мікропорах, що виникає в результаті перетворення на поверхнях дефекту атомарного водню в молекулярний. Хімічна дія водню пов'язана з зневуглецюванням і руйнуванням границь зерен. Присутність водню в розплавленому металі сприяє також утворенню тріщин в основному металі й виникненню дефектів. Б) Механізм кінетики поглинання й виділення газів обумовлюється їхньою поверхневою активністю. У свою чергу активність визначається впливом газів (азоту, водню, кисню) на одну з найважливіших поверхневих характеристик – на поверхневий натяг металу. Установлено, що водень володіє не дуже великою активністю з погляду впливу на поверхневий натяг металів і їхніх сплавів. У той же час азот більше активний. Азот є поверхнево активним елементом як у чистому залізі, так і в сплавах на основі заліза. Знизити поверхневу активність азоту, а також і водню можна шляхом введення в метал інших більше активних елементів. До поверхнево активних елементів, що знижують поверхневий натяг сталей ставляться сірка, вуглець, марганець, кремній, хром, фосфор.
У той же час нікель, титан, молібден, вольфрам підвищують поверхневий натяг сплавів на основі заліза. У загальному випадку кількісний вплив окремих елементів залежить від їхнього змісту й змісту в сплаві інших добавок. Концентрація атомів газу в поверхневому шарі металу приблизно може бути визначена за рівнянням
де N – число Авогадро; М – молекулярна маса газу; d – щільність розплаву; с – концентрація поверхово активного елемента; σ – поверхневий натяг розплаву. Відповідно до цього рівняння адсорбція водню падає з ростом змісту вуглецю в розплаві. За допомогою даного рівняння також можна знайти залежність адсорбції азоту від змісту в рідкому залізі активних елементів. Самим поверхово активним елементом у сталях є кисень, тому його невеликі добавки істотно знижують поверхневий натяг. Окислення Як ми вже відзначали кисень є найбільш активним елементом. Властивості металевої поверхні, покритої шаром адсорбованого кисню, відрізняються від властивостей поверхні металу, покритої оксидом. Будова адсорбованої плівки двовимірне, при якому атоми кожного виду мають кількість сусідів, що відрізняється від того, котре вони мають в оксидній плівці. Плівку хемосорбованого кисню необхідно розглядати як хімічну речовину з певною структурою, що володіє певними термодинамічними константами, здатне брати участь в зворотних рівновагах. Дуже важливою особливістю цієї плівки є те, що вона пов'язана з металевою основою. Адсорбована плівка містить у собі не тільки атоми адсорбованої речовини, але й поверхневі атоми металу. Ці атоми зв'язують тверде тіло з адсорбованою речовиною й перебувають тому в зовсім іншому стані, чим атоми в об'ємі твердого тіла. З боку атмосфери плівка покрита фізично адсорбованим киснем. Хімічний зв'язок між киснем і атомами поверхні металу — іонний. Передача електронів від металу кисню при утворенні зв'язку приводить до появи негативного заряду на плівці та позитивному заряді на її внутрішній поверхні. Зв'язок між адсорбованим киснем і металом значно сильніше зв'язку кисню з металом в окислі. Кінетика адсорбції кисню на чистих металах показує, що як тільки метал приводиться в зіткнення з киснем, відбувається миттєве закріплення кисню. При підвищенні температури відносна кількість миттєво закріпленого кисню в порівнянні із загальною кількістю адсорбованого кисню зростає, тоді як період адсорбції (а не миттєвого закріплення) має тенденцію до зменшення. Слідом за закріпленням кисню, якщо температура досить висока, на поверхні металу утвориться плівка оксиду. За сучасними даними утворення плівки оксиду починається й проходить через ряд різних адсорбційних станів, характерних для хемосорбції на металевій поверхні. Наприклад можливі наступні стадії: 1. Хемосорбція на непорушеній металевій поверхні. 2. Атомне перегрупування, при якій поверхневі атоми металу залишають свої місця - корозійна хемосорбція. 3. Адсорбція додаткових молекул газу на іонах металу, які виникають внаслідок процесів перебудови при атомному перегрупуванні. Схематично поява плівки оксиду на поверхні металу з хемосорбованого кисню можна представити як результат перебудови атомів металу й кисню поблизу поверхні так, щоб просторовий розподіл цих двох видів атомів було близьким тому, що спостерігається в оксиді. Перебудова припускає міграцію на невеликі відстані поверхневих атомів і атомів кисню, що вимагає значної енергії активації. При зміні взаємного розташування атомів відбувається збільшення кількості найближчих сусідів і для атомів металу й для атомів кисню. Структура впорядковується, зменшується асиметричність зв'язків метал-кисень в адсорбованій плівці й цим самої відновлюється іонний характер зв'язків, яким вони володіють в оксиді.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 143; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.88.249 (0.008 с.) |
 (9.1)
(9.1)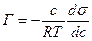 – величина адсорбції, відповідно до рівняння Гіббса;
– величина адсорбції, відповідно до рівняння Гіббса;
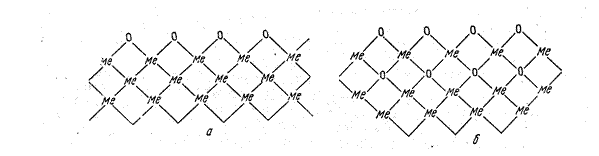 Рис.9.1.Схема появи плівки оксиду на поверхні металу
Рис.9.1.Схема появи плівки оксиду на поверхні металу


