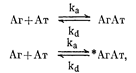Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Радиоиммунологические методы
Радиоиммунологические методы в настоящее время, вероятно, наиболее широко применяются для количественного определения гормонов и многих других соединений в биологических жидкостях. Как показывает само название, радиоиммунологический метод представляет собой иммунологическое исследование, в котором используют меченые гормоны или связывающие их антитела. Более 20 лет назад Berson и Yalow [26] предложили радиоиммунологический метод определения инсулина. Этот метод основывался на их наблюдении, согласно которому в периферической крови больных диабетом, получавших инсулин, присутствует белок (который, как было показано позднее, является глобулином), связывающий инсулин, меченный 131I Значение этих данных и последующей разработки радиоиммунологического метода определения инсулина подчеркивается присуждением Yalow и Berson нобелевской премии. Вскоре после первых сообщений этих исследователей другими лабораториями были разработаны и описаны соответствующие методы для определения других гормонов. В этих методах применяются либо антитела, либо сывороточные белки, связывающие определенный гормон или лиганд и несущий радиоактивную метку-гормон, конкурирующий со стандартным гормоном или гормоном, присутствующим в биологической пробе. Термодинамически взаимодействие антигена и антитела можно рассматривать как реакцию псевдопервого порядка, которая схематически может быть представлена следующим образом
где Аг — антиген или гормон, at — антитело к антигену или гормону, Аг — радиоактивно меченный антиген или гормон. Kd — константа скорости диссоциации. Ка — константа скорости ассоциации.
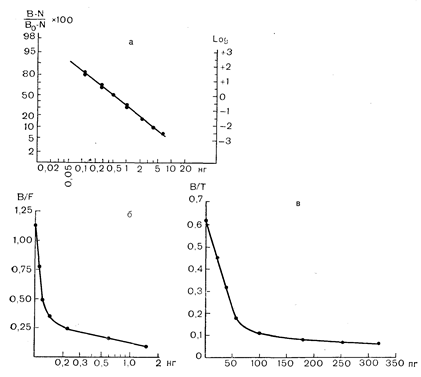
Рис. 5—1. Кривые доза—реакция, полученные с помощью трех разных методов определения гормонов. а—преобразования данных в системе logit-координат, где N—импульсы, обусловленные неспецифическим связыванием, Во — максимальное число импульсов связанного гормона, когда в инкубационной среде присутствуют только антитела и меченый гормон; б — данные представлены как отношение импульсов связанного гормона (В) к импульсам (F) против логарифма концентрации гормона; в — кривая доза — реакция для определения стероидного гормона в координатах В/Т против дозы гормона, где Т — общее число импульсов.
Реакция антиген—антитело обратима, но скорость диссоциации комплекса антиген—антитело значительно меньше, чем скорость его ассоциации. Количество гормона, связанное с антителом, является результирующей скоростей ассоциации и диссоциации. Поскольку в каждую пробирку вносят постоянную концентрацию антител и меченого гормона, количество импульсов, связанных с антителами, должно зависеть от концентрации немеченого гормона, добавляемого в виде стандарта или неизвестной пробы. Чем выше концентрация немеченого гормона, тем меньшим оказывается количество импульсов, связанных с антителами, присутствующими в системе в фиксированной концентрации. На рис.5—1 приведены различные часто применяющиеся способы графического изображения результатов радиоиммунологических исследований. Верхний график представляет собой кривую доза—реакция в логарифмических координатах, где по оси ординат отложено число импульсов гормона, связанного с антителами, приведенное к максимальному числу связанных импульсов (Во), когда инкубируются только антитела и меченый гормон (без немеченого). Это построение в системе logit-log координат обычно представляет собой прямую линию, что облегчает визуальную интерполяцию количества гормона в неизвестной пробе. С целью получения прямой линии, облегчающей визуальную интерполяцию количества гормона в неизвестных пробах, применяют различные способы трансформации данных. Большинство результатов радиоиммунологических определений подвергается машинной обработке, позволяющей избежать утомительных и длительных расчетов. Получение высокоочищенных гормонов дало возможность разработать чувствительные радиоиммунологические методы для точного измерения низких физиологических уровней циркулирующих гормонов, требующие относительно малых объемов биологических жидкостей. Для чувствительных радиоиммунологических определений необходимо следующее 1 — высокоочищенный гормон, несущий радиоактивную метку с достаточно высокой удельной активностью, чтобы в каждую пробирку можно было вносить только «следовые» его количества; 2 — реактивы, используемые в реакции присоединения метки, не должны изменять иммунореактивности гормона в существенной степени; 3 — антитела с достаточно высокой чувствительностью (сродством) и специфичностью, чтобы определить низкие физиологические уровни нужного гормона; 4 — соответствующий препарат сравнения, по отношению к которому можно было бы интерполировать неизвестные концентрации гормона в неизвестной пробе. Препарат сравнения и исследуемый гормон должны одинаково взаимодействовать с антителами и давать параллельные кривые доза—реакция.
В надежных системах для радиоиммунологического определения концентрация меченого гормона и антител фиксирована. В связи с этим по мере увеличения концентрации немеченого гормон уменьшается вероятность связывания меченого гормона с антителами, что обусловливает обратное соотношение между числом молекул меченого гормона, связанных с антителами, и концентрацией немеченого гормона в реакционной смеси. В отношении взаимодействия антигена с антителами принимаются некоторые допущения 1 — присутствующий гормон гомогенен и взаимодействует с антителами с равным сродством независимо от того, содержит он радиоактивную метку или нет; 2 — присутствующие антитела гомогенны и одна молекула антитела взаимодействует с одной молекулой гормона; 3 — два разных вида молекул — гормон и антитела — реагируют до тех пор, пока между ними не установится равновесие; 4 — применяется эффективное средство разделения связанного с антителами и свободного гормона, причем методика разделения не нарушает исходного равновесия, достигнутого между гормоном и антителами. Хотя перечисленные допущения идеализируют ситуацию, но они приблизительно очерчивают условия радиоиммунологических исследований. С помощью соответствующих методов удается определить такие концентрации гормонов, которые обычно не поддаются определению большинством биологических методов in vivo. Под чувствительностью или наименьшей определимой дозой понимают ту концентрацию гормона, которая вызывает значимое изменение процента связывания меченого гормона с антителами при сравнении с «пустой» пробой. Чувствительность определения зависит от сродства гормона к специфическим антителам.
ЙОДИРОВАНИЕ Наиболее широко применяемым методом йодирования белков является, вероятно, модифицированный метод, предложенный Greenwood, Hunter и Glover [27]. В нем используется окисляющий агент хлорамин Т, превращающий Na125I в свободный йод, который затем включается главным образом в остатки тирозина. При использовании этого метода могут йодироваться и остатки гистидина. Для сохранения максимальной иммунореактивности необходимо, чтобы на молекулу гормона приходился только один атом 131I или 125I, поскольку большая степень йодирования обычно снижает иммунологическую и биологическую активность гормона, изменяя его химические свойства [27]. В настоящее время применяют и другие способы йодирования. Второе по популярности место занимает, по-видимому, ферментативный метод с использованием лактопероксидазы [28, 29]. В присутствии перекиси водорода, добавляемой непосредственно в реакционную смесь, лактопероксидаза превращает Na125I в свободный йод, который избирательно включается в остатки тирозина. Поскольку перекись водорода является сильным окислителем, действие ее высоких концентраций на гормон может изменять его химические свойства; поэтому перекись водорода обычно добавляют двумя или тремя небольшими порциями, которые быстро используются в реакции. Другим, более новым, но менее распространенным методом йодирования, является метод, разработанный Bolton и Hunter [30]. В нем возможность вредных эффектов хлорамина Т, бисульфита натрия и перекиси водорода, применяемых в двух других методах йодирования, на гормон сводится к минимуму. С помощью хлорамина Т йодируют промежуточное соединение-сложный эфир, образованный N-оксисукцинимидом и 3-(р -оксифенил)-пропионовой кислотой, которое затем конденсируется с аминогруппами полипептидного гормона. Такой подход позволяет избежать воздействия на гормон сильных окислителей или восстановителей. Эта методика несколько громоздка и пока не получила широкого распространения.
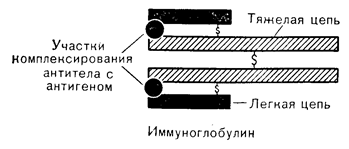
Рис. 5—2. Схематическое изображение молекулы g-глобулина или антитела. Участки, «узнающие» гормон, могут содержать разные аминокислотные области легких и тяжелых цепей иммуноглобулина. Легкие цепи ковалентно связаны с тяжелыми дисульфидными мостиками, обозначенными знаком S. Одна дисульфидная связь имеется и между двумя тяжелыми цепями. Недавно полученные данные указывают на Y-образную конфигурацию молекулы иммуноглобулина, в которой участки коплексирования с антигеном расположены в верхней части этой фигуры.
В настоящее время используют не Na131I, a Na125I, поскольку он обладает значительно большим периодом полураспада: 59 дней вместо 6. Однако при работе с 125I необходима особая тщательность, так как его удельная g-активность значительно ниже, чем у 131I. Стероидные гормоны и витамин D метят тритием, что позволяет получить более высокую удельную активность, чем с помощью метки 14C. Полипептиды, не имеющие в своем составе остатков тирозина или гистидина, можно модифицировать, вводя или присоединяя тирозин к их структуре без видимого изменения конформации нативного соединения. Выбирают такие замещения, которые с наименьшей вероятностью изменят конформацию молекулы. ПОЛУЧЕНИЕ АНТИСЫВОРОТКИ Антитела принадлежат к классу иммуноглобулинов и являются преимущественно g-глобулинами (IgG). Молекула IgG состоит из 4 полипептидных цепей: двух тяжелых и двух легких, расположенных симметрично и ковалентно связанных друг с другом дисульфидными мостиками. Схематическое изображение этой молекулы приведено на рис. 5—2. Взаимодействие антигена, или лиганда, с антителом можно уподобить контакту «замка и ключа». Форма комплексобразующего участка антитела комплементарна таковой участка антигена. Связь между антигеном и антителом обусловлена сочетанием электростатических, водородных и ван-дер-ваальсовых взаимодействий [31, 32]. Форму связывающего участка и тем самым сродство и специфичность связи молекулы IgG с нужным антигеном определяет аминокислотная последовательность комплексообразующего участка этой молекулы [33].
Для получения системы определения гормона высокоочищенный гормон вводят лабораторным животным, индуцируя у них синтез иммуноглобулинов, обладающих достаточно высокой специфичностью и чувствительностью, чтобы их можно было использовать для радиоиммунологических определений. Как правило, соединения с размерами молекул менее 1000 дальтон недостаточно иммуногенны и для придания им свойств активных нммуногенов их нужно соединять с молекулой-носителем. Иммуногеном называется вещество, способное индуцировать образование антител. Для того чтобы обеспечить возможность индукции антителообразования, небольшие молекулы, или гаптены, можно соединять с такими веществами, как альбумин, тироглобулин или гемоцианин. Иммуногенная реакция обычно выше в случае введения тех белков-носителей, которые и сами являются высокоиммуногенными. В связи с этим такие вещества, как альбумин, тироглобулин и гемоцианин являются более подходящими белками-носителями, чем полилизин или другие синтетические полиаминокислоты, при индукции синтеза специфических антител к конъюгированным гаптенам. Стероиды, тиреоидные гормоны (трийодтиронин и тироксин) и различные формы витамина D, как правило, требуют конъюгации с белками-носителями. Необходимо тщательно следить за тем, чтобы в процессе конъюгации стероидов и других гаптенов принимала участие та часть молекулы, изменение которой в наименьшей мере сказывалось бы на стереоспецифичности этой молекулы. Например, антитела к 17 b-эстрадиолу лучше всего образуются при ковалентном присоединении его 6-кетоаналога к альбумину, т. е. при сохранении интактности 3- и 17-гидроксильных групп, равно как и кольца А, стероида. Последнее особенно важно, поскольку именно эти структуры придают данному эстрогену специфичность. За многие годы разработаны разнообразные методики иммунизации, но все они, по существу, являются модификациями оригинальной методики Фрейнда [34]. Эмульсия, содержащая гормон, или иммуноген, соответствующее масло и убитые нагреванием туберкулезные палочки, вводят внутри- или подкожно. С получением высокоочищенных гормонов и других производных удалось разработать методику иммунизации малыми количествами иммуногена [35]. Имеются надежные экспериментальные доказательства образования специфических обладающих высоким сродством антител к малым дозам иммуногена [36]. Именно малые дозы иммуногена с наибольшей вероятностью обусловливают продукцию специфических иммуноглобулинов теми клетками, которые образуют антитела с наиболее высоким сродством к иммуногену. В связи с этим при применении больших доз иммуногена повышается вероятность выработки антител, обладающих низким сродством. При введении очень больших доз иммуногена у иммунизированных животных может наблюдаться феномен толерантности, когда антитела вообще не образуются или образуются в очень низких титрах [37, 38]. После начальной иммунизации обычно должно пройти минимум 6 нед, чтобы появились значительные титры антител. Сродство антител продолжает увеличиваться и достигает максимума обычно между 8-й и 12-й неделей после начальной иммунизации [35, 39]. Эмпирически установлено, что повторная иммунизация животного обеспечивает лучшую реакцию в том случает, если повторные инъекции производят в период снижения титра циркулирующих антител. При повторном введении 1/2 или 1/4 дозы гормона, использованной при первичной иммунизации, значительное повышение титра циркулирующих антител наблюдается уже через несколько дней. Повторную иммунизацию животного следует производить в ту же анатомическую область, в которую иммуноген вводили первый раз. Больше того, для воспроизведения реакции «по памяти» уже не нужно вводить убитые нагреванием туберкулезные бациллы, которые могут увеличивать заболеваемость и смертность животных.
Для получения специфических антител следует выбирать те виды животных, которые легко доступны, не слишком дороги и у которых структура своего собственного эндогенного гормона значительно отличается от применяемого для иммунизации. Например, хотя СТГ у животных разных видов обладают одинаковой биологической активностью, но они существенно различаются по аминокислотному составу. Эти различия в первичной структуре, как и некоторые другие недостаточно охарактеризованные факторы определяют иммуногенность гормона для других видов животных. В некоторых случаях аминокислотные последовательности могут различаться относительно слабо и поэтому нужно с особой тщательностью подбирать вид животного, которому вводят гормон. Например, структура инсулина у человека, кролика и овцы почти одинакова, но инсулины человека и морской свинки различаются сильнее. Для получения специфических антител к инсулину человека лучше всего использовать именно морских свинок [40]. ЧУВСТВИТЕЛЬНОСТЬ СИСТЕМЫ ОПРЕДЕЛЕНИЯ После получения антител от иммунизированного животного и определения их концентрации проводят оценку чувствительности и специфичности антисыворотки. Концентрацию антител в сыворотке вначале определяют по связыванию меченого гормона, который применяли для иммунизации, причем используют разные разведения антисыворотки. Этот способ называется титрованием и под титром понимают концентрацию молекул антител в сыворотке. После нахождения той концентрации антител, которая в равновесных условиях связывает 30—40% меченого гормона, определяют чувствительность и специфичность антител. Получение и характеристика специфических систем для определения ХГЧ и инсулина очень подробно изложена в других публикациях и может служить ориентиром при получении других специфических радиоиммунологических систем определения гормонов. В реальных условиях антитела, получаемые для использования в клинических радиоиммунологических исследованиях, содержат популяцию иммуноглобулинов, обладающих различной специфичностью и сродством. Следует выбрать антисыворотку, содержащую популяцию антител с достаточно высоким сродством и специфичностью к тому гормону, который предстоит определить. На практике выбрать такую популяцию антител с высоким сродством можно путем достаточно высокого разведения антисыворотки, чтобы роль других популяций антител, обладающих низшим сродством и, возможно, неспецифических, стала относительно несущественной.
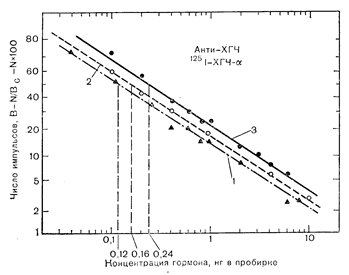
Рис. 5 — 3. Кривая доза — реакция для ХГЧ-a, определяемого в гомологичной для него радиоиммунологической системе. Три кривые доза — реакция для ХГЧ-а получены в условиях, отличающихся только концентрацией антител к ХГЧ-a. При увеличении начального отношения В/Т с 25 до 60% вследствие увеличения концентрации антител точка на оси абсцисс, соответствующая 50% снижению исходного связывания, сдвигается с 0,12 до 0,24 нг в пробе. 1 — В/Т=25%: 2 — В/Т=32%: 3 — В/Т =60%. Обозначения см. на рис. 5-1;
При выборе такого разведения антисыворотки, которое отличается от использованного вначале для характеристики системы, необходимо заново определить ее чувствительность и специфичность, поскольку в ином разведении концентрация других популяций антител может оказаться относительно высокой, и разведенная антисыворотка будет обладать меньшей чувствительностью и специфичностью. Такая ситуация графически представлена на рис. 5—-3, на котором кривая доза—реакция для высокоочищенного лиганда смещена вправо, что отражает снижение чувствительности системы по мере увеличения концентрации антител. Поскольку гормоны содержатся в крови в относительно низких концентрациях (10–12—10–9 М), необходимо отбирать антитела с высоким сродством и специфичностью. Сродство и специфичность каждого разведения антител нужно определять эмпирически. Больше того, антисыворотка, получаемая от одного и того же животного в разное время после иммунизации, может обладать существенно различающимися сродством и специфичностью по отношению к гормону, которым иммунизировали животное.
СПЕЦИФИЧНОСТЬ СИСТЕМЫ ОПРЕДЕЛЕНИЯ Следует учитывать как структуру, так и степень очистки гормона, используемого для иммунизации. Гликопротеиновые гормоны человека (ЛГ, ФСГ и ТТГ), а также хорионический гонадотропин, имеют общую четвертичную структуру и состоят из двух различных субъединиц, обозначаемых как a и бета [42]; a-субъединица, по существу, совершенно одинакова во всех этих гормонах с точки зрения ее аминокислотной последовательности. Иммунологическую и биологическую специфичность этим гормонам придает b-субъединица. В связи с этим необходимо тщательно выбирать антисыворотку, полученную к любому из гликопротеиновых гормонов, и тщательно проверять, достаточно ли она специфична, чтобы можно было определить концентрацию данного гормона в присутствии в той же пробе высокого уровня других гликопротеиновых гормонов. В некоторых случаях перекрестной реакции, обусловленной общностью антигенных детерминант, можно избежать, адсорбируя антитела на общем антигене. Например, если антисыворотка к ТТГ обнаруживает перекрестную реакцию с ФСГ и ЛГ и эта перекрестная реакция обусловлена общими детерминантами a-субъединицы, то данную антисыворотку можно очистить с помощью свободной a-субъединицы или ХГЧ, который содержит a-детерминанты. Такая «очищенная» антисыворотка в идеальном варианте специфична по отношению к ТТГ и практически не менее чувствительна к этому гормону. Проблема еще больше усложняется в связи с тем, что b-субъединицы ХГЧ и ЛГ обладают выраженной структурной гомологией, что и делает биологическую активность этих двух молекул неотличимой. В результате антитела, образующиеся к целым молекулам ЛГ и ХГЧ, по всей вероятности, будут взаимодействовать с любой из них и обоими вместе. Поскольку некоторые опухоли эктопически секретируют ХГЧ и поскольку высокие концентрации ХГЧ присутствуют и в нормальных условиях при беременности, при обычном определении ЛГ должны получать завышенные результаты, трактовать которые нужно с большой осторожностью. Наилучшим клиническим доказательством преимущественного присутствия в периферической крови ХГЧ, а не ЛГ, является резкое расхождение концентраций ЛГ и ФСГ в одной и той же пробе; Загрязнение гормонального препарата, используемого для иммунизации животного, другим гормоном может создавать и другие методические проблемы. Даже в высокоочищенных препаратах гормонов гипофиза человека присутствуют небольшие, но существенные примеси других гипофизарных гормонов. Это справедливо также для гормонов, получаемых в чистом виде из поджелудочной железы и желудочно-кишечного тракта. Очевидно, что у иммунизированного этими гормонами животного могут образовываться антитела к любому из попавших в его организм гормонов, в том числе и к тем, которые присутствовали в виде примесей, В связи с этим необходимо знать источник гормона, поскольку в процессе его очистки могут одновременно очищаться и другие гормоны, попадающие в конечный препарат. В идеальном случае следовало бы проверить структурное сходство гормонов, так как именно оно может служить основой перекрестной реактивности некоторых антисывороток по отношению к разным гормонам. ЭФФЕКТ СЫВОРОТОЧНЫХ БЕЛКОВ Поскольку между различными стероидами, между тироксином и трийодтиронином и некоторыми их метаболитами и между различными формами витамина D отмечается выраженная структурная гомология, не всегда возможно получить антисыворотку, достаточно специфическую, чтобы без предварительного применения методов экстракции и разделения избирательно определять эти гормоны и их метаболиты. Некоторые гормоны циркулируют в крови, будучи связанными со специфическими белками-переносчиками или более рыхлой связью с альбумином. Для того чтобы избежать загрязнения радиоиммунологической системы связывающими белками сыворотки, необходимо вначале экстрагировать гормон соответствующим растворителем. Начальную экстракцию следует проводить и при малой специфичности антител к гормону. В некоторых случаях может оказаться достаточной дифференциальная экстракция, но в других необходимо произвести хроматографическое разделение гормонов. К наиболее распространенным средствам разделения структурно близких стероидов относятся тонкослойная хроматография и хроматография на колонках сефадекса LH-20. Поскольку крупные полипептидные гормоны циркулируют в крови, не будучи связанными с белками-переносчиками, начальный этап экстракции в этом случае не нужен, и аликвоту сыворотки можно прямо помещать в пробирку для анализа. Однако содержащиеся в сыворотке протеазы могут обусловить занижение концентрации некоторых полипептидных гормонов. Если разрушение гормона существенно изменяет его структуру, он может и не реагировать с антителами. В результате появляется необходимость добавления в пробу ингибиторов ферментов, чтобы противодействовать эффекту протеаз. К ингибиторам протеаз, добавляемых в сосуды с пробами на АКТГ, глюкагон и другие гормоны, которые могут подвергаться быстрой протеолитической деградации, относятся трасилол и бензамидин. В отношении некоторых полипептидных гормонов отмечаются неспецифические эффекты сывороточных белков. Эти неспецифические белковые эффекты можно нивелировать, добавляя пустую сыворотку в пробирки для исследования, не содержащие сыворотки, с тем, чтобы все пробирки содержали сравнимые концентрации мешающих определению сывороточных белков. Каждую антисыворотку можно эмпирически проверять на неспецифический эффект белка в отношении реакции антиген—антитело.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 419; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.223.123 (0.026 с.) |