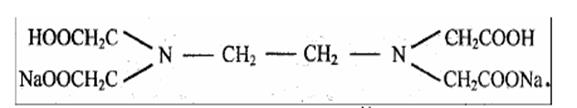Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика комплексных соединений
Теория комплексных соединений Альфреда Вернера (1866-1919 гг.), согласно которой комплексные соединения – это вещества (молекулы,ионы), которые состоят из М – комплексообразователя (центральный ион, атом) и связанного с ним донорно-акцепторной или ковалентной связями лигандов L.
K3[Fe(CN)6] – гексоцианоферрат III калия К+ - внешняя координационная сфера Fe3+ - центральный ион-комплексообразователь
[Fe(CN)6]3- - внутренняя координационная сфера (ион комплексообразователь + лиганд)
СN- - лиганд (характеризуется дентантностью (от лат. dentatus-зубчатый) – способность лигандов занимать определенное число мест около комплексообразователя: моно- ионы или молекулы, имеющие 1 непод.электр.пару (NH3, H2O, CN-, HO-, F-, Cl-, J- и др.) Лиганды, занимающие 2 координационных места, - би – или двудентантные (C2O42-, C2O32-, H2N-CH2-CH2-NH2 и др.). Дентантность определяется числом связей, которые лиганд способен образовывать с центральным атомом. Полидентантные лиганды с ионами металлов образуют комплексные соединения циклического строения, называемые хелатами (от англ. Chelate - клешня)- этилендиаминтетрауксусная кислота.
Важной характеристикой комплексных соединений является – координационное число N – число лигандов, связанное с комплексообразователем во внутренней координационной сфере (наиболее часто N=6,4 реже 2). Равновесие в растворах комплексных соединений Образование комплексных соединений происходит ступенчато. Каждая ступень характеризуется константой равновесия, которая называется константой устойчивости:
- - - - - - - - -
MLn-1 + L «MLn
x1, x2, xn – ступенчатые константы устойчивости (в справочнике Лурье) b1, b2, bn – общие константы устойчивости (b1 = x1, b2= x1×x2, bn= x1×x2×xn), величина обратная b обозн. Кн= 1/b – конст. нейстойкости.
Влияние температуры на равновесия в растворах комплексных соединений. Зависимость константы устойчивости от температуры имеет вид:
Где DН – тепловой эффект реакции, кДж/моль, R- универсальная газовая постоянная, равная 8,31 Дж/моль×К, Т – абсолютная температура, К. При протекании экзотермических реакций (DН>0) константы устойчивости с ростом температуры уменьшаются, а при протекании эндотермических – увеличиваются. Температурная зависимость констант устойчивости многих координационных соединений имеет вид вогнутой параболы, т.е. с ростом температуры устойчивость проходит через минимум.
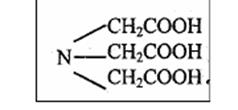
Рабочие растворы Комплексоны – органические производные аминополикарбоновых кислот Наиболее часто используют три Комплексон I – это трехосновная нитрилотриуксусная кислота (НТА): H3Y
Комплексон II –этилендиаминтетрауксусная кислота (ЭДТА): H4Y
Этот реагент образует шестидентантный лиганд, поскольку он может координироваться с ионом металла двумя атомами азота и четырьмя атомами кислорода карбоксильных групп. Комплексон II – это четырехосновная кислота и обозначается обычно H4Y, где Y4- – этилендиаминтетраацетат-ион. Белое кристаллическое вещество, малорастворимое в воде (при 200 С – 28,3 мг в 100 мл воды) и мин. при рН=1,6-1,8. В водных растворах в зависимости от рН могут существовать 5 форм ЭДТА м.д которыми устанавливается равновесие:
Константы устойчивости комплексов ионов с ЭДТА приводятся в справочнике Лурье и чем выше устойчивость образовавшегося комплекса, тем ниже значение рН комплексонометрического титрования.
На практике применяют двунатриевую соль этилендиаминтетрауксуснoй кислоты, комплексон III, или трилон Б: Na2H2Y×2H2O (дигидрат)
Рабочий раствор комплексона III готовят по точной навеске. Эта соль легко получается в чистом виде, хорошо растворяется в воде, ее растворы устойчивы при хранении.
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 299; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.15.1 (0.006 с.) |




 ML + L «ML2
ML + L «ML2