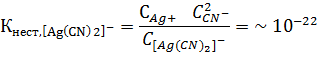Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Устойчивость комплексных соединений. Константа нестойкости.
При растворении в воде комплексные соединения обычно распадаются так, что внутренняя сфера ведет себя как единое целое: K[Ag(CN)2] Наряду с этим процессом хоть и вне значительной степени, проиходит диссоциация внутренней сферы комплекса: [Ag(CN)2]- Применив к последнему равновесию выражение константы ионизации, получим соотношение, называемое константой нестойкость комплекса:
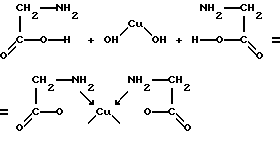
Константа нестойкости есть мера прочности комплекса. Вместо константы нестойкости иногда пользуются обратной величиной, называемой константой устойчивости: У ряда соединений, которые рассматриваются как комплексные, константы нестойкости настолько велики, что концентрации составляющих частиц оказываются больше концентрации комплексного иона. К таким соединениям относятся двойные соли, которые в твердом состоянии имеют координационную структуру, а в растворе в значительной мере распадаются на составные ионы, например: K2[CuCl4] В умеренно разбавленных растворах этой соли существуют как комплексные, так и простые ионы. Дальнейшее разбавление приводит к полному распаду комплексных ионов [CuCl4]2- . Хелаты. Хелатный эффект К очень важным циклическим соединениям относят так называемые хелаты или клешнеобразные соединения, в которых центральный атом и полидентантный лиганд образуют цикл. Например, при взаимодействии гидроксида меди с аминоуксусной кислотой образуется нейтральный комплекс:
Каждая молекула аминоуксусной кислоты использует обе функциональные группы. В одном случае она соединяется с центральным атомом через две аминогруппы по донорно-акцепторному механизму, а во втором – через кислород карбоксильной группы обычной ковалентной связью. Комплексообразователь при этом оказывается как бы втянутым внутрь лиганда, охвачен связями наподобие клешни рака. Отсюда и происходит название хелат. Примерами других хелатов могут служить комплексы с этилендиамином NH2-C2H4-NH2, этилендиаминтетрауксусной кислотой (ЭДТА), щавелевой кислотой. К хелатам также относятся такие важные для жизни соединения, как хлорофилл и гемоглобин:
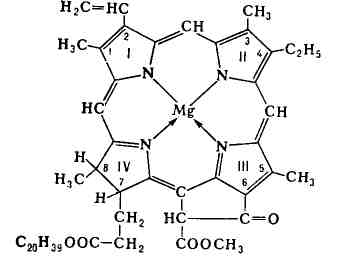
Комплексообразователем в хлорофилле выступает магний, а в гемоглобине – железо. В одной плоскости с металлом располагаются четыре атома азота органического лиганда. По другую сторону от плоскости железо присоединяем молекулу белка(глобина), а по другую молекулу кислорода. Такой продукт называется оксигемоглобином. Он образуется в легких, где гемоглобин присоединяет кислород воздуха и далее в виде оксигемоглобани разносится по всему организму. Хлорофилл играет важнейшую роль в процессах фотосинтеза, протекающих во всех зеленых растениях.
Наличие в хелатах циклических группировок сильно увеличивает их устойчивость по сравнению с соединениями подобного состава, но не имеющими циклов. Такое повышение устойчивости называют хелатным эффектом. Этот термин был введен Г.Шварценбахом в 1952 году для пояснения экспериментально обнаруженного факта существенно более высокой устойчивости комплексов ионов металлов с полидентатными реагентами по сравнению с комплексами этих же металлов с монодентатными лигандами. Хелатный эффект (ХЭ) количественно выражается следующим соотношением: ХЭ = lg βMZ - lgβMAm, где Z – m-дентатный лиганд, а lgβMAm = lgKMA1 + lgKMA2 + … +lgKMAn Хелатный эффект – это разность между логарифмами константы устойчивости хелатного комплекса и общей константой устойчивости комплекса, образованного этим же ионом металла с соответствующим монофункциональным лигандом. Г.Шварценбах предложил так называемое энтропийное толкование хелатного эффекта. Из общих физико-химических соображений ΔGo = -RTlnK =ΔHo – TΔSo. Шварценбах считал, что высокая устойчивость хелатов с полидентатными лигандами связана с увеличением энтропийного вклада в свободную энергию образования комплекса. Для комплексов с монодентатными лигандами реакцию образования можно записать следующим образом: M(H2O)6 + 6 NH3 = M(NH3)6 + 6 H2O, тогда как для полидентатных лигандов процесс пойдет несколько иначе: M(H2O)6 + Y = MY + 6 H2O. В соответствии с этими уравнениями при комплексообразовании с монодентатными лигандами общее число свободно колеблющихся частиц в растворе не изменяется, а в случае полидентатных – увеличивается, что приводит к увеличению энтропии системы.
|
|||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 346; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.96.146 (0.005 с.) |
 K++[Ag(CN)2]-
K++[Ag(CN)2]-