Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетический баланс процесса
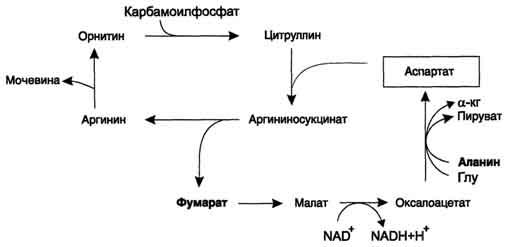
В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул
Рис. 9-17. Цикл регенерации аспартата, сопряжённый с орнитиновым циклом. АТФ на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину имеет пути компенсации энергозатрат: · при включении фумарата в ЦТК на стадии дегидрирования малата образуется NADH, который обеспечивает синтез 3 молекул АТФ (рис. 9-18); · при окислительном дезаминировании глу-тамата в разных органах также образуется NADH, соответственно - ещё 3 молекулы АТФ. Затраты энергии происходят также и при трансмембранном переносе веществ, связанном с синтезом и экскрецией мочевины (рис. 9-18). Первые две реакции орнитинового цикла происходят в митохондриях, а последующие три - в цитозоле. Цитруллин, образующийся в митохондрии, должен быть перенесён в цитозоль, а орнитин, образующийся в цитозоле, необходимо транспортировать в митохондрию. Кроме того, в почках перенос мочевины из крови в мочу происходит путём активного транспорта за счёт градиента ионов натрия, создаваемого К+,Nа+-АТФ-азой, что тоже сопряжено с энергозатратами. Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются не только в печени, но и в других клетках. В энтероцитах, например, имеется карбамоилфосфат-синтетаза I и орнитинкарбамоилтрансфераза, следовательно, может синтезироваться цитруллин. В почках обнаружены аргининосукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени. 3. Биологическая роль орнитинового цикла Орнитиновый цикл в печени выполняет 2 функции: · превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака; · синтез аргинина и пополнение его фонда в организме. Регуляторные стадии процесса - синтез карбамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменениях количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния, характеризующиеся интенсивным распадом белков
Рис. 9-18. Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины. тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла. При избыточном белковом питании количество ферментов орнитинового цикла в печени увеличивается, что приводит к интенсификации синтеза мочевины. №21. Гипераммониемии. Виды. Причины. Симптомы протекания заболевания. Метод Гипераммониемия - это наследственное заболевание обмена веществ, проявляющееся в недостаточности цикла ферментов мочевины, приводящее к отравлению организма аммиаком.
Симптомы Гипераммониемии: Транзиторной гипераммониемией называется также пограничное состояние, присущее новорожденным детям в период адаптации к внеутробной жизни, проявляющееся обычно на вторые – трети сутки жизни. Этот вид гипераммониемии встречается чаще всего у недоношенных детей с задержкой внутриутробного развития, с частотой до пятидесяти процентов рождений, однако иногда регистрируется и у доношенных малышей. Часть детей не проявляет симптоматики клинической картины гипераммониемии: признаки угнетения центральной нервной системы (вялость, понижение мышечного тонуса, приступы апноэ, ослабленная реакция зрачков на свет, отказ от еды, ступор и кома), а также расстройства дыхательной функции, желтуха,судороги и обезвоживание. Причиной вызывающей гипераммониемию называют кислородное голодание, или гипоксию, во время беременности и в процессе родов.
Приобретенные формы Приобретенная (вторичные) гипераммониемия развивается вследствие заболеваний печени и вирусных инфекций. В крайне тяжелых случаях она проявляется как тошнота, рвота, судороги, нечленораздельная речь, затуманивание зрения, тремор, нарушение координации движений. Наследственные формы гипераммониемии вызваны генетическим дефектом любого из пяти ферментов синтеза мочевины. Соответственно ферменту заболевание делится на пять типов. Первичными признаками гипераммониемий являются сонливость, отказ от пищи, рвота, беспокойство, судороги, нарушение координации движений, тахипноэ, дыхательный алкалоз. Могут развиться печеночная недостаточность, легочные и внутричерепные кровоизлияния. Наиболее частой является гипераммониемия типа II, связанная с недостатком орнитин-карбамоилтрансферазы. Заболевание рецессивно, сцеплено с Х-хромосомой. У матери также наблюдается гипераммониемия и отвращение к белковым продуктам. При полном дефекте фермента наследственные гипераммониемии имеют раннее начало (в период до 48 часов после рождения). Лабораторным критерием заболевания является накопление глутамина (в 20 и более раз) и аммиака в крови, ликворе и моче. Основа лечения гипераммониемий сводится к ограничению белка в диете, уже это позволяет предотвратить многие нарушения мозговой деятельности. Причины Гипераммониемии: Токсичность аммиака обусловлена следующими обстоятельствами: 1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток. 2. Ионы аммония NH4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток. 3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+. 4. Продукт связывания аммиака с глутаминовой кислотой – глутамин – является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть. 5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ-аминомасляной кислоты (ГАМК), тормозного медиатора нервной системы Гипераммониемия Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла (табл. 9-4).
В литературе описаны случаи всех этих довольно редких энзимопатий, среди которых отмечено больше всего случаев гипераммониемии II типа. Нарушение орнитинового цикла наблюдается при гепатитах различной этиологии и некоторых других вирусных заболеваниях. Например, установлено, что вирусы гриппа и других острых респираторных вирусных инфекций снижают активность карбамоилфосфатсинтетазы I. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию. Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Так, при дефекте аргининосук-цинатсинтетазы повышается содержание цитруллина (цитруллинемия); при дефекте аргиназы - концентрация аргинина, аргининосукцината, цитруллина и т.д. При гипераммониемиях I и II типа вследствие дефекта орнитинкарбамоилтрансферазы происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Содержание всех метаболитов повышается, и состояние больных ухудшается при увеличении количества белков в пище. Тяжесть течения заболевания зависит также от степени снижения активности ферментов. Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина. Гипераммониемия сопровождается появлением следующих симптомов: · тошнота, повторяющаяся рвота; · головокружение, судороги; · потеря сознания, отёк мозга (в тяжёлых случаях); · отставание умственного развития (при хронической врождённой форме). № 22. Количественного определения мочевины в сыворотке крови. Мочевина сыворотки крови – важнейший продукт азотистого (белкового) обмена, количественное определение которого имеет диагностическое значение для оценки функционального состояния почек. У здорового человека содержание мочевины в сыворотке крови составляет 2,5 – 8,3 ммоль/л. При нарушении экскреторной функции почек уровень мочевины в сыворотке крови повышается. При почечной недостаточности азот мочевины может составлять до 90% фракций остаточного азота. Однако повышение уровня мочевины сыворотки крови может носить и внепочечный характер. В частности, это наблюдается при обезвоживании организма в результате рвоты и поноса, при усиленном распаде белков (острая дистрофия печени, тяжелые соматические заболевания).
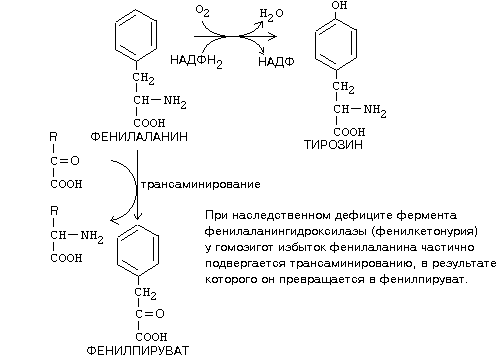
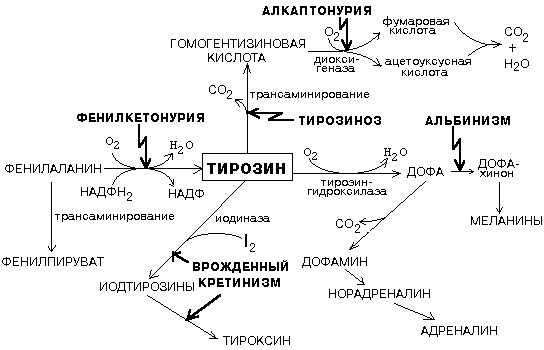
№ 23. Метаболизм фенилаланина и тирозина. Нарушение обмена фенилаланина и тирозина: альбинизм, базедова болезнь, алкаптонурия, фенилкетонурия. Реакция качественного обнаружения фенилпирувата в моче. Фенилаланин является незаменимой аминокислотой, а тирозин - заменимая аминокислота. Фенилаланин вступает в незначительное количество превращений в тканях. Кроме включения этой аминокислоты в структуру молекул белка, единственным путем метаболизма фенилаланина у здорового человека является его окисление в тирозин с участием фермента микросомального окисления, специфической монооксигеназой - фенилаланингидроксилазой:
Тирозин вступает в многочисленные реакции в различных тканях. В результате этих превращений тирозин не только распадается до конечных продуктов, но и дает промежуточные метаболиты, из которых образуются ряд важных соединений, некоторые из которых являются биологически активными веществами. Из тирозина образуются: а) гормоны мозгового слоя надпочечников адреналин и норадреналин, б) меланины - пигменты кожи, волос, радужной оболочки глаза, в) йодсодержащие гормоны щитовидной железы - тироксин и трийодтиронин.
|
||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 331; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.64.126 (0.016 с.) |