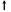Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ориентировочный объем и структура инфузионных сред в зависимости от объема острой массивной акушерской кровопотери
(Барышев Б. а Новиков Б. Н., 2005)
Примечание. ГЭК — гидроксиэтилкрахмал; СЗП — свежезамороженная плазма; * — если нет кровотечения, обусловленного острым ДВС-синдромом; ** — доза содержит не менее 0,55 • 1011 тромбоцитов. — стимуляция сосудисто-тромбоцитарного звена гемостаза (ди-цинон, этамзилат, АТФ); — использование транексамовой кислоты (трансамчи) в дозе 500—750 мг на физиологическом растворе, подавляющей активность плазмина, стабилизирующей коагуляционные факторы и фибрин. Препарат снижает проницаемость сосудов и вызывает выраженный гемостатический эффект, что предотвращает деградацию фибриногена. Выведение больной из критического состояния, связанного с геморрагическим шоком, является первым этапом лечения. В последующие дни продолжается терапия, направленная на ликвидацию последствий массивного кровотечения и на профилактику новых осложнений. В постреанимационном периоде при массивной крово-потере рекомендуется различать 4 стадии (Кулаков В. И., Серов В. Н., Абубакирова А. М. [и др.], 1999):
1-я стадия — период нестабильности функций, который длится 6—10 ч от момента кровотечения и начала терапии. Основными задачами в этот период являются: поддержание системной гемодинамики и адекватного газообмена, коррекция КОС и КОД, ликвидация гипогликемии, восстановление коагуляционного потенциала, глобулярного объема. 2-я стадия — относительная стабилизация основных функций организма, которая наступает через 10—12 ч от начала лечения. Продолжается коррекция гипопротеинемии, электролитных нарушений, глобулярного объема. Проводится нормализация микроциркуляции с использованием дезагрегантов (трентал). Осуществляется профилактика гнойно-септических осложнений антибиотиками широкого спектра действия. С целью профилактики синдрома полиорганной недостаточности привлекаются эфферентные методы терапии: плазмаферез, ультрафиолетовое и лазерное облучение крови. 3-я стадия — ухудшение состояния больных к концу первых или началу вторых суток лечения наступает в случае неэффективности предыдущей терапии. Характерно развитие синдрома полиорганной недостаточности. Для выведения больной из этого тяжелейшего состояния применяют, главным образом, методы экстракорпоральной детоксикации (плазмаферез, гемофильтрация, гемодиафильтрация, гемодиализ). Детоксикация осуществляется на фоне применения ге-патопротекторов, глюкокортикоидов, витаминов С и группы В, антибиотиков и иммуномодуляторов. 4-я стадия характеризуется либо улучшением состояния больной, и при продолжающейся длительной ИТ наступает выздоровление, либо при прогрессировании синдрома полиорганной недоста- точности наступает гибель больной. Летальность при синдроме по-лиорганной недостаточности достигает 80 %. Профилактика. Мероприятия по профилактике геморрагического шока в акушерской практике — это профилактика массивных кровотечений. Они совпадают с теми мерами по предупреждению кровотечений, о которых говорилось в главе «Кровотечения во время беременности поздних сроков, в родах и в послеродовом периоде».
Первый этап профилактических мероприятий проводят врачи женских консультаций и дородовых отделений стационаров. Среди беременных выделяют группу риска по возможным кровотечениям, в которую включают женщин со следующей патологией: —гипоплазия, инфантилизм, пороки развития полового аппарата; —воспалительные процессы гениталий; —аборты и осложненное течение родов в прошлом; —невынашивание и перенашивание беременности; —многоводие, многоплодие, крупный плод; —старший и юный возраст беременной; —сопутствующие заболевания, особенно сердечно-сосудистой системы и печени; —артериальная гипотония; —резус-отрицательная принадлежность крови; —анемия беременных; —множественная миома матки; —гестоз; —хронический ДВС-синдром; —наследственные и врожденные дефекты системы гемостаза (тромбоцитопения, болезнь Виллебранда); — беременные с антифосфолипидным синдромом, длительно — антенатальная гибель плода. Все женщины этой группы, помимо целенаправленного лечения выявленной акушерской и соматической патологии, в конце беременности должны получать витамины группы В, С, Р, АТФ, кальция глюконат, кислородные коктейли или ингаляции кислорода, общее ультрафиолетовое облучение. Им необходимо проводить подготовку мягких родовых путей к родам. Физиопсихопрофилактическая подготовка к родам должна проводиться с особой тщательностью. Второй этап профилактики геморрагического шока заключается в своевременном и правильном родоразрешении. Особое внима-ние необходимо обращать на коррекцию родовой деятельности при слабых, чрезвычайно сильных или дискоординированных схватках. Своевременно предоставлять отдых в родах, не забывать о необхо- димой терапии гестоза, проводить эффективное обезболивание ро-дового акта, все оперативные вмешательства осуществлять при адекватном анестезиологическом пособии. Использовать методы профилактики кровотечений в последовом и раннем послеродовом периодах. Правильно оценивать кровопотерю, в том числе и при операции кесарева сечения, и своевременно восполнять ОЦК. В случаях, где необходимо осуществлять коррекцию коагуляционных свойств крови, адекватно применять ингибиторы протеаз, свежезамороженную плазму, концентрат тромбоцитов. В последние годы с появлением новых технологий возникла возможность предупреждать массивные кровотечения, используя аутоплазмодонорство. Профилактика и оказание помощи женщинам с такой тяжелой патологией как геморрагический шок служит своего рода проверкой правильной организации работы родовспомогательного учреждения. Обеспеченность необходимым набором инфузионных сред, компонентами крови, лекарственными препаратами; готовность инструментария и аппаратуры; квалификация персонала — основные слагаемые успеха проводимой терапии. 5.2. СИНДРОМ ДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГО СВЕРТЫВАНИЯ КРОВИ. ОСТРОЕ ТЕЧЕНИЕ
Диссеминированное внутрисосудистое свертывание крови (ДВС) — приобретенный синдром, наблюдаемый при разнообразной клинической патологии. Согласно современному представлению синдром ДВС характеризуется чрезмерной активацией системы гемостаза, которая приводит к избыточному образованию тромбина (тром-бинемии) и ускоренному внутрисосудистому образованию фибрина с последующей блокадой микроциркуляции в органах-мишенях, с их дисфункцией и дистрофическими изменениями. Если процесс сопровождается вторичной активацией фибринолиза (плазминемия), это вносит определенный вклад в развитие геморрагических проявлений. Если процесс сопровождается ингибицией фибринолиза, это также вносит свой вклад в прогрессирование процесса тромбообразования с нарушением органной функции. Патогенез острого ДВС-синдрома. При подавляющем большинстве форм острого ДВС-синдрома главным инициатором активации свертывания крови является тканевый тромбопластин (внешний путь активации), который может поступить в системный кровоток из поврежденных тканей при акушерской патологии: . эмболии околоплодными водами; . преждевременной отслойке нормально расположенной пла . внутриутробной гибели плода; . атоническом маточном кровотечении; . тяжелых гестозах. При других видах острого ДВС-синдрома инициатором активации системы гемостаза может быть диффузное повреждение эндотелия сосудов, появление в кровотоке избытка фосфолипидов из мембран разрушенных эритроцитов и тромбоцитов, что вызывает контактную активацию тромбоцитарного звена гемостаза и запуск процесса свертывания крови по внутреннему пути через факторы XII и XI. Этот механизм развития острого ДВС имеет место при: . тяжелой бактериальной и вирусной инфекциях; • кризисе микроциркуляции во время шока любой природы (геморрагического, септического, анафилактического, гемотрансфу-зионного); • иммуннокомплексных заболеваниях. Как показали исследования последних лет, усиление образования тромбина обусловлено активацией факторов не только внутреннего пути свертывания крови, но и внешнего, так как поврежденный эндотелий и активированные при указанной патологии моноциты становятся «фабрикой» по производству тромбопластина. Таким образом, in vivo внутренний и внешний пути активации свертывания крови тесно взаимосвязаны и активация одного из них при инициации ДВС-синдрома обязательно сопровождается активацией другого.
Итак, основополагающее событие в генезе острого ДВС-синдрома - это тромбинемия, которая сопровождается накоплением в кровотоке растворимых фибрин-мономерных комплексов, блокирующих систему микроциркуляции. В свою очередь, чрезмерная активация свертывающей системы крови с образованием избытка тромбина характеризуется падением уровня тромбоцитов и факторов свертывания крови, в особенности фибриногена, что объясняется потреблением их в процессе образования тромбов, а также недостаточным восполнением за счет образования. Активация процесса свертывания крови всегда сопровождается активацией противосвертывающих систем с целью ограничения развития тромбинемии. Нейтрализация активированных факторов коагуляции происходит за счет естественных антикоагулянтов, в первую очередь антитромбина III с гепарином (Х11а, XIa, IXa, V1la, Ха и На/тромбин), протеинов С и S (Va и Villa), которые в процессе инактивации потребляются. В свою очередь, потребление ингиби- торов приводит к еще большему образованию активированных субстанций и, таким образом, к истощению запаса антикоагулянтов. Образование фибрина и микротромбов приводит и к активации другой системы защиты — фибринолитической, а именно: к активации плазминогена по внешнему пути (тканевой активатор плазми-ногена/t-PA) и (или) внутреннему пути (ХИа) с образованием плаз-мина. Однако, как показали экспериментальные исследования, во время максимальной активации свертывания при остром ДВС-синдро-ме за фибринолитической реакцией почти немедленно происходит ингибиция фибринолиза в связи с повышением в кровотоке уровня ингибитора активатора плазминогена 1 (PAI-1). Имеются и другие механизмы снижения регуляции эндогенного фибринолиза. Так, фибринолиз может нарушаться за счет появления ингибитора фибринолиза, который активируется тромбином (thrombin-activatab1е fibrinolytic inhibitor, TAFI). Другим антифибринолитическим механизмом является инактивация тромбином урокиназного активатора плазминогена. На первых порах генерализации фибринолиза препятствуют и естественные ингибиторы, в частности, а2-антиплаз-мин. Но запасы ингибиторов, как и естественных антикоагулянтов, быстро истощаются. Они потребляются в процессе нейтрализации плазмина. И чем больше образуется плазмина, тем больше потребляются ингибиторы фибринолиза. Это потребление ингибиторов приводит к неконтролируемой активации (генерализации) фибринолиза, что в конечном итоге разрушает свертывающую систему крови. Образующиеся под воздействием плазмина продукты деградации фибриногена и фибрина переполняют кровоток и вызывают ряд эффектов. Продукты деградации фибрина и фибриногена оказывают воздействие на все звенья гемостаза — сосудистое, тромбоцитарное и коагуляционное. Ранние пептиды (X, Y), высвобождаемые в начале процесса расщепления, обладают вазоактивным действием. Они вызывают нарушение микроциркуляции, транскапиллярного обмена, увеличивают проницаемость сосудов, что приводит к выходу форменных элементов крови и белков плазмы за пределы сосудов. Кроме того, ранние продукты деградации ингибируют полимеризацию фибрин-мономеров, вступая во взаимодействие с ними, благодаря чему нарушается образование функционально полноценного фибрина, а также оказывают выраженное антитромбиновое действие-Поздние ПДФн (DD/E) и ПДФ (D, Е) блокируют рецепторы мембраны тромбоцитов, в результате чего снижается их агрегационная активность и развивается вторичная тромбоцитопатия. Другой при-чиной тромбоцитопатии служит значительная их внутрисосудистая
активация, вследствие чего в кровотоке остаются опустошенные кровяные пластинки, потерявшие в процессе секреции содержимое своих гранул. В развитие тромбоцитопатии вносит свой вклад и сам плазмин, разрушая на тромбоцитарной мембране рецепторы, ответственные за агрегацию тромбоцитов. Снижение числа тромбоцитов, которое имеет место при остром ДВС-синдроме вследствие их потребления, в совокупности с тромбоцитопатией является наиболее частой причиной спонтанных кровотечений из слизистых и множественных кровоизлияний в кожу у больных с этим грозным осложнением. Другой причиной геморрагических проявлений у больных с острым ДВС-синдромом является снижение факторов свертывания крови, которые потребляются в процессе тромбообразования (коа-гулопатия потребления), что в свою очередь усугубляется под действием плазмина, разрушающего не только фибриноген, но и факторы V, VIII, XIII. Характер течения ДВС-синдрома (острое или хроническое) обусловлен скоростью поступления в кровоток субстанций, активирующих гемостаз. Быстрое, лавинообразное поступление этих субстанций определяет развитие острого ДВС-синдрома с угрозой фатальных акушерских кровотечений. Постоянный избыток тромбина в кровотоке с малой скоростью его генерации без существенного потребления факторов свертывания крови характеризует хронический ДВС-синдром с угрозой развития органной недостаточности (тяжелые гестозы). 5.2.1. Сталин и формы острого ЛВС Выделяют три формы острого ДВС-синдрома, каждой из которых соответствует определенная стадия синдрома. Компенсированная форма соответствует I стадии острого ДВС - гиперкоагуляции (изокоагуляции), при которой кровотечения либо нет, либо оно не носит характера коагулопатического, т. е. вытекающая кровь способна к образованию плотных, не лизирую-Щихся сгустков. Кровотечение может быть остановлено хирургическим путем. Субкомпенсированная форма соответствует боле глубокой стадии острого ДВС: коагулопатия потребления без активации фиб-ринолиза (ДВС-И), коагулопатия потребления с активацией вторичного фибринолиза (ДВС-Ш). Для ДВС-И свойственен уже коагулопатический характер крово-течения: - усиление кровотечения из родовых путей, тканей операцион-ного поля; • изливающаяся кровь образует рыхлые, но спонтанно не лизи-рующиеся сгустки; • повышенная кровоточивость мест инъекций. На этапе коагулопатии потребления с активацией вторичного фибринолиза (ДВС-Ш) к коагулопатическому присоединяется ка-пиллярно-гематомный тип кровоточивости: • усиление кровотечения из родовых путей, тканей операционного поля; • кровотечение по дренажам; • изливающаяся кровь образует единичные рыхлые, спонтанно лизирующиеся сгустки; • диффузная кровоточивость тканей операционного поля, слизистых, мест инъекций; • на коже и слизистых оболочках обильная геморрагическая сыпь, местами склонная к слиянию, возможно образование гематом. Некомпенсированная форма — полное несвертывание крови (ДВС-IV) сопровождается: • профузным кровотечением из родовых путей, тканей операционного поля; • по дренажам изливается жидкая кровь; • изливающаяся кровь не образует сгустков; • профузное кровотечение из неповрежденных слизистых носа, верхних дыхательных путей, желудка. Кровоизлияния в жизненно важные органы: головной мозг, надпочечники. Лабораторная диагностика. Лабораторные сдвиги в системе гемостаза при остром ДВС-синдроме быстротечны, буквально в течение нескольких минут могут сменять друг друга. У врача не может быть никакой уверенности, что в момент проведения лечения у больного еще сохраняются те сдвиги в коагулограмме, которые до этого были определены в лаборатории. Поэтому лабораторную диагностику острого ДВС-синдрома следует разделить на два этапа: у постели больного (выполняет лечащий врач), в лабораторий (скрининговые и подтверждающие тесты). Для каждой стадии острого ДВС-синдрома характерны вышеперечисленные лабораторные сдвиги: 1 стадия ДВС — очень кратковременная и быстро преходящая стадия гиперкоагуляции, или компенсированная активация системы гемостаза, в течение которой у больного потребление клеточных и плазменных компонентов не достигает значений, актуальных для гипокоагуляции. Однако клиническая ситуация позволяет преД' положить развитие этого грозного осложнения. При лабораторном исследовании у постели больного (время вертьшания крови по Ли — Уайту, тесту спонтанного лизиса сгустка) и в лаборатории (протромбиновое время, АПТВ, тромбинового времени и число тромбоцитов) показатели обычно в пределах нор-мы. На данной стадии может быть умеренное снижение активности антитромбина III. Именно в этот период у больного уже может быть повышен уровень маркеров тромбинемии: F1 + 2, фибрин-мономер, комплекс тромбин + антитромбин (ТАТ), РКМФ. 2 стадия ДВС — коагулопатия потребления без активации фибринолиза. Для этого периода характерны нормальные показатели времени свертывания крови по Ли — Уайту, теста спонтанного лизиса сгустка и постепенное снижение числа тромбоцитов и факторов свертывания крови, преимущественно фибриногена, более выраженное снижение активности естественных антикоагулянтов и повышение уровня вышеперечисленных маркеров тромбинемии. Показатели обычных скрининговых тестов, таких как протромбиновое время и АПТВ могут быть удлинены или в пределах нормы, что можно объяснить избыточным образованием тромбина. 3 стадия ДВС — коагулопатия потребления с активацией вторичного фибринолиза. Время свертывания крови по Ли — Уайту удлинено, а тест спонтанного лизиса сгустка обнаруживает быстрый лизис свернувшейся крови. На данной стадии наряду с признаками коагулопатии потребления отмечается высокий уровень маркеров тромбинемии и активации фибринолиза (высокий уровень ПДФ, D-димера). Число тромбоцитов и их функции резко снижаются. 4 стадия — полное несвертывание крови. Время свертывания крови по Ли — Уайту и тесты коагулограммы не определяются. Активация фибринолиза (высокий уровень ПДФ, D-димера). Острый ДВС-синдром следует дифференцировать с: • гемодилюционной коагулопатией (табл. 10), которая возникает как следствие нерациональной ИТТ массивного кровотечения; • отрицательным действием на первичный и вторичный гемостаз ряда кровезаменителей (декстранов, ГЭК, инфузионных анти-гипоксантов, перфторана); • гипергепаринемией; • всевозможным их сочетанием. Определение времени свертывания крови по Ли — Уайту. В с ухую мерную центрифужную пробирку путем венепункции самотеком набирают 1 мл крови и по секундомеру отмечают время полного свертывания крови, которое в норме равно 5—12 мин. Тест спонтанного лизиса сгустка. Если при выполнении пре-дыдущего теста свертывание крови наступило, то пробирку помещают в термостат при температуре 37 °С. Уменьшение образовавшегося сгусткa на половину или полный лизис в течение 15—20 мин свиде- Таблица 10 Типы кровотечения и лабораторная экспресс-диагностика острого ДВС-синдрома
Примечание. (*) I — гиперкоагуляция; II — коагулопатия потребления без активации фибринолиза; III — коагулопатия потребления с активацией вторичного фибринолиза; IV — полное несвертывание крови; РКМФ** — растворимые комплексы мономера фибрина; D-димер*** — продукты деградации фибрина; ПДФ**** — продукты деградации фибриногена, фибрина; * — удлинение, снижение; t — увеличение. тельствует о повышенной фибринолитической активности (плазми-на). При значительном снижении концентрации фибриногена или нарушении его биологической активности, а также при наличии антикоагулянтов (гепарина) свертывания крови не происходит. Таким образом, постановка диагноза острого ДВС-синдрома должна строиться на основании: • оценки клинической ситуации (акушерская патология и другие состояния); • оценки прогрессирования клинических проявлений геморрагии; • оценки лабораторной диагностики. Терапия острого ДВС-синдрома. Основными задачами при лечении кровотечений, обусловленных острым ДВС-синдромом, являются (табл. 11): Таблица 11 Лечение острого ДВС-синдрома
Примечание. (*) стадии: I — гиперкоагуляция; II — коагулопатия потребления без активации фибринолиза; III — коагулопатия потребления с активацией вторичного фибринолиза; IV — полное несвертывание крови. • прекращение внутрисосудистого свертывания крови с потреблением прокоагулянтов и тромбоцитов (гепарин); • подавление повышенной фибринолитической активности (естественные ингибиторы протеаз — контрикал, гордокс, тразилол); • замещение дефицита прокоагулянтов, антикоагулянтов (АТ-Ш, протеинов С и S) и плазминогена (свежезамороженная плазма); тромбоцитов (концентрат тромбоцитов); эритроцитов (эрит-роцитсодержащие среды); одновременно эритроцитов, тромбоцитов и плазмы (свежеконсервированная кровь). Использование гепарина требует большой осторожности. Его вводят в/в на 100 мл раствора натрия хлорида 0,9 % или 5 % раствора глюкозы со скоростью 30 кап./мин. Если через 15 мин после начала введения гепарина не происходит усиления кровотечения, введение можно продолжить. Если происходит усиление кровотечения, следует прекратить введение. Гепарин нельзя вводить при Ш—IV стадии ДВС, сочетании ДВС с гемодилюционной коагулопа-тией и при наличии обширных раневых поверхностей. Ингибиторы протеаз (контрикал, гордокс или тразилол) вводят в/в шприцем в III—IV стадии ДВС или через 15 мин после начала ведения гепарина при ДВС-И. Абсолютно противопоказано внут- ривенное введение 5 % раствора е-аминокапроновой кислоты с целью ингибирования вторичной активации фибринолиза в фазе гипокоагуляции. Имеются многочисленные клинические свидетельства ухудшения течения ДВС-синдрома, вследствие генерализованного летального тромбоза. Заместительную терапию (СЗП, тромбоциты и кровь) следует начинать через 15 мин после введения ингибиторов протеаз (максимальный эффект протеаз). Свежезамороженная плазма (СЗП) применяется во II—IV стадиях ДВС, в/в, струйно. Необходимо использовать только плазму, совместимую по системе АВО. Свежезамороженную плазму следует размораживать в течение 20 мин при температуре 37—38 °С. Введение дозы СЗП повышает концентрацию функционально полноценного фибриногена у реципиентки на 0,25 г/л. Минимальная гемо-статическая концентрация функционально полноценного фибриногена составляет 0,8—1,0 г/л. Группа крови и резус-принадлежность переливаемых донорских тромбоцитов и пациентки должны совпадать. Введение 1 дозы тромбоцитов (не менее 0,6 • 1011) на каждые 10 кг массы тела увеличивает число тромбоцитов на 7—9 • 109/л. Консервированную кровь не более 6 ч от момента заготовки следует использовать при сочетании тромбоцитопении (менее 100 • 109/л), анемии и дефицита прокоагулянтов. В качестве консерванта не следует использовать гепарин. С гемостатической целью в рану или в дренаж целесообразно на 20—30 мин вводить смесь, состоящую из е-аминокапроновой кислоты (100—400 мл 5 % раствора), сухого тромбина (125—500 ЕД) и адроксона (1—4 мл) или дицинона (250—500 мг). Эффект достигается лишь после применения ингибиторов протеаз или свежезамороженной плазмы. Местный гемостатик тахокомб, состоящий из коллагеновой пластины, покрытой с одной стороны высококонцентрированными тромбином, фибриногеном и апротинином, надежно склеивает за 5 мин раневую поверхность и коллагеновую пластину, даже при нарушениях биологического гемостаза. Реинфузии у таких больных не показаны. Критерии эффективности консервативной гемостатической терапии. Для окончательной консервативной остановки кровотечения (прекращения кровоточивости, резкого уменьшения кро-вопотери за каждые последующие 15 мин, образования плотных, спонтанно не лизирующихся сгустков, улучшения показателей коагулограммы), обусловленного ДВС-П, требуется 45-60 мин; ДВС-111 — 60—90 мин и ДВС-IV — 90—120 мин. Если по истечении этого времени уже нет клинико-лабораторных данных, подтверждающих коагулопатическое или капиллярно-гематомное кровотечение, но интенсивность его сохраняется, предполагают оставшийся дефект хирургического гемостаза. В течение не менее 2 ч после остановки кровотечения для избежания его рецидива больных не следует перекладывать и транспортировать. Тактика врача при подозрении на кровотечение, обусловленное острым ДВС-синдромом. Кровотечение, обусловленное острым ДВС-синдромом, можно заподозрить при наличии: ситуаций, сопровождающихся массивным поступлением в кровоток тромбопластиноподобных субстанций и (или) повреждением эндотелия сосудистой стенки иммунными комплексами, токсинами патологической микрофлоры и т. п.; кровотечения коагулопатического и (или) капиллярно-гематом-ного типа (см. табл. 11); увеличения времени свертывания крови по Ли — Уайту и наличие положительного теста спонтанного лизиса сгустка, проводимого у постели больного (см. табл. 11); нарушения скрининговых и подтверждающих тестов (см. табл. 11). Кровотечение, обусловленное острым ДВС-синдромом, следует лечить, выполняя следующие правила: 1) строго соблюдать дозы, последовательность, скорость введения и интервалы между началом введения лекарственных средств и компонентов крови; 2) постоянно ориентироваться на клинико-лабораторные критерии эффективности и продолжительности консервативной гемоста-тической терапии; 3) применять коллоиды (гелофузин), не оказывающие прямого отрицательного воздействия на первичный и вторичный гемостаз. 4) воздерживаться от переливания «теплой» донорской крови, заготовленной на гепарине, и реинфузий. В течение не менее 2 ч после остановки кровотечения для избежания его рецидива больных не следует перекладывать и транспортировать. Кровотечение, продолжающееся после медикаментозного устранения клинико-лабораторных данных острого ДВС-синдрома, следует останавливать хирургическим путем. 5.2.2. Коагулопатия потребления без активации фибринолиза (2-я сталия острого АВС-синлрома) Инициаторы развития. Поступление в системный кровоток инициаторов активации системы гемостаза: • тканевого тромбопластина (преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами, атоническое маточное кровотечение, внутриутробная гибель плода); • фосфолипидов из разрушенных форменных элементов крови и эндотелия сосудов (тяжелые бактериальные и вирусные инфекции, кризис микроциркуляции во время шока любой природы и иммуно-комплексных заболеваниях). Клинические признаки. Коагулопатический характер кровотечения: • усиление кровотечения из родовых путей, тканей операционного поля; • изливающаяся кровь образует рыхлые, но спонтанно не лизи-рующиеся сгустки; • повышенная кровоточивость мест инъекций. Нормальные показатели времени свертывания крови по Ли — Уайту (5—12 мин) и теста спонтанного лизиса сгустка. Постепенное снижение числа тромбоцитов (< 120 • 109/л) и факторов свертывания крови, преимущественно фибриногена (< 1,5 г/л). Более выраженное снижение активности естественных антикоагулянтов (AT III) и повышение уровня маркеров тромбинемии (F1 + 2, фибрин-мономер, комплекс тромбин + антитромбин, РКМФ). Гемостатическая терапия. Гепарин 10—30 ЕД/кг массы тела вводят в/в на 100 мл 0,9 % раствора натрия хлорида или 5 % раствора глюкозы со скоростью 30 кап/мин. Если через 15 мин после начала введения гепарина не происходит усиления кровотечения, введение можно продолжить. Если происходит усиление кровотечения, следует прекратить введение. Гепарин нельзя вводить при наличии обширных раневых поверхностей. Ингибиторы протеаз: контрикал 20—60 тыс. АТрЕ или гор-докс 200—600 тыс. Е или тразилол 50—100 тыс. КИЕ вводят в/в, шприцем через 15 мин после начала введения гепарина. Свежезамороженную плазму 10—15 мл/кг массы тела следует переливать через 15 мин после введения ингибиторов протеаз. Она применяется в/в, струйно. Необходимо использовать только плаз- му, совместимую по системе АВО. Ее следует размораживать в течение 20 мин при температуре 37—38 °С. Воздерживаться от переливания крови, заготовленной на гепарине, и реинфузии. Инфузионная терапия. Для лечения гиповолемии применять кровезаменители, не оказывающие прямого отрицательного воздействия на первичный и вторичный гемостаз (гелофузин, изотонические электролитные растворы). Критерии эффективности гемостатической терапии: 1. Через 15 мин после введения ингибиторов протеаз изливающаяся кровь образует уже не рыхлые, а плотные, спонтанно не ли-зирующиеся сгустки. 2. После введения 2 доз СЗП резкое уменьшение или прекращение кровотечения из родовых путей, тканей операционного поля и повышенной кровоточивости мест инъекций. 3. Окончательная остановка кровотечения наблюдается через 45-60 мин от начала введения гепарина. 4. Если по истечении 45—60 мин уже нет клинико-лабораторных данных, подтверждающих острый ДВС-синдром, но интенсивность кровотечения сохраняется, следует предположить дефект хирургического гемостаза.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-20; просмотров: 316; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.26.246 (0.113 с.) |