Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обнаружение синильной кислоты и цианидов
Изолирование синильной кислоты и цианидов из биологического материала производят перегонкой с водяным паром. Для этой цели собирают 3—5 мл первого дистиллята в пробирку, содержащую 2 мл 2 %-го раствора гидроксида натрия. Поскольку синильная кислота быстро разлагается в организме, исследование биологического материала на наличие этой кислоты и ее солей желательно проводить сразу же после вскрытия трупов. При отравлении синильной кислотой и цианидами на химико-токсикологическое исследование берут желудок с содержимым, печень и почки. Ввиду быстрого разложения синильной кислоты и цианидов в тканях организма эти яды можно обнаружить в содержимом желудка и не обнаружить в паренхиматозных органах. При заключении об отравлении синильной кислотой и цианидами (на основании результатов химико-токсикологического анализа биологического материала) следует учитывать то, что цианиды в небольших количествах (около 6 мкг %) могут быть в моче лиц, неподвергавшихся воздействию этих соединений. В моче курящих количество цианидов может быть почти в 3 раза больше, чем в крови некурящих. В крови цианиды могут образовываться и посмертно. Для обнаружения синильной кислоты в дистиллятах применяют несколько реакций, из которых наиболее доказательной является реакция образования берлинской лазури. Другие описанные ниже реакции используют как вспомогательные, а также для обнаружения цианидов в порошках, жидкостях и в других объектах. Реакции на синильную кислоту и ее соли выполняют под тягой. Реакция образования берлинской лазури. От прибавления сульфата железа (II) к щелочному раствору цианидов, образуется цианид железа (II), который при взаимодействии с избытком цианидов, а затем с сульфатом или хлоридом железа (III) образует берлинскую лазурь:
При образовании берлинской лазури происходят и побочные реакции между солями железа и щелочью (образуются гидро-ксиды железа). Для растворения гидроксидов железа и нейтрализации избытка щелочи прибавляют кислоту до кислой реакции. Большой избыток прибавленной кислоты может замедлить процесс образования берлинской лазури. Выполнение реакции. К нескольким миллилитрам дистиллята, собранного в раствор щелочи, прибавляют 1—4 капли разбавленного раствора сульфата железа (II) и такой же объем разбавленного раствора хлорида железа (III). Смесь хорошо взбалтывают и нагревают на пламени газовой горелки почти до кипе-
ния, а затем охлаждают до комнатной температуры и прибавляют 10 %-й раствор соляной кислоты до слабокислой реакции на лакмус. Появление синего осадка или синей окраски указывает на наличие синильной кислоты (цианидов) в дистилляте. Предел обнаружения: 20 мкг синильной кислоты в 1 мл раствора. Предельная концентрация 1: 100000. При количествах синильной кислоты, превышающих 30 мкг в 1 мл, образуется синий осадок. При наличии 20—30 мкг синильной кислоты в 1 мл появляется зеленая или голубоватая окраска. При малых количествах синильной кислоты в растворах синяя окраска появляется только через 24—48 ч. При длительном отсутствии синего осадка или синей окраски к смеси прибавляют 5 %-ый раствор хлорида бария. При этом выпадает осадок сульфата бария и происходит соосаждение берлинской лазури. Осадок берлинской лазури может быть представлен судебно-следственным органам как доказательство наличия синильной кислоты или цианидов в исследуемых объектах. Реакция образования роданида железа. Эта реакция основана на том, что при нагревании цианидов с раствором полисульфида аммония образуется роданид, от прибавления к которому раствора хлорида железа (Ш) появляется кроваво-красная окраска:
Выполнение реакции. К 2—3 мл исследуемого раствора прибавляют 3—5 капель 10—20 %-го раствора полисульфида аммония и смесь упаривают на водяной бане до небольшого объема. К упаренной жидкости по каплям прибавляют 8 %-й раствор соляной кислоты до кислой реакции (по лакмусу), а затем прибавляют 1 каплю 10 %-го раствора хлорида железа (III). Появление кроваво-красной окраски указывает на наличие цианидов в растворе. При взбалтывании окрашенного раствора с диэтило-вым эфиром окраска переходит в эфирный слой. Предел обнаружения: 10 мкг синильной кислоты в 1 мл. Реакция образования бензидиновой сини. Соли меди (II) с цианидами образуют дициан (CN) 2, при взаимодействии которого с водой выделяется кислород, окисляющий бензидин. Продуктом окисления бензидина является бензидиновая синь:
Выполнение реакции. Для выполнения этой реакции пользуются индикаторной бумагой, смоченной смесью растворов ацетата меди и бензидина. В колбу вносят 2—3 мл исследуемого раствора, к которому прибавляют 1 мл 10 %-го раствора винной кислоты. Колбу сразу же закрывают пробкой, к которой прикреплена влажная индикаторная бумага. Затем колбу нагревают несколько минут на водяной бане. При наличии синильной кислоты или ее солей в пробе бумага синеет. Приготовление индикаторной бумаги (см. Приложение 1, реактив 6). Реакция с пикриновой кислотой. От прибавления пикриновой кислоты и щелочи к цианидам образуется соль изопурпуровой кислоты, имеющая красную окраску:
Выполнение реакции. К 1 мл щелочного дистиллята прибавляют 1 мл 0,5 %-го раствора пикриновой кислоты и слегка нагревают на водяной бане. При наличии цианидов раствор приобретает красную окраску. Подобную окраску с пикриновой кислотой дают и некоторые другие вещества (альдегиды, ацетон, сульфиты и др.). Поэтому реакция с пикриновой кислотой на цианиды имеет значение только при отсутствии цианидов в дистилляте. Обнаружение цианидов методом микродиффузии. Синильную кислоту и ее соли можно обнаружить методом микродиффузии, который основан на реакции с пиридином и барбитуровой кислотой. Способ обнаружения цианидов методом микродиффузии описан выше (см. гл. III, § 3). ФОРМАЛЬДЕГИД Формальдегид (альдегид муравьиной кислоты)—газ, хорошо растворимый в воде, обладающий острым специфическим запахом. Водный раствор, содержащий 36,5—37,5 % формальдегида, называется формалином. Формальдегид образуется при неполном сгорании метана, при окислении метилового спирта и т. д. Газообразный формальдегид при комнатной температуре легко полимеризуется с образованием параформальдегида. Известно несколько продуктов полимеризации газообразного формальдегида. Один из полимеров формальдегида называется триоксиметилен (СН 2 О) 3. Он имеет температуру плавления 63—64°С. В водных растворах также образуется параформальдегид, относящийся к полиоксиметиленам, которые являются продуктами полимеризации значительно большего числа молекул формальдегида. ПараформаЛьдегид при нагревании, особенно в присутствии кислот, частично деполимеризуется с образованием газообразного формальдегида. Формальдегид изолируют из биологического материала путем перегонки с водяным паром. Однако этим методом перегоняется только незначительная часть формальдегида. Считают, что формальдегид в водных растворах находится в виде гидрата (метиленгликоля), который трудно отгоняется с водяным паром: НСНО + НОН ---> СН 2 (ОН) 2. Применение. Действие на организм. Формальдегид широко используется в промышленности для получения пластических масс и фенолоформальдегидных смол, дубления кож, консервирования анатомических препаратов, получения гексаметилентетра-мина, синтетического каучука, протравливания зерна, обработки помещений, тары с целью дезинфекции. Формальдегид проявляет дубящее, антисептическое и дезодорирующее действие., При вдыхании небольших количеств формальдегида он раздражает верхние дыхательные пути. При вдыхании больших концентраций формальдегида может наступить внезапная смерть в результате отека и спазма голосовой щели. При попадании формальдегида в организм через рот могут наступить некротические поражения слизистой оболочки рта, пищевого канала, появляется слюнотечение, тошнота, рвота, понос. Формальдегид угнетает центральную нервную систему, в результате этого может произойти потеря сознания, появляются судороги. Под влиянием формальдегида развиваются дегенеративные поражения печени, почек, сердца и головного мозга. Формальдегид оказывает влияние на некоторые ферменты. 60—90 мл формалина являются смертельной дозой.
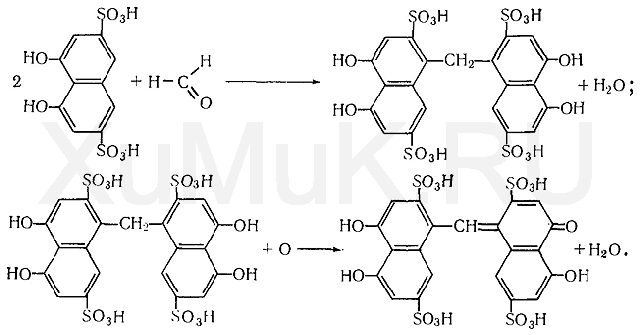
Метаболизм. Метаболитами формальдегида являются метиловый спирт и муравьиная кислота, которые, в свою очередь, подвергаются дальнейшему метаболизму. Обнаружение формальдегида В химико-токсикологическом анализе для обнаружения формальдегида Η—СНО применяют реакции с хромотроповой кислотой, фуксинсернистой кислотой, с раствором кодеина в серной кислоте, с резорцином и др. Реакция с хромотроповой кислотой. Хромотроповая кислота (1,8-диоксинафталин-3,6-дисульфокислота) с формальдегидом в присутствии серной кислоты дает фиолетовую окраску. При взаимодействии формальдегида с хромотроповой кислотой концентрированная серная кислота одновременно является водо- отнимающим средством и окислителем. Вначале серная кислота вызывает конденсацию формальдегида с хромотроповой кислотой, а затем окисляет образовавшийся продукт конденсации:
Для успешного протекания указанной выше реакции требуется серная кислота, концентрация которой должна быть не ниже 72 %. Выполнение реакции. В пробирку вносят 3—5 капель исследуемого раствора или дистиллята, 4 мл 12 н. раствора серной кислоты и несколько кристалликов хромотроповой кислоты, а затем пробирку нагревают в течение 10 мин на водяной бане до 60 °С. При наличии формальдегида в пробе появляется фиолетовая окраска. Второй вариант реакции. В пробирку вносят 1 мл исследуемого раствора, 0,2 мл 1 %-го раствора хромотроповой кислоты в концентрированной серной кислоте, а затем прибавляют 5 мл концентрированной серной кислоты и взбалтывают. Появление фиолетовой или красно-фиолетовой окраски указывает на наличие формальдегида в исследуемом растворе. Предел обнаружения: 1 мкг формальдегида в пробе. Не дают этой реакции альдегиды уксусной, пропионовой и масляной кислот, хлоралгидрат и др. Эту реакцию дают вещества, которые при гидролизе, дегидратации или окислении образуют формальдегид.
Реакция с фуксинсернистой кислотой. Фуксинсернистая кислота (реактив Шиффа) с формальдегидом дает синюю или сине-фиолетовую окраску. Для приготовления фуксинсернистой кислоты берут раствор парафуксина (I), имеющий красную окраску, прибавляют водный раствор оксида серы (IV) или пропускают газообразный SO 2. При этом образуется фуксинсернистая кислота (II), не имеющая окраски. Эта кислота с альдегидами образует хиноидный краситель (III) розового цвета:
Выполнение реакции. В пробирку вносят 1 мл исследуемого раствора и 2—3 капли концентрированной серной кислоты. Содержимое пробирки взбалтывают и охлаждают проточной водой, затем прибавляют 1 мл раствора фуксинсернистой кислоты. Появление сине-фиолетовой или красно-фиолетовой окраски указывает на наличие формальдегида. Раствор иногда окрашивается не сразу, а через 10—15 мин. Окраска может появляться не только под влиянием формальдегида, но и под влиянием окислителей (хлор, оксиды азота, кислород воздуха и др.). Поэтому появление окраски через 30 мин после прибавления реактивов не должно рассматриваться как положительный результат реакции на формальдегид. Эта реакция не специфична для обнаружения формальдегида. Ее дают ацетальдегид, нитробензальдегид и др. Не дает указанной окраски хлоралгидрат. В сильно кислой среде (рН = 0,7) с фуксинсернистой кислотой реагирует только формальдегид. При рН >= 2,7 с фуксинсернистой кислотой реагирует ацетальдегид, фурфурол и др. Приготовление реактива (см. Приложение 1, реактив 56). Реакция с метиловым фиолетовым. Метиловый фиолетовый, который аналогично фуксину предварительно обесцвечен сульфитом натрия, с формальдегидом дает сине-фиолетовую окраску. Выполнение реакции. В пробирку вносят 1 мл исследуемого раствора и 0,5 мл 10 %-го раствора серной кислоты, а затем прибавляют такой же объем раствора метилового фиолетового, обесцвеченного сульфитом или гидросульфитом натрия. При наличии формальдегида в пробе появляется сине-фиолетовая окраска. Эта реакция не специфична для обнаружения формальдегида. Ее дают и некоторые другие альдегиды. Приготовление реактива (см. Приложение 1, реактив 21). Реакция с кодеином и серной кислотой. При нагревании формальдегида с кодеином в присутствии концентрированной серной кислоты появляется синяя окраска. Эта реакция основана на том, что под влиянием концентрированной серной кислоты от кодеина отщепляется метоксильная группа, в результате чего образуется морфин, содержащий фенольную группу. При взаимодействии морфина с формальдегидом появляется синяя окраска. Выполнение реакции. В фарфоровую чашку вносят 1 мл исследуемого раствора и прибавляют 5 мл концентрированной серной кислоты. После охлаждения жидкости прибавляют 0,02— 0,03 г кодеина. При наличии формальдегида сразу или через 5—10 мин появляется сине-фиолетовая или красно-фиолетовая окраска.
Предел обнаружения: 0,02 мкг формальдегида. Реакция с резорцином. Альдегиды реагируют с резорцином в его таутомерной форме (кетоформе) с образованием окрашенного соединения:
Выполнение реакции. В пробирку вносят 1 мл исследуемого раствора и 1 мл 1 %-го раствора резорцина в 10 %-м растворе гидроксида натрия. Смесь нагревают в течение 3—5 мин на водяной бане. Появление розовой или малиновой окраски указывает на наличие формальдегида. Эту реакцию дают уксусный альдегид, акролеин, фурфурол и др. Реакция восстановления ионов серебра. Из аммиачного раствора солей серебра формальдегид выделяет металлическое серебро:
Выполнение реакции. В хорошо очищенную от жира пробирку вносят 5 капель 1 %-го раствора нитрата серебра и по каплям прибавляют 10%-й раствор аммиака до растворения образовавшегося осадка гидроксида серебра. К полученному раствору прибавляют 1 мл исследуемого раствора, а затем смесь осторожно нагревают на пламени горелки. При наличии формальдегида происходит реакция образования «серебряного зеркала». Эта реакция успешно протекает при рН = 8...9. Нагревание пробирки должно быть умеренным. При высокой температуре «серебряное зеркало» не образуется, а выпадает бурый осадок серебра. Кроме формальдегида эту реакцию дают и некоторые другие восстанавливающие вещества. Реакция с реактивом Фелинга. При нагревании реактива Фелинга с формальдегидом выпадает осадок оксида или гидроксида меди. Оксид меди (I) имеет черную окраску. Окраска гидроксида меди (I) зависит от размера частиц. Очень мелкие частицы имеют голубовато-зеленую окраску, а крупные — красную. Поэтому при взаимодействии реактива Фелинга с восстановителями в большинстве случаев выпадает желтый или красный осадок. В реактиве Фелинга, который представляет собой смесь сульфата меди, щелочи и сегнетовой соли, медь входит в состав комплексного иона:
Выполнение реакции. 1 мл исследуемого раствора вносят в пробирку, в которую прибавляют 1—2 капли 10 %-го раствора гидроксида натрия до щелочной реакции (по лакмусу), а затем прибавляют 2—3 капли реактива Фелинга. Жидкость интенсивно взбалтывают и нагревают на пламени газовой горелки. Образование желтого или красного осадка указывает на наличие формальдегида в исследуемом растворе. Эта реакция не специфична. Кроме формальдегида ее дают и другие альдегиды алифатического ряда, восстанавливающие сахара и др. Приготовление реактива (см. Приложение 1, реактив 42). Обнаружение формальдегида методом микродиффузии. Для обнаружения формальдегида в тканях, крови и моче используется метод микродиффузии, основанный на реакции с хромотроповой кислотой (см. гл. III, § 3). МЕТИЛОВЫЙ СПИРТ Метиловый спирт (метанол) — бесцветная жидкость (т. кип. 64,5 °С, плотность 0,79), смешивающаяся во всех соотношениях с водой и многими органическими растворителями. Метиловый спирт ядовит, он горит бледно-голубым некоптящим пламенем, с хлоридом кальция дает соединение СаС1 2 ·4СН 3 ОН, а с оксидом бария образует кристаллы ВаО·2СН 3 ОН. Метиловый спирт по запаху и вкусу почти не отличается от этилового. Известны случаи отравления метиловым спиртом, ошибочно принятым вместо этилового. В природе метиловый спирт в свободном состоянии почти не встречается. Распространены его производные — эфирные масла, сложные эфиры и др. Раньше метиловый спирт получали путем сухой перегонки дерева. Поэтому и до сих пор неочищенный метиловый спирт, полученный сухой перегонкой дерева, называют древесным спиртом. В настоящее время используется несколько промышленных синтетических способов получения метилового спирта. Применение. Действие на организм. Метиловый спирт широко используется в промышленности как растворитель лаков, красок, как исходное вещество для получения хлористого метила, диметилсульфата, формальдегида и ряда других химических соединений. Он применяется для денатурации этилового спирта, входит в состав антифриза. Метиловый спирт может поступать в организм через пищевой канал, а также с вдыхаемым воздухом, содержащим пары этого спирта. В незначительных количествах метиловый спирт может проникать в организм и через кожу. Токсичность метилового спирта зависит от обстоятельств отравления и индивидуальной восприимчивости. Под влиянием метилового спирта происходит поражение сетчатки глаза и зрительного нерва, а иногда наступает неизлечимая слепота. Появление слепоты ряд авторов объясняют не действием метилового спирта, а действием его метаболитов (формальдегида и муравьиной кислоты). Метиловый спирт нарушает окислительные процессы и кислотно-щелочное равновесие в клетках и тканях. В результате этого наступает ацидоз. Отравление метиловым спиртом в ряде случаев заканчивается смертью. Опасность появления слепоты возникает уже после приема 4—15 мл метилового спирта. Смертельная доза принятого внутрь метилового спирта составляет 30—100 мл. Смерть наступает в результате остановки дыхания, отека головного мозга и легких, коллапса или уремии. Местное действие метилового спирта на слизистые оболочки проявляется сильнее, а наркотическое действие — слабее, чем у этилового спирта. Одновременное поступление метилового и этилового спиртов в организм уменьшает токсичность метилового спирта. Это объясняется тем, что этиловый спирт уменьшает скорость окисления метилового спирта почти на 50 %, а следовательно, и уменьшает его токсичность. Метаболизм. Метиловый спирт, поступивший в организм, распределяется между органами и тканями. Наибольшее количество его накапливается в печени, а затем в почках. Меньшие количества этого спирта накапливаются в мышцах, жире и головном мозгу. Метаболитом метилового спирта является формальдегид, который окисляется до муравьиной кислоты. Часть этой кислоты разлагается на оксид углерода (IV) и воду. Некоторое количество метилового спирта, не подвергшегося метаболизму, выделяется с выдыхаемым воздухом. Он может выделяться с мочой в виде глюкуронида. Однако с мочой могут выделяться и небольшие количества неизмененного метилового спирта. Метиловый спирт окисляется в организме медленнее, чем этиловый спирт. При заключении об отравлении метиловым спиртом следует иметь в виду, что в организме (в норме) может содержаться 0,01—0,3 мг % метилового спирта и около 0,4 мг % муравьиной кислоты.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-23; просмотров: 2266; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.115.195 (0.044 с.) |