
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первое начало термодинамики. Адиабатный процесс ⇐ ПредыдущаяСтр 4 из 4
Уравнение Менделеева–Клайперона описывает зависимость функций состояния идеального газа, но не дает ответа о причине совершения газом работы. Из закона сохранения энергии можно заключить, что теплота, подводимая к газу, идет на совершение работы и на изменение его внутренней энергией. Под внутренней энергией идеального газа понимают кинетическую энергию движения молекул. Первое начало термодинамики записывается следующим образом:
где Q – количество теплоты; U – внутренняя энергия; A – работа, совершаемая газом. Следует отметить, что при изотермическом процессе внутренняя энергия остается постоянной и приращение ее равно нулю, при изохорном процессе все тепло идет во внутреннюю энергию, и только при изобарном процессе тепло идет и на изменение внутренней энергии и в работу, поэтому изобарный процесс из всех изопроцессов наиболее теплосодержательный. Для изопроцессов первое начал термодинамики в дифференциальном виде запишется:
Как известно, теплоемкостью тела называется величина, равная количеству теплоты, необходимого на нагревания единицы содержания тела на единицу температуры. Исходя из определения теплоемкости можно вводить три величины теплоемкости: удельная (на единицу массы), объемная (на единицу объема тела) и молярную (на количество вещества в молях):
Объемная теплоемкость применяется в теплотехнике, где используются постоянные объемы теплоносителей (ядерные реакторы и т.д.). В термодинамике газов используется молярная теплоемкость. Как видно из (63) и (64) при изохорном процессе:
где cV – теплоемкость при постоянным объеме. Если подставить в первое начало термодинамики уравнение состояния в полных дифференциалах:
с наложением условия изобарности:
и вычислить молярную теплоемкость при постоянном давлении по определению, получим закон Майера:
Для теоретического вычисления теплоемкости рассмотрим все варианты движения одной молекулы, которые называют степенями свободы молекулы. Во-первых, любая молекула может двигаться поступательно, летая по всем трем координатным направлениям. Во-вторых, для молекулы многоатомного газа разрешено вращательное движение, и в-последних, для молекул, с слабыми химическими связями возможны колебательные движения атомов.
Каждый из вариантов движения равновероятно осуществим с точки зрения затрат энергии. Поэтому внутренняя энергия одной молекулы, после подстановки в закон Больцмана:
где
Молекула одноатомного идеального газа может иметь только три поступательных степени свободы (i =3). Вращательных степеней свободы молекула одноатомного газа в рамках теории теплоемкости иметь не может, поскольку молекулы считаем материальными точками, а точка вращаться не может. Молекула двухатомного идеального газа может быть описана тремя моделями: модель жесткой гантели, модель пружинно-поршневой гантели и модель из двух атомах на пружинке. В модели жесткой гантели атомы расположены на жестком абсолютно несжимаемом стержне. Такая молекула имеет, кроме трех поступательных, ее две вращательных степени свободы (i=5). В модели пружинно-поршневой гантели атомы расположены на упругом стержне и могут совершать колебания в одном направлении (i=7). В модели двух атомов на пружинке молекула имеет три поступательных и вращательных степеней свободы и одну колебательную (i=8). Поэтому от выбора вида модели будет зависеть конкретный расчет теплоемкости. Ранее рассмотренные изопроцессы дают в правой части уравнения первого начала термодинамики постоянные или равные нулю значения внутренней энергии или работы газа. Остался один процесс, совершаемый над идеальным газом, при котором к газу подводится постоянное количество теплоты или не подводится вообще. В первом случае (Q = const) процесс называют политропным, во втором (Q =0) – адиабатным. Остановимся на адиабатном процессе подробно. При адиабатном процессе, газ совершает работу за счет изменения внутренней энергии:
где T 2 и T 1 – температуры начала и конца процесса.
Адиабатный процесс на практике не осуществим, но многие быстрые процессы можно считать близкими к адиабатному. Например, быстрое выпускание газа из баллона, взрыв бомбы, распространение звука в газе, конец такта сжатия поршневого насоса при накачке шин и т.д. Для вывода уравнения адиабаты в первое начало термодинамики в дифференциальном виде (62) подставим уравнение Менделеева–Клайперона в полных дифференциалах (67) и работу газа (54):
Далее, после приведения к объему знаменателю и приведению подобных слагаемых:
Подстановкой в (72) закона Майера и делением обеих частей уравнения на произведение давления на объем, всегда при положительной температуре отличного от нуля, получаем уравнение адиабаты в дифференциальном виде:
Интегрируя дифференциальное уравнение (73) получаем уравнение адиабаты:
Отношение теплоемкости при изобарном процессе к теплоемкости при изохорном процессе называют показателем адиабаты:
Константы в уравнениях (74) и (75) разные, соотношения между ними можно получить проведя указанную подстановку уравнения состояния в уравнение (74). Произведя деление уравнений (74) на (75) в произвольной последовательности можно получить уравнение адиабаты по двум точкам параметров состояния идеального газа:
Аналогично получается работа, совершаемая газом, при адиабатном процессе:
Обобщением рассмотренного выше адиабатного процесса, являетсся политропный процесс, описываемый аналогично адиабатному, уравнением адиабаты с точностью до решения уравнения (72) и первого начала термодинамики до константы:
где χ – безразмерная величина, показатель политропы. Всем ранее изученным процессам, соответствуют разные показатели политропы: при χ=0 имеем изобарный процесс; при χ=1 – изотермический процесс; при χ=γ – адиабатический процесс и при Вычислим молярную теплоемкость c при политропным процессом. Перепишем первое начало термодинамики из определения молярной теплоемкости и работы, совершаемой газом:
Соотношение между температурой газа и его объемом приполитропном процессе найдем из уравнения (78) и уравнения Менделеева–Клайперона:
дифференцирую его, получаем:
Подстановка последнего выражения в (79) и уравнения состояния имеем:
Для изопроцессов из формулы (80) следует: 1. для изотермического процесса ( 2. для изобарного процесса ( 3. для изохорного процесса ( 4. для адиабатного процесса ( Работа, совершаемая идеальным газом, при политропном процессе:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 707; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.116.20 (0.008 с.) |
 ,
,
 .
.
 .
.
 ,
,
 ,
,
 .
.
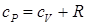 .
.
 .
.
 – число степеней свободы, равное сумме поступательных (iП), колебательных (iК) и удвоенных вращательных(iВ) степеней свободы. После умножения на постоянную Авогадро и подстановкой в опредеение молярной теплоемкости при изохорном процессе:
– число степеней свободы, равное сумме поступательных (iП), колебательных (iК) и удвоенных вращательных(iВ) степеней свободы. После умножения на постоянную Авогадро и подстановкой в опредеение молярной теплоемкости при изохорном процессе: .
.
 ,
,
 .
.
 .
.
 .
.
 .
.
 . Подстановка уравнения Менделеева–Клайперона в уравнение (74) дает уравнение адиабаты в зависимости от других функций состояния идеального газа:
. Подстановка уравнения Менделеева–Клайперона в уравнение (74) дает уравнение адиабаты в зависимости от других функций состояния идеального газа: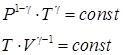 .
.
 .
.
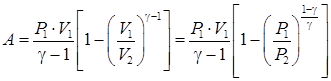 .
.
 ,
,
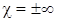 – изохорный процесс.
– изохорный процесс.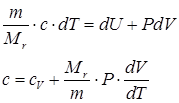 .
.
 ,
,
 .
.
 .
.
 ) –
) –  ;
; ) –
) –  ;
;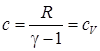 ;
; ) –
) – 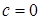 .
. .
.



