Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция №3. Врожденный иммунитет. Клеточные факторы врожденного иммунитетаСтр 1 из 5Следующая ⇒
СЛАЙД 1 Лекция №3. Врожденный иммунитет. Клеточные факторы врожденного иммунитета Содержание 1. Типы белых клеток крови. Миелоидные клетки (нейтрофилы, эозинофилы, тучные клетки, базофилы, моноциты, макрофаги, дендритные клетки) 2. Происхождение белых клеток крови 3. Длительность жизни белых клеток крови. 4. Нейтрофилы и макрофаги 5. Ретикулоэндотелиальная система. Молекулы адгезии (селектины, интегрины) Хемотаксические факторы (Хемокины) 8. Воспаление 9. Эффекты воспаления. Макрофаги и нейтрофилы при воспалении 10. Нейтрофилия. Защитные механизмы воспаления 11. Образование гноя. 12. Эозинофилы 13. Базофилы. Тучные клетки 14. Дендритные клетки 15. Естественные киллеры Т-лимфоциты. Взаимодействие естественных киллеров и дендритных клеток Фагоцитоз. Механизмы и значение фагоцитоза
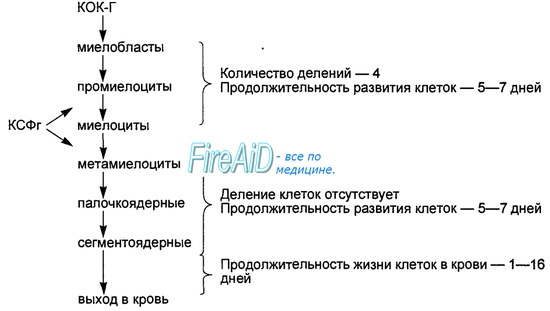
СЛАЙД 2 Типы белых клеток крови. В норме в крови присутствуют шесть типов белых клеток крови: Полиморфноядерные нейтрофилы, Полиморфноядерные эозинофилы, Полиморфноядерные базофилы, Моноциты, Лимфоциты Плазматические клетки. Кроме того, существует большое количество тромбоцитов, представляющих фрагменты клеток другого типа — мегакариоцитов, которые, подобно лейкоцитам, обнаруживают в костном мозге. Первые три типа клеток имеют зернистость, поэтому их называют гранулоцитами или, согласно клинической терминологии, полиморфноядерными клетками из-за многочисленных ядер.
Гранулоциты и моноциты защищают организм от внедряющихся агентов, главным образом путем их поглощения, т.е. фагоцитоза. Лимфоциты и плазматические клетки функционируют в основном в связи с иммунной системой. Наконец, специфической функцией тромбоцитов является активация механизма свертывания крови. Концентрации разных типов лейкоцитов в крови. Взрослый человек имеет около 7000 белых клеток крови на микролитр крови (сравните с 5 млн красных клеток крови). По отношению к общему количеству лейкоцитов нормальное процентное содержание разных их типов приблизительно следующее. Количество тромбоцитов, которые являются лишь фрагментами клеток, в каждом микролитре крови в норме — около 300000. СЛАЙД 3 СЛАЙД 4
Длительность жизни белых клеток крови. Нейтрофилы и макрофаги Жизнь гранулоцитов после их выделения из костного мозга в норме продолжается 4-8 ч в циркулирующей крови и еще 4-5 сут в тканях, которые в них нуждаются. Во время тяжелой тканевой инфекции этот общий срок жизни часто укорачивается до нескольких часов, поскольку гранулоциты поступают еще быстрее в инфицированную область, выполняют свои функции и в процессе этого саморазрушаются. Моноциты тоже имеют короткий транзитный период, находясь в крови 10-20 ч, затем выходят через мембраны капилляров в ткани. В тканях размер моноцитов значительно увеличивается, они становятся тканевыми макрофагами, и в такой форме могут жить месяцами до тех пор, пока не разрушатся во время выполнения фагоцитарной функции. Тканевые макрофаги составляют основу тканевой макрофагальной системы, которая обеспечивает постоянную защиту против инфекции, что подробно обсуждается далее. Лимфоциты постоянно поступают в систему кровообращения вместе с дренажом лимфы из лимфатических узлов и другой лимфоидной ткани. Через несколько часов они выходят из крови в ткани путем диапедеза. Затем лимфоциты вновь входят в лимфу и опять возвращаются в кровь; так происходит постоянная циркуляция лимфоцитов в теле. Срок жизни лимфоцитов составляет недели или месяцы в зависимости от потребности организма в этих клетках. Тромбоциты в крови заменяются примерно каждые 10 сут; другими словами, каждые сутки формируются примерно 30000 пластинок на каждый микролитр крови.
СЛАЙД 5
Нейтрофилы и макрофаги Именно нейтрофилы и тканевые макрофаги в основном атакуют и разрушают внедрившиеся бактерии, вирусы и другие вредоносные агенты. Нейтрофилы — зрелые клетки, способные атаковать и разрушать бактерии даже в циркулирующей крови. Наоборот, тканевые макрофаги начинают жизнь как моноциты крови и, пока они находятся в крови, являются незрелыми клетками с низкой способностью к борьбе с инфекционными агентами. Однако сразу после выхода в ткани моноциты начинают разбухать, иногда увеличиваясь в диаметре в 5 раз до размера, видимого невооруженным глазом — 60-80 мкм. Теперь эти клетки называют макрофагами, и они обладают очень высокой способностью бороться с внутритканевыми болезнетворными агентами.
Белые клетки крови выходят в тканевые пространства путем диапедеза. Нейтрофилы и моноциты могут протискиваться через поры кровеносных капилляров путем диапедеза. Это значит, что даже если пора гораздо меньше размера клетки, небольшая часть клетки вдвигается в нее и моментально сжимается до размера поры. Белые клетки крови продвигаются через тканевые пространства амебоидными движениями. И нейтрофилы, и макрофаги могут двигаться через ткани амебоидными движениями. Некоторые клетки двигаются со скоростью, достигающей 40 мкм/мин, т.е. каждую минуту перемещаются на расстояние, равное их собственной длине. Белые клетки крови притягиваются к области воспаления путем хемотаксиса. Многие химические вещества в тканях заставляют нейтрофилы и макрофаги двигаться по направлению к источнику химического агента. Этот феномен, показанный на рисунке, известен как хемотаксис. При воспалении ткани формируется, по крайней мере, дюжина разных продуктов, способных вызывать хемотаксис по направлению к воспаленной области. К таким веществам относят: (1) некоторые из бактериальных или вирусных токсинов; (2) продукты дегенерации самих воспаленных тканей; (3) некоторые продукты реакции системы комплемента, активируемой в воспаленных тканях; (4) некоторые продукты взаимодействия, возникающие при свертывании плазмы в воспаленной области, и другие вещества. Хемотаксис зависит от градиента концентрации хемотаксического вещества. Самая высокая концентрация — около источника, который управляет однонаправленным движением белых клеток крови. Хемотаксис эффективен на расстоянии до 100 мкм от воспаленной ткани. Следовательно, поскольку практически нет тканевой области, расположенной на расстоянии больше 50 мкм от капилляра, хемотаксический сигнал может легко перемещать массы лейкоцитов из капилляров в воспаленную область.
СЛАЙД 7 СЛАЙД 8 Воспаление При повреждении ткани независимо от его причины (бактерии, травма, химические агенты, тепло или любое другое явление) выделяется множество веществ, вызывающих существенные вторичные изменения в окружающих неповрежденных тканях. Весь комплекс этих тканевых изменений называют воспалением. Воспаление характеризуется: (1) расширением местных кровеносных сосудов с последующим избыточным местным кровотоком; (2) увеличением проницаемости капилляров, что способствует утечке большого количества жидкости в интерстициальное пространство; (3) часто — свертыванием жидкости в интерстициальном пространстве в связи с избытком фибриногена и других белков, вытекающих из капилляров; (4) миграцией большого числа гранулоцитов и моноцитов в ткани; (5) отеком тканевых клеток. К тканевым продуктам, вызывающим эти реакции, относятся гистамин, брадикинин, серотонин, простагландины, несколько разных продуктов реакции системы комплемента, продукты реакции свертывающей системы крови и множество веществ, называемых лимфокинами, которые выделяются активированными Т-клетками (частью иммунной системы). Некоторые из этих веществ мощно активируют макрофагальную систему, и в течение нескольких часов макрофаги начинают уничтожать поврежденные ткани. Но иногда макрофаги повреждают еще живые тканевые клетки.
СЛАЙД 9 СЛАЙД 10 СЛАЙД 11 Образование гноя. Когда нейтрофилы и макрофаги поглощают большое количество бактерий и некротической ткани, практически все нейтрофилы и многие (но не большинство) макрофаги погибают. Через несколько дней в воспаленной ткани часто формируется полость, содержащая различные части некротизированной ткани, погибшие нейтрофилы и макрофаги, а также тканевую жидкость. Эту смесь обычно называют гноем. После прекращения инфекционного процесса мертвые клетки и некротическая ткань в гное постепенно, в течение нескольких дней растворяются, а конечные продукты в итоге всасываются в окружающие ткани и лимфу до тех пор, пока большинство признаков повреждения ткани не исчезнут.
СЛАЙД 11 Эозинофилы В норме эозинофилы составляют около 2% всех лейкоцитов крови. Эозинофилы — слабые фагоциты и способны к хемотаксису, но в отличие от нейтрофилов значение эозинофилов в защите против обычных типов инфицирования сомнительно. Однако у людей с паразитарными инфекциями часто образуется большое число эозинофилов, которые мигрируют в ткани, пораженные паразитами. Хотя большинство паразитов слишком велики, чтобы их могли поглотить эозинофилы или любые другие клетки-фагоциты, эозинофилы способны прикрепляться к паразитам с помощью специфических поверхностных молекул и выделять вещества, губительные для многих из них. Например, одной из наиболее распространенных паразитарных инфекций является шистосомоз, которым страдает треть населения в некоторых развивающихся странах. Паразит, вызывающий эту инфекцию, может проникать в любую часть тела. Эозинофилы прикрепляются к незрелым формам паразитов и уничтожают многих из них несколькими способами: (1) выделением гидролитических ферментов из гранул, представляющих собой модифицированные лизосомы; (2) выделением высокореактивных форм кислорода, особенно губительных для паразитов; (3) выделением из гранул полипептида, убивающего личинки, который называют главным основным белком. В некоторых районах мира эозинофилию вызывает другое паразитарное заболевание — трихинеллез. Оно возникает в результате проникновения в мышцы тела паразита трихинеллы (Trichinella, или «свиной червь») после того, как человек съедает плохо проваренную свинину.
Эозинофилы обычно собираются также в тканях, где осуществляются аллергические реакции, например в перибронхиальных тканях легких у людей с астмой и в коже после аллергических кожных реакций. Частично это связано с фактом участия в аллергических реакциях многих тучных клеток и базофилов, которые мы обсудим в следующем разделе. Тучные клетки и базофилы выделяют эозинофилъный хемотаксический фактора заставляющий эозинофилы мигрировать по направлению к ткани, воспаленной в связи с аллергической реакцией. Полагают, что эозинофилы нейтрализуют некоторые из вызывающих воспаление веществ, выделяемых тучными клетками и базофилами и, вероятно, фагоцитируют и разрушают комплексы аллерген-антитело, предупреждая чрезмерное распространение местного воспалительного процесса.
СЛАЙД 12 Базофилы. Тучные клетки Базофилы циркулирующей крови похожи на большие тканевые тучные клетки, локализованные непосредственно снаружи капилляров. И тучные клетки, и базофилы высвобождают в кровь гепарин — вещество, способное предупреждать свертывание крови. Эти клетки выделяют также гистамин и небольшое количество брадикинина и серотонина. В воспаленных тканях именно тучные клетки в основном высвобождают эти вещества. Тучные клетки и базофилы играют чрезвычайно важную роль в некоторых типах аллергических реакций, поскольку вызывающий эти реакции особый тип антител — иммуноглобулин Е (IgE) — имеет специфическую способность прикрепляться к тучным клеткам и базофилам. Когда впоследствии специфический антиген реагирует со специфическим IgE антителом, возникающее в результате прикрепление антигена к антителу заставляет тучную клетку или базофил разрываться и выделять очень большие количества гистамина, брадикинина, серотонина, гепарина, медленно действующей анафилактической субстанции и ряда лизосомальных ферментов. Они вызывают локальные сосудистые и тканевые реакции, лежащие в основе большинства аллергических реакций.
СЛАЙД 13 Молекулы адгезии (селектины, интегрины) Молекулам адгезии принадлежит основополагающая роль в формировании многоклеточного организма, поскольку они служат главными факторами контакта между клетками, а также участвуют в их перемещении. Молекулы адгезии формируют несколько достаточно консервативных семейств. У млекопитающих известно 4 группы молекул адгезии — селектины, интегрины, молекулы суперсемейства иммуноглобулинов (IgSF) и кадхерины. Для осуществления миграции и взаимодействия миелоидных клеток важны представители трех первых групп. Селектины — тканевые лектины, обладающие сродством к концевым остаткам маннозы и фрукозы. Известно три варианта селектинов: P (от Platelet — тромбоцитарный), E (от Endothelial — эндотелиальный) и L (от Lymphocyte — лимфоцитарный). Селектины — трансмембранные белки. Р-селектин участвует в активации тромбоцитов и ранних этапах
Е-селектин — основной селектин клеток эндотелия сосудов. Под влиянием активирующих воздействий (особенно провоспалительных цитокинов) Е-селектин экспрессируется на поверхности клеток и играет ведущую роль на ранних этапах эмигра- ции лейкоцитов из сосудистого русла. В отличие от двух вышеназванных, L-селектин присутствует не на эндотелиальных клетках, а на лейкоцитах. Он спонтанно экспрессируется на поверхности нейтрофилов, моноцитов и лимфоцитов и обеспечивает осуществление начального этапа миграции этих клеток — этапа перекатывания. Интегрины — наиболее важные и полифункциональные молекулы адге- зии. Интегрины соединяют внутреннюю и внешнюю среду клетки, проводя сигналы как изнутри клетки наружу, так и наоборот — из внеклеточной среды внутрь клетки. Внутриклеточная часть интегринов связана с компонентами цитоскелета, что определяет многие функции этих молекул Интегрины — трансмембранные гетеродимеры. Полипептидные цепи интегринов (α и β) соединены нековалентно. К настоящему времени известно 24 варианта интегринов, представляющих собой комбинации из 18 вариантов α- и 8 вариантов β-цепей. Наибольший интерес для иммунологии представляют интег- рины семейств β1 и β2, присутствующие на поверхности иммуноцитов. Интегрины задействованы в различных реакциях, связанных с участием этих клеток в иммунных процессах: эмиграции лейкоцитов из кровотока и поступлении их в очаг воспаления, взаимодействии с клетками-мишенями, формировании иммунного синапса и т.д. β1-Интегрины (молекулы группы VLA) взаимодействуют с компонен- тами межклеточного матрикса (фибронектином, ламинином, коллагеном, фибриногеном) и мембранным рецептором VCAM-1 (СD106). Наиболее важную роль в физиологии нейтрофилов играет интегрин VLA-5, для моноцитов/макрофагов и лимфоцитов наиболее важен интегрин VLA-4, отсутствующий на нейтрофилах. β2-Интегрины (иногда называемые LeuCAM) представлены на поверхности лейкоцитов. Основной интегрин лимфоцитов LFA-1, присутствующий на всех разновидностях этих клеток, представлен и на поверхности моноцитов и макрофагов. Интегрин Мас-1 наиболее характерен для макрофагов (что отражено в его названии), но его выявляют и на других миелоидных и NK-клетках, а также перитонеальных В-лимфоцитах. Третий интегрин этой группы — p150/р95 — маркер дендритных клеток, но также представлен на других клетках миелоидного ряда.
СЛАЙД 14 Хемотаксические факторы (Хемокины) Важнейшее условие участия миелоидных клеток в реакциях врожденного иммунитета — хемотаксис — направленное движение клеток, определяемое градиентом химических факторов (хемоаттрактантов). Хемотаксис следует отличать от хемокинеза — ненаправленного усиления подвижности клеток под влиянием химических агентов. При реализации врожденного имму- нитета в виде воспалительной реакции хемотаксис определяет миграцию лейкоцитов из кровяного русла в очаг воспаления. При воспалении и реакциях врожденного иммунитета в качестве хемо- аттрактантов выступают разные вещества, образующиеся в очаге воспале- ния. Прежде всего это продукты, выделяемые самими микроорганизмами. Наиболее известен пептид N-формил-метионил-лейцил-фенилаланил (fMLP) и его аналоги, обладающие очень сильным хемотаксическим действием. Этот пептид участвует в инициации синтеза белка у бактерий. Он отсутствует в эукариотических клетках и его появление служит сигналом бактериальной инфекции, фактически выступая в качестве PAMP. Миелоидные клетки (нейтрофилы, моноциты, макрофаги) имеют мембранные рецепторы для этого пептида — FPR (Formyl-peptide receptor) и FPLR (Formyl peptide-like receptor). Синтетический пептид fMLP широко применяют для моделирования хемотаксиса, обусловленного бактериальными продуктами. FPR и FPLR относят к семейству родопсиноподобных рецепторов, 7 раз пронизывающих мембрану. Хемотаксическим действием обладают многие другие молекулы, образую- щиеся в очаге воспаления, а также продукты расщепления факторов сверты- вания крови и фибринолиза (тромбин, фибрин), нейропептиды, фрагменты иммуноглобулинов, пентраксины (С-реативный белок, сывороточный ами- лоид), фактор агрегации тромбоцитов — PAF (Platelet aggregation factor) и т.д. Ряд цитокинов (особенно провоспалительных) также оказывает на лейкоци- ты хемотаксическое действие. Хемокины (от Chemotactic cytokines) были открыты в конце 80-х годов про- шлого столетия. Они составляют обширную группу цитокинов, объединен- ную сходным строением и способностью распознавать родопсиноподобные рецепторы. Хемокины — полипептиды. Помимо сек- ретируемых, выделяют мембранные формы молекул хемокинов (например, фракталкин), выступающие также в роли молекул адгезии. Обычно хемо- кины присутствуют в биологических жидкостях в форме димеров, реже — тетрамеров. Четвертичная структура димеров существенно различается для хемокинов двух основных групп. Хемокины способны формировать не только CC:хемокин CCL2 (MCP:1) CXC:хемокин СXCL8 (IL:8). Функционально важное свойство хемокинов — их способность взаимодействовать с глюкозаминогликанами (гепарин, хондро- итинсульфат и др.) на поверхности клеток или в межклеточном матриксе. Иммобилизация хемокинов в тканях важна для создания их градиента, необ- ходимого для направленного движения клеток. По функциональной роли выделяют: гомеостатические хемокины; провоспалительные хемокины. Гомеостатические хемокины отвечают за распределение клеток (прежде всего лимфоцитов) по лимфоидным органам. Остальные хемокины (подавляющее большинство) относят к группе провоспалительных, поскольку они отве- чают за активацию клеток и привлечение их в очаг воспаления. Хемокины этих групп различаются условиями синтеза и секреции: гомеостатические цитокины секретируются постоянно, обычно стромальными и эндотелиальными.
СЛАЙД 15 Дендритные клетки Впервые дендритные клетки были описаны Лангергансом в 1868 г., в связи с чем впоследствии они стали известны как клетки Лангерганса. Однако сам автор считал их чувствительными нейронами. Фундамент современных представлений о ДК, как клетках иммунной системы, заложили американские ученые Штайман и Кон, и коллеги в 1970-е гг., открывшие и охарактеризовавшие ДК в лимфоидных органах мышей. В 1985 г. показана принадлежность клеток Лангерганса к ДК. 1990-е гг. характеризуются определением характеристики различных линий ДК и путей их дифференцировки, установлением роли ДК в регуляции клеточного, гуморального адаптивного ответа, началом изучения роли ДК в патогенезе инфекционных и онкологических заболеваний человека. Подобно другим клеткам иммунной системы, предшественниками ДК являются гематопоэтические стволовые клетки костного мозга. FLT-3 лиганд и GM-CSF являются ключевыми ростовыми и дифференциро-вочными факторами in vivo. В процессе гематопоэза стволовые клетки, несущие молекулы CD34', дают начало двум типам прекурсорных ДК (пpe-DCs) — моноцитов (пре-DC1) и плазмацитоидных клеток (пpe-DC2), из которых формируются зрелые ДК. Данные предшественники составляют около 1% всех мононуклеарных клеток периферической и пуповинной крови, а также лимфоидных органов. Лимфоидные дендритные клетки присутствуют в крови, лимфатических узлах, селезенке и тимусе. Судьба лимфоидных ДК, поступающих в Т-клеточные области лимфоузлов из крови, неизвестна. В тимусе лимфоидные ДК принимают участие в процессе отрицательной селекции, то есть отвечают за элиминацию Т-клеток, реагирующих на собственные антигены. Незрелые дендритные клетки и их предшественники избирательно реагируют на патогены. В отличие от миелоидных пре-ДК плазмацитоидные пре-ДК заселяют преимущественно Т-клеточные зоны вторичных лимфоидных органов, а в нелимфоидных практически отсутствуют Незрелые ДК и их предшественники (пpe-DCs) вовлекаются во врожденное распознавание микробов, в то время как пре-DCsl (предшественники миелоидных ДК) фагоцитируют и вызывают киллинг различных бактерий и грибков. Пpe-DCs2 (предшественники лимфоидных ДК) играют главную роль в раннем антивирусном иммунном ответе, продуцируя IFN-a и В. Эти клетки были названы натуральными интерферонпродуцирую-щими клетками (NIPCs). Плазмацитоидные дендритные клетки участвуют в В-клеточном ответе на вирусы: после их элиминации из культур МЛПК уровень продукции антител резко падает. За счет секреции интерферонов I типа лимфоидные ДК стимулируют пролиферацию плазмобластов, а проведение сигналов с TLRs ДК способствует выработке ими IL-6 и индукции синтеза специфических антител В-клетками. При аллергических реакциях и некоторых видах хронического воспаления пpe-DCs привлекаются как в пораженные нелимфоидные ткани, так и в реактивно измененные регионарные лимфатические узлы; они инфильтрируют также опухолевую ткань при некоторых злокачественных новообразованиях.
СЛАЙД 16 СЛАЙД 17 СЛАЙД 18 Фагоцитоз, осуществляемый нейтрофилами. Нейтрофилы, входящие в ткани, являются уже зрелыми клетками, способными к немедленному фагоцитозу. При встрече с частицей, которая должна быть фагоцитирована, нейтрофил сначала прикрепляется к ней, а затем выпускает псевдоподии во всех направлениях вокруг частицы. На противоположной стороне частицы псевдоподии встречаются и сливаются друг с другом. При этом образуется замкнутая камера, содержащая фагоцитируемую частицу. Затем камера погружается в цитоплазматическую полость и отрывается от наружной стороны клеточной мембраны, формируя свободно плавающий фагоцитарный пузырек (также называемый фагосомои) внутри цитоплазмы. Один нейтрофил обычно может фагоцитировать от 3 до 20 бактерий, прежде чем он сам инактивируется или погибает. Фагоцитоз, осуществляемый макрофагами. Макрофаги представляют собой конечную стадию развития моноцитов, входящих в ткани из крови. При активации иммунной системой они становятся гораздо более мощными фагоцитами, чем нейтрофилы, и часто могут фагоцитировать до 100 бактерий. Макрофаги также способны поглощать гораздо более крупные частицы, даже целые эритроциты и иногда малярийных паразитов, тогда как нейтрофилы не могут фагоцитировать частички, размер которых значительно превышает размер бактерии. Кроме того, макрофаги могут выталкивать конечные продукты и часто живут и функционируют в течение многих месяцев. Сразу после фагоцитирования большинство частиц перевариваются внутриклеточными ферментами. После фагоцитирования инородной частицы лизосомы и другие цитоплазматические гранулы нейтрофила или макрофага немедленно вступают в контакт с фагоцитарным пузырьком, их мембраны сливаются, в результате в пузырек вбрасываются многие переваривающие ферменты и бактерицидные вещества. Таким образом, фагоцитарный пузырек теперь становится переваривающим пузырьком, и сразу начинается расщепление фагоцитированной частицы. И нейтрофилы, и макрофаги содержат громадное количество лизосом, наполненных протеолитическими ферментами, особенно приспособленными для переваривания бактерий и других чужеродных белковых веществ. Лизосомы макрофагов (но не нейтрофилов) содержат также большое количество липаз, которые разрушают толстые липидные мембраны, покрывающие некоторые бактерии, например туберкулезную палочку. И нейтрофилы, и макрофаги могут уничтожать бактерии. Кроме переваривания поглощенных бактерий в фагосомах нейтрофилы и макрофаги содержат бактерицидные агенты, уничтожающие большинство бактерий, даже если лизосомальные ферменты не могут их переварить. Это особенно важно, поскольку некоторые бактерии имеют защитные оболочки или другие факторы, предупреждающие их разрушение пищеварительными ферментами. Основная часть «убивающего» эффекта связана с действием некоторых мощных окислителей, образуемых в больших количествах ферментами мембраны фагосомы, или специфической органеллой, называемой пероксисомой. К этим окислителям относятся супероксид (О2), пероксид водорода (Н2О2) и гидроксилъные ионы (-ОН), каждый из них даже в небольших количествах смертелен для большинства бактерий. Кроме того, один из лизосомальных ферментов — миелопероксидаза — катализирует реакцию между Н2О2 и ионами Сl с образованием гипохлорита — мощного бактерицидного агента. Однако некоторые бактерии, особенно туберкулезная палочка, имеют оболочки, устойчивые к лизосомальному перевариванию, и к тому же секретируют вещества, отчасти препятствующие «убивающим» эффектам нейтрофилов и макрофагов. Такие бактерии ответственны за многие хронические болезни, например туберкулез.
СЛАЙД 1 Лекция №3. Врожденный иммунитет. Клеточные факторы врожденного иммунитета Содержание 1. Типы белых клеток крови. Миелоидные клетки (нейтрофилы, эозинофилы, тучные клетки, базофилы, моноциты, макрофаги, дендритные клетки) 2. Происхождение белых клеток крови 3. Длительность жизни белых клеток крови. 4. Нейтрофилы и макрофаги 5. Ретикулоэндотелиальная система.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 821; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.119.199 (0.06 с.) |