
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кривые титрования системы слабое – сильное
Система слабое – сильное представляет собой кривые титрования слабого электролита (кислоты или основания) сильным электролитом, взятым в качестве титранта. Особенностью этих кривых является несимметричность относительно линий эквивалентности и нейтральности, так как до точки эквивалентности в таких растворах образуются сопряженные системы: слабый электролит и его соль, которые обладают выраженным буферным действием, замедляющим изменение рН среды. Точка эквивалентности смещена и не совпадает с линией нейтральности в следствии гидролиза продуктов реакции, но она по-прежнему находится в середине скачка. Величина скачка значительно меньше, чем в системе сильное – сильное, поэтому подбор индикатора должен осуществляться с учетом этих особенностей. Существует два вида кривых титрования (КТ) системы слабое – сильное: а) слабой кислоты сильным основанием (титрант); б) слабого основания сильной кислотой (титрант). а) Кривая титрования слабой одноосновной кислоты сильным основанием Пусть титруют слабую кислоту сильным основанием, например 0,1 н. раствор CH3COOH – титруемое вещество (X), а 0,1 н. раствор NaOH – титрант (Т). Пример К.Т. такой системы представлен на рисунке 4.16.
Рисунок 4.16 – Кривая титрования слабой кислоты (0,1н. CH3COOH) сильным основанием (0,1н.NaOH) 1. pH раствора определяется концентрацией слабой кислоты Са и значением ее константы диссоциации Kд (раздел 4.8). Обычно величина рН составляет порядка 2 – 4 (выше, чем у сильной кислоты). 2. Раствор недотитрован. В результате реакции с титрантом образуется соль слабой кислоты и сильного основания, которая вместе с остатком неоттитрованной кислотой образует сопряженную систему – кислотный буфер: CH3COOHост – CH3COONa, поэтому pH меняется очень медленно и кривая идет почти горизонтально. Вблизи скачка, как и в начале КТ, буферное действие ослабевает и кислотность раствора начинает изменяться несколько быстрее. Для построения этой части КТ используют формулу кислотного буфера (таблица 4.4). 3. В растворе только продукт реакции – соль, гидролизующаяся по аниону. Для данной системы уравнением, описывающим Т.Э., будет:
CH3COOH + NaOH = CH3COONa + H2O. Запишем уравнение гидролиза соли CH3COONa: CH3COO- + HOH «CH3COOH + OH- т.к. в избытке ионы OH-, то Т.Э. в этой системе смещена в щелочную среду и рассчитывается по формулам гидролизующихся солей (таблица 4.4). Для фиксации Т.Э. применяют индикаторы, срабатывающие при pH > 7, например фенолфталеин. Интервал работы индикатора метилового оранжевого (рис. 4.16) находится вне области скачка и титровать с ним нельзя. 4. Титруемый раствор содержит избыток титранта NaOH, концентрация которого и определяет свойства системы, поэтому значения pH будут меняться достаточно быстро. Влиянием образовавшейся соли на ход КТ можно пренебречь, т.к. ее гидролиз подавляется избытком щелочи. б) Кривая титрования слабого основания сильной кислотой Пусть титруют слабое основание сильной кислотой, например 0,1 н. раствор NH4OH – титруемое вещество (X), а 0,1 н. раствор HCl – титрант (Т). Пример КТ такой системы представлен на рисунке 4.17. Вычисление значений рН также выполняют по формулам, приведенным в разделе 4.8, таблица 4.4.
Рисунок 4.17 – Кривая титрования слабого основания (0,1н. NH4OH) сильной кислотой (0,1н. HCl)
1. Исходный раствор слабого основания имеет щелочную реакцию и для слабого электролита обычно составляет порядка pH = 10 – 12. Значение pH определяется начальной концентрацией раствора С(NH4OH) и константой диссоциации слабого основания Kд 2. После начала прибавления титранта – сильной кислоты, в титруемом растворе образуется соль NH4Cl, содержащая катион слабого основания и анион сильной кислоты, которая с остатком неоттитрованного слабого основания образует буферную систему NH4OH - NH4Cl (основный буфер), что и определяет общее слабое изменение рН в ходе титрования (рис. 4.17). В начале титрования, когда количество образовавшейся соли невелико, раствор обладает недостаточно эффективными буферными свойствами, как и вблизи Т.Э., когда в растворе остается незначительное количество слабого основания. В этих областях изменение рН происходит несколько быстрее. 3. В Т.Э. слабое основание полностью прореагировало с прибавленной сильной кислотой. В растворе присутствует только соль, образованная катионом слабого основания, которая подвергается гидролизу по катиону:
NH4OH + HCl = NH4Cl + H2O – уравнение Т.Э.
Т.к. в следствии гидролиза NH4Cl в растворе присутствует избыток ионов H+, то Т.Э. в этой системе смещена в кислую среду и для ее фиксации применяют индикаторы, срабатывающие при pH < 7, например метиловый оранжевый. 4. Значение pH титруемого раствора после Т.Э. определяется концентрацией Сизб(T) – сильной кислоты, в присутствии которой гидролиз образовавшейся соли подавляется и практически не вносит заметного вклада в величину pH раствора. Концентрация протонов возрастает пропорционально изменению концентрации избытка титранта HCl в растворе, т. е. рН меняется достаточно быстро (убывает).
|
||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 484; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.41.187 (0.008 с.) |
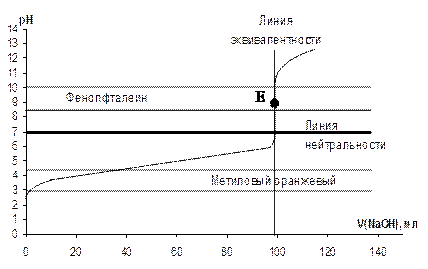
 – начальная точка титрования.
– начальная точка титрования. – область до начала скачка.
– область до начала скачка. - область скачка, содержащего Т.Э.
- область скачка, содержащего Т.Э. - раствор перетитрован.
- раствор перетитрован.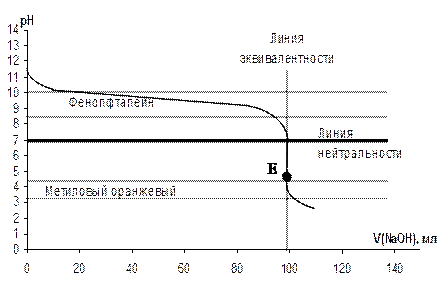
 – начальная точка титрования.
– начальная точка титрования. - область скачка, содержащая Т.Э.
- область скачка, содержащая Т.Э.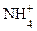 + HOH «NH4OH + H+ - уравнение гидролиза
+ HOH «NH4OH + H+ - уравнение гидролиза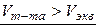 - область после Т.Э.
- область после Т.Э.


