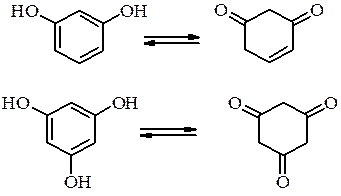Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особливості реакцій електрофільного заміщення
Найважливішими реакціями за участю ароматичного ядра є реакції електрофільного заміщення: галогенування, нітрування, сульфування, алкілування, азосполучення. Вони відбуваються надзвичайно легко в орто - і пара -положення ароматичного ядра відносно групи –ОН, внаслідок значного збільшення електронної густини в цих положеннях за рахунок р,π-супряження. а) Бромування фенолу Фенол легко вступає в реакцію з галогенами. В реакції з бромною водою утворюється важкорозчинний у воді 2,4,6-трибромфенол. Можливе його подальше галогенування:
б) Сульфування фенолу.
в) Нітрування фенолу проходить при дії розведеної нітратної кислоти. Одержується суміш о - та п -нітрофенолів з перевагою о -ізомеру. При подальшому нітруванні концентрованою нітратною кислотою отримують 2,4,6-тринітрофенол (пікрінову кислоту).
г) Нітрозування фенолу. Фенол порівняно легко нітрозується нітритною кислотою вже при кімнатній температурі з утворенням суміші орто - і пара - ізомерів:
д) С-алкілування та С-ацилювання фенолу Реакції С-алкілування для фенолів проходять з малою швидкістю та малим виходом.
Реакції С-ацилювання можна проводити за Фріделем-Крафтсом, але частіше ацильні похідні фенолів одержують у дві стадії: спочатку феноли перетворюють в естери, які нагрівають з AlCl3. При цьому відбувається міграція ацильноъ групи від атома Оксигену гідроксильної групи в о - або п ‑положення ароматичного кільця (перегрупування Фріса):
е) Гідроксиметилування фенолу. Феноли легко конденсуються з альдегідами у присутності кислот або лугів. Особливе значення має конденсація фенолу з формальдегідом, в результаті якої утворюється фенолформальдегідна смола. За звичайної температури збільшення молекули за рахунок конденсації фенола з альдегідом проходить у лінейному напрямку:
При нагріванні фенолу з надлишком формальдегіду утворюється полімер з розгалуженою просторовою сітчастою структурою – резит. ж) Рекція Кольбе-Шмідта – одержання саліцилової кислоти
Багатоатомні феноли Три ізомерні двоатомні феноли
а також три ізомери триатомних фенолів:
мають властивості близькі до властивостей одноатомних фенолів: утворюють етери та інші похідні за гідроксильною групою, дають кольорові реакції з FeCl3, але легше окиснюються до відповідних хінонів і є більш сильними кислотами.
Резорцин і флороглюцин мають здатність до кето-єнольної таутомерії:
Хінони Хінони – циклічні a,b-ненасичені дикетони. Найпростішими представниками є о - і п -хінони:
Хінони –легко утворюються з двоатомних фенолів і легко відновлюються до двоатомних фенолів. Хінони вступають у реакції характерні для кетонів. Крім того хінони вступають у реакції 1,4- і 1,6-приєднання, які призводять до утворення похідних двоатомних фенолів. При змішуванні рівномолярних кількостей хінону і гідрохінону утворюється молекулярна сполука – хінгідрон.
АЛЬДЕГІДИ І КЕТОНИ Альдегіди і кетони – це сполуки, у молекулах яких міститься функціональна група >C=O (карбонільна або оксогрупа). В альдегідах карбонільна група сполучена з карборадикалом і одним атомом Гідрогену, у кетонах вона сполучена з двома карборадикалами: Класифікація
|
|||||
|
Последнее изменение этой страницы: 2016-12-29; просмотров: 740; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.73.125 (0.004 с.) |
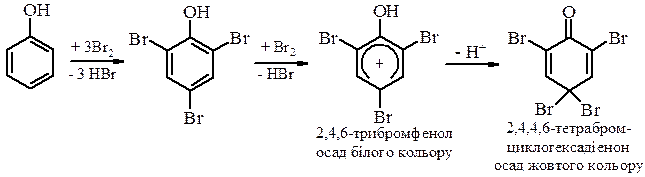 В апротонних розчинниках бромування проходить переважно з утворенням п -бромфенолу:
В апротонних розчинниках бромування проходить переважно з утворенням п -бромфенолу:
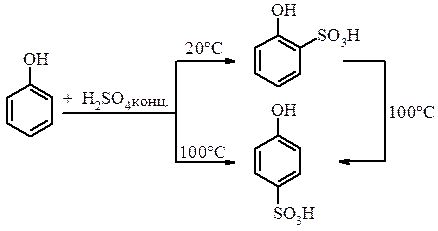
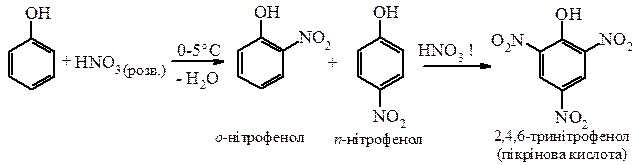
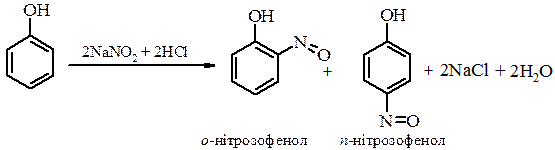
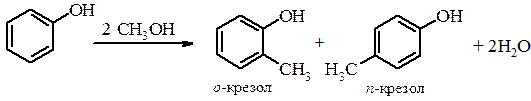
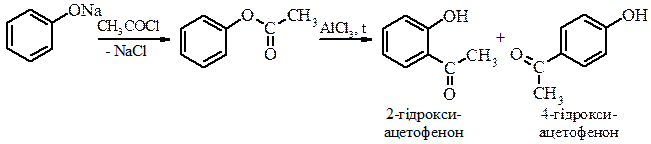
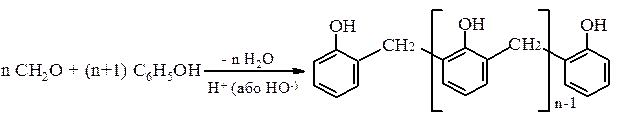
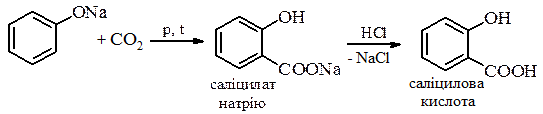
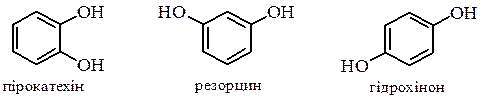
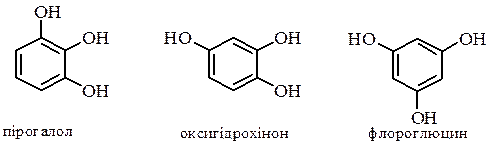 ,
,