Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оценка данных дифференцированного обследования
Если дыхание в норме и нет существенных отклонений от нормы пульса и артериального давления, после того как получены достаточно исчерпывающие данные анамнестического, характера и в основном решены проблемы элементарной терапии, необходимо провести быстрое, но осторожное дифференцированное обследование больного. Целью обследования должно быть получение данных, не только объясняющих происхождение комы, но и обусловливающих дальнейший ход лечения и, поддержания витальных функций организма. Выяснению природы комы, возможной локализации поражения мозга может способствовать оценка уровня сознания, характера дыхания, данных исследования состояния глазных яблок и зрачков, характера мышечного ответа на неприятные (болевые) раздражения. Рассмотрим более подробно каждый из этих признаков. Уровень сознания. У больных, не находящихся в глубоком коматозном состоянии, уровень сознания является наиболее чувствительным показателем тенденций в развитии комы, т. е. показателем предстоящего улучшения или ухудшения. Для оценки сознания удобнее всего пользоваться шкалой комы Глазго. Больного необходимо обследовать с использованием этой шкалы каждые 2 ч. Уменьшение числа баллов, получаемых при оценке сознания по этой шкале, свидетельствует об ухудшении тенденций в развитии комы. Наш опыт показывает, что изменения уровня сознания и их направленность являются более тонким и достоверным показателем комы, чем, например, характер дыхательной функции и даже ЭЭГ. Расстройства дыхания. Нарушения деятельности мозга, в частности ствола мозга, вызывают расстройства дыхания, которые могут быть как самостоятельной причиной, так и вспомогательным фактором в развитии сопора или комы. Классическим примером подобных расстройств является дыхание Чейна—Стокса. В некоторых случаях это первое дыхательное нарушение, свидетельствующее о депрессии мозга. Существует много причин возникновения дыхания типа Чейна—Стокса: атеросклероз мозговых сосудов, нарушение кровообращения мозга при застойной недостаточности и др. Центральная нейрогенная гипервентиляция, свидетельствующая, как правило, о поражении среднего мозга, обычно характеризуется устойчивым, быстрым, глубоким и регулярным дыханием. Иногда такое дыхание называют машинным. В чистой форме, т. е. без гипоксии или гиперкапнии, нарушения дыхания наблюдаются редко.
Наш многолетний опыт лечения коматозных состояний и консультаций больных, находящихся в коме в связи с каким-либо критическим состоянием, показывает, что лечащие врачи часто не распознают элементарных расстройств механики дыхания у больного, принимая патологически экспрессивный характер дыхательных движений за норму. Чаще всего «просматривают» так называемое парадоксальное дыхание, когда у больного нарушается синхронность реберного и диафрагмального компонентов дыхания или полностью выпадает диафрагмальный компонент. Именно в подобных ситуациях у больного возникает форсированное реберное дыхание, создающее для малоосведомленного наблюдателя иллюзию высокой дыхательной активности и, следовательно, адекватности дыхательной функции в целом. Тонкие неврологические механизмы возникновения описанного варианта дыхательных расстройств, характеризующихся торможением диафрагмального звена, изучены недостаточно. Ясно, однако, что они являются следствием биохимического или анатомического поражения структур среднего мозга. Развитие при этом форсированной реберной дыхательной активности следует рассматривать как выражение компенсации функции. Подобный вариант нарушения дыхания не всегда является показанием к ИВЛ. Такая необходимость возникает лишь при сочетании его с выраженной комой. Наиболее часто торможение диафрагмальной активности наблюдается как рефлекторное явление при перитоните у больного в ясном сознании и в этих случаях не требует ИВЛ. Опытный врач обязан различать эти варианты дыхательных расстройств. Апнеистический вариант дыхания характеризуется паузами в конце инспираторной фазы. Такое дыхание нетипично для комы, но если наблюдается, то свидетельствует о возможном поражении в зоне моста мозга. Атаксический вариант дыхания характеризуется нерегулярными альтернациями по частоте и по глубине. Обычно он указывает на депрессию ствола мозга и, как правило, требует искусственного поддержания дыхательной функции, т. е. ИВЛ.
Подобные нарушения дыхательной функции, являющиеся следствием первичного поражения зон мозга, редко возникают в описанной классической форме. Однако они, как правило, развиваются у больных с поражением мозга при выраженном набухании его или при глубоких метаболических энцефалопатиях и предшествуют полному прекращению дыхания. Несколько другая картина нарушения дыхательной активности наблюдается при передозировке седативных веществ. Диффузная депрессия ствола проявляется постепенным снижением частоты дыхания и его глубины без каких-либо других отклонений. Глубокое медикаментозное угнетение дыхания, как правило, ведет к развитию гипоксии мозга. Справедливость требует подчеркнуть, что описанные варианты расстройств дыхательной функции в клинической практике наблюдаются не столь часто. Это связано с тем, что показания к ИВЛ, требующей, как правило, выключения спонтанного дыхания, определяются прежде всего наличием гипоксии (гипоксемии), а не расстройствами механики дыхания. Чаще всего к моменту возникновения дыхательных расстройств гипоксия достаточно выражена и ИВЛ уже начата. Исследование глаз — очень важный элемент в оценке комы. Как уже отмечалось, одинаковые по величине, нормально реагирующие зрачки свидетельствуют о том, что кома не имеет связи с деструкцией мозга и обусловлена скорее всего метаболическими или токсическими причинами. Если зрачки одинаковых размеров, но не реагируют на свет, то больше оснований предполагать структурные или глубокие токсико-метаболические причины комы. Выраженная неравномерность зрачков, особенно если она сочетается с различной реакцией на свет, является прямым указанием на одностороннее поражение мозга. Расширение и фиксация зрачка на одном глазу могут указывать на вероятность ущемления мозга в тенториальном отверстии на стороне большего зрачка. Такое ущемление приводит к сдавлению III черепного нерва. Для представления о функциональной интегрированности ствола мозга важно оценить рефлекторные сопряженные движения глазных яблок. Полное их отсутствие указывает на глубокую кому и реальную возможность прекращения дыхания или по крайней мере на его возможную депрессию. В случае глубокого отравления барбитуратами (или другими седативными, препаратами) глазные рефлексы при калорической пробе могут отсутствовать. Однако это не исключает возможности пробуждения больного через сутки или позже. Отсутствие глазодвигательных рефлексов при немедикаментозной коме — очень неблагоприятный прогностический признак. Реакции скелетных мышц можно оценивать по характеру мышечных ответов на болевое раздражение, например на давление в области надбровных дуг, угла нижней челюсти, на грудину или постукивание молоточком между пальцами. Ответы могут быть различными — от адекватной двигательной или речевой реакции на раздражение до полного отсутствия реакций. Промежуточными вариантами могут быть гримасы и попытки движений (сгибание рук, разгибание ног), признаки: децеребрации в виде ротационных движений конечностей и др. В части случаев при коме не возникает необходимости в поясничной пункции. Однако она должна быть выполнена при; тяжелой черепно-мозговой травме, геморрагическом инсульте, у инфекционных больных, а также в случае комы, развивающейся на фоне солитарных или распространенных нагноительных процессов (абсцесс, эмпиема плевры и т. д.). Иногда бывает целесообразно пунктировать субдуральное пространство, чтобы определить степень развития отека мозга.
Диагностика отека мозга. У больных, находящихся в крайне тяжелых (критических) состояниях, кома, как правило, развивается постепенно и определение ее конкретной причины редко вызывает затруднения. Наиболее часто коматозные состояния в подобных случаях обусловлены ишемией и гипоксическим поражением мозга, интоксикацией, расстройством водно-электролитного баланса организма, нарушением осмоляльности и КОД в сосудистом, интерстициальном пространствах, внутри клеток. Нередко эти причины сочетаются и четко разграничить их невозможно. Различные варианты поражения мозга — травматического, метаболического, инфекционного, опухолевого, постишемического, непосредственно гипоксического характера часто сопровождаются развитием отека мозга. В связи с этим основной терапевтической проблемой становится ликвидация самого отека. Различают два варианта отека мозга при коме — цитотоксический и вазогенный. Иногда эти варианты сочетаются или переходят один в другой [Thurel С. et al., 1983]. При цитотоксическом отеке мозга основной механизм связан с расстройством клеточного метаболизма и нарушением транспорта ионов через клеточные мембраны. Первоначально процесс выражается в потере клеткой электролитов, главным образом К+, и замене его Na+ из внеклеточного пространства. При гипоксических состояниях пировиноградная кислота восстанавливается до молочной [Laborit H., 1970] и нарушается деятельность редокс-системы, ответственной за выведение Na+ из клетки,— возникает блокада так называемого натриевого насоса. Мозговая клетка, содержащая повышенное количество Na+, начинает усиленно накапливать воду — появляется отек мозга. Содержание лактата свыше 6—8 ммоль/л в оттекающей от мозга крови всегда свидетельствует об его отеке. Цитотоксическая форма отека мозга всегда генерализована. Она распространяется практически на все отделы, включая стволовые, поэтому довольно быстро начинает проявляться нарушением витальных функций. Основой вазогенного отека мозга являются, как правило, поражение сосудистой стенки и нарушение гематоэнцефалического барьера. Имеется множество факторов, приводящих к повреждению сосудистой стенки,— прежде всего инсульт, а также травма мозга, опухоль его и др. В результате поражения стенки сосудов плазма крови вместе с содержащимися в ней электролитами и белками покидает сосудистое пространство и пропитывает периваскулярные зоны мозга.
Таким образом, цитотоксический отек — это преимущественно набухание клеточных структур мозга, а вазогенный — мозаичное, неравномерно выраженное накопление плазмоподобной жидкости в интерстициальном пространстве мозга. Однако различия вариантов отека мозга имеют лишь теоретический интерес, так как в большинстве случаев трудно отличить один вариант от другого [Арутюнов А.И., 1960]. При гипоксии мозга любого происхождения, а также при элементарной ишемии его преобладает, естественно, цитотоксический вариант отека мозга. Процесс характеризуется набуханием клеток мозга с последующим повреждением их внутренних структур, в том числе митохондрий [Fujimoto Т. et al., 1976; Hossmann K., 1976]. В первой фазе развития процесс происходит при неповрежденном гематоэнцефалическом барьере и связан прежде всего с расстройством деятельности клеточной натриевой помпы: накопление в клетке L— и аминокислот и повышение осмоляльности способствуют задержке воды в ней — возникает набухание клетки. Во второй фазе постгипоксического, а также ишемического повреждения развивается сосудистый компонент, нарушается гематоэнцефалический барьер. В результате часть плазменных белков покидает сосудистое русло и перемещается в интерстициальное пространство, увлекая за собой воду. Концентрация лактата в оттекающей от мозга крови может в определенной степени быть дифференциально-диагностическим показателем при цитотоксическом и вазогенном вариантах отека мозга. При метаболическом повреждении мозга и, следовательно, истинном набухании клеток содержание лактата в крови всегда высокое. В диагностике отека мозга как причины комы большую роль играет исследование давления цереброспинальной жидкости (при спинальной пункции), которое отражает величину внутричерепного давления [Салалыкин В.И., Арутюнов А.И.,. 1978]. В норме давление цереброспинальной жидкости не должно превышать 120—180 мм вод. ст. Повышение его до 400— 500 мм вод. ст. свидетельствует об увеличении внутричерепного давления, которое может быть обусловлено отеком мозга (или каким-либо объемным образованием, например опухолью). В ряде случаев давление цереброспинальной жидкости достигает 800—1000 мм вод. ст. С клинической точки зрения понятия «отек мозга» и его «набухание» почти равнозначны. Во всяком случае различия между ними определить всегда очень трудно [Двитницкий-Рыжов Ю.Н., 1964; Смирнов А.В., 1969], поэтому клиницисты часто пользуются термином «отек—набухание головного мозга» [Арутюнов А. И., 1960].
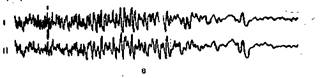
Электроэнцефалография. Для оценки функции мозга при коматозных состояниях часто используют электроэнцефалографию (рис. 7.1, 7.2). Поскольку этот метод отражает электрическую активность мозга (и в лучшем случае можно получить представление об ее изменениях в различных зонах мозга), изменения характера ЭЭГ нельзя считать специфичными для комы. Электрокардиографическая картина часто не совпадает с состоянием функциональной активности отдельных структур головного мозга, поэтому нередко можно получить, например, сходные характеристики кривых ЭЭГ при коме наркотического происхождения и при глубокой гипоксической коме. Тем не менее электрокардиография как метод диагностики имеет большое значение в оценке комы, так как облегчает диагностику и способствует оценке динамики комы (см. рис. 7.2). Однако наша практика показывает, что прогностическое значение ЭЭГ при коме невелико. Это положение может быть иллюстрировано следующим наблюдением. Больной С., 62 лет, поступил в клинику в связи с желудочным кровотечением. Проведен комплекс мероприятий, направленных на восстановление ОЦК и поддержание кровообращения. После стабилизации состояния выполнена гастроскопия. Установлено наличие на задней стенке желудка гемангиомы, являющейся источником кровотечения. Два года назад больной подвергся оперативному вмешательству в связи с желудочным кровотечением. Операция закончилась гастротомией и прошиванием кровоточащих сосудов. Радикальная операция оказалась невозможной из-за анатомических особенностей и сосудистых аномалий. При гастроскопии признаков продолжающегося кровотечения не обнаружено. Через 2 сут началось повторное массивное желудочное кровотечение, по поводу которого больной немедленно взят в операционную. В момент транспортировки возникла асистолия и развилась клиническая смерть. Немедленно применен комплекс реанимационных мероприятий, включавший наружный массаж сердца, ИВЛ и последующую массивную гемотрансфузию; кровообращение удалось восстановить. Произведены гастротомия и прошивание конгломерата кровоточащих сосудов на задней стенке желудка. После операции больной оставлен на продленной ИВЛ, но добиться пробуждения его не удалось. Состояние оценено как коматозное в связи с перенесенной клинической смертью, геморрагическим шоком, гиповолемией, постгеморрагическим ДВС-синдромом. Кома выражалась в полном отсутствии сознания, арефлексии, сопровождалась мышечной гипотонией. Однако наблюдалась нерегулярная спонтанная дыхательная активность, требовавшая медикаментозной синхронизации с использованием мышечных релаксантов. Через 4 сут спонтанное дыхание прекратилось полностью и отпала необходимость в медикаментозной синхронизации. Кома в этот момент оценена как ареактивная (coma cams no Bozza Marrubini). Медленноволновая дельта-активность на ЭЭГ с редкими всплесками ее в виде разрядов, наблюдавшаяся в первые 4 сут, постепенно сменилась полным отсутствием колебаний практически во всех зонах мозга. В течение 2 нед состояние было крайне тяжелым. На фоне продолжавшейся ИВЛ, интенсивной инфузионной и гемотрансфузионной терапии, противоотечной терапии, а также медикаментозного лечения (применение дофамина, нитролингвала, стероидных гормонов, массивная антибиотикотерапия, иммунокоррекция и др.), СДРВ и тяжелого ДВС-синдрома, почечной недостаточности, метаболического постгипоксического алкалоза многократно возникали эпизоды желудочного кровотечения, всякий раз ухудшавшие общее состояние и усиливавшие проявления полиорганной недостаточности. В результате нескольких попыток удалось эмболизировать чрезаортальным способом конгломерат аномальных артериальных стволов в зоне селезеночной и левой желудочной артерий. Кровотечение прекратилось, общее состояние стабилизировалось, гемодинамика улучшилась. Хотя наркотических анальгетиков и релаксантов в этом периоде больной не получал, он продолжал оставаться в состоянии сверхглубокой комы. Спонтанная дыхательная активность полностью отсутствовала. Зрачковые рефлексы не отмечались, но зрачки были расширены лишь незначительно. При неврологическом исследовании сухожильные и мышечные рефлексы не вызывались. Ежедневно на ЗЭГ фиксировалось практически полное отсутствие электрической активности мозга. Это давало основание, учитывая другие проявления комы, оценивать прогноз как крайне неблагоприятный. Через несколько дней после полного прекращения кровопотери состояние удалось стабилизировать путем применения сложного комплекса мероприятий, направленных на нормализацию внутренней среды организма, волемии, осмоляльности плазмы, КОС, гемодинамики, выделительных и других функций. Проводилась также борьба с постгипоксическим отеком мозга (диуретические средства, многократные сеансы гемофильтрации). Продолжалась ИВЛ через трахеостому. Через 1 нед после эмболизации сосудов и полного прекращения кровопотери появились низкие сухожильные рефлексы и слабая двигательная реакция на болевые раздражения. Еще через 2 дня стало проявляться спонтанное дыхание, которое оставалось неадекватным. Этому сопутствовало улучшение электроэнцефалографической картины: появившаяся вначале медленноволновая дельта-активность сменилась а -подобной и вскоре ЭЭГ нормализовалась. Больной начал проявлять элементарные признаки пробуждения — открывать глаза и по инструкции двигать конечностями. Через 42 дня от начала ИВЛ, после недельного периода тренировок спонтанного дыхания удалось полностью отключить респиратор и восстановить адекватную дыхательную функцию. К этому моменту полностью восстановились сознание и «ориентировка в окружающем, но отмечалась выраженная психическая астения. Через 68 дней больной в удовлетворительном состоянии переведен в санаторное учреждение для окончательной реабилитации.
Рис. 7.1. Динамика ЭЭГ (8 отведений) при прогрессирующей коме. а —исходная ЭЭГ, больной в сознании; б— сознание утрачено, дыхание не нарушено, рефлекторная активность сохранена; в — ареактивная кома, ИВЛ.
Рис. 7.2. Варианты нарушений ЭЭГ у больных в состоянии прекомы и комы. I — лобно-затылочное; II — теменно-затылочное отведение; а— преобладает бета-активность. Начальные стадии острой печеночной недостаточности. Больной в сознании. беспокоен; б — преобладает а -активность, редкие 8-волны. Острая почечная недостаточность. Больной в сознании заторможен: в — переход бета-активности в преобладающую 6-активность. Развитие токсико-инфекционного шока, кома; г — преобладающая делта-активность с примесью других видов активности; д — непрерывная спайковая активность на фоне 6-активности. Эпизодически появляются зоны сниженной почти до изоэлектрической линии активности длительностью около 1 с и более. Кома, сохранена болевая реакция в виде экстензорных судорог; е — изоэлектрическая линия биоэлектрическая активность практически отсутствует. Ареактивная кома.
Компьютерная томография. С внедрением в клиническую практику аксиальной компьютерной томографии появилась возможность прямой неинвазивной диагностики отека — набухания головного мозга, а также возможность наблюдать его динамику и результаты лечения. Для зон отека мозга характерно снижение плотности мозгового вещества из-за повышения содержания воды в сочетании с расширением желудочков мозга.
7.5. Клинические варианты комы
Постишемическая (постгипоксическая) кома. В настоящее время в зарубежной литературе варианты повреждения мозга и комы, возникающей после прекращения кровообращения (например, в результате остановки сердца), принято называть глобальной церебральной ишемией — аноксией [Safar P. el al., 1978]. Социально-экономическое и клиническое значение этого явления вытекает из того факта, что большая часть больных, реанимированных после остановки сердца, умирают в результате вторично развившейся смерти мозга, а более чем у 20% выживших наблюдаются тяжелые перманентные нарушения мозговой функции [Bell J. A., Hodgson L. Н., 1974]. Пессимистическая концепция относительно возможности восстановления функции мозга и выживания организма после остановки сердца более 4—6 мин в настоящее время считается не оправдавшейся [Гурвич А.М., 1985; Safar P. et al., 1978]. В литературе приводятся свидетельства возможности полного восстановления и выживания даже после более длительной остановки сердца, хотя подобные случаи не часты. По-видимому, это в значительной степени связано с усовершенствованием методов сердечно-легочно-мозговой резусцитации [Safar P. et al., 1978J, применением специальных методов лечения гипоксии мозга, монито-рирования функций и адекватного общего интенсивного лечения. В результате в клиники и больницы стали периодически поступать больные, которым требуется длительное и сложное лечение в связи с постгипоксической комой и отеком мозга, сопровождающимися недостаточностью других функций. Изменения в мозге после остановки кровообращения, прекращения дыхания и применения методов реанимации всегда многообразны и комплексны. Они являются результатом сложения последствий первичного «глобального инсульта» и вторичных постишемических изменений, которые включают в себя динамическую многофокусную гипоперфузионную или гипоксическую гипоксию и гиперметаболизм мозга [Fischer E., 1973; Lind В. et al., 1975]. При внезапном тотальном прекращении мозгового кровообращения уже через 10 с истощаются запасы О2 в мозге и наступает потеря сознания. Снижение уровня глюкозы, а также прекращение низкоэнергетического анаэробного метаболизма происходит в течение последующих 4—6 мин. Затем окончательно исчерпываются запасы высокоэнергетических фосфатов (АТФ). В результате в течение 5 мин прекращаются все процессы, требующие энергии, что приводит к прекращению специфической деятельности нейронов. Дефицит внутриклеточной энергии обусловливает прекращение деятельности натриевого насоса, задержку Na+ в клетке и возникновение вследствие этого внутриклеточной гиперосмоляльности и отека (набухания) клетки. Несколько позднее нарушается также функция гематоэнцефалического барьера, что приводит к интерстициальному отеку мозга и множественным микрогеморрагиям [Hossmann К.A., Kleihenes P., 1973]. Важно подчеркнуть, что общего гиперосмоляльного синдрома (по осмоляльности плазмы крови) на первых этапах развития постишемической комы, как правило, не бывает. Он может развиться на более поздних этапах заболевания, когда присоединяется полиорганная недостаточность (например, почечная недостаточность и задержка натрийуреза или азотемия) или возникают ятрогенные изменения содержания Na+ в плазме. Все описанные нарушения водного баланса в мозге, обусловливающие его отек, связаны с клеточной гиперосмоляльностью, которая обычно не отражается на содержании Na+ в плазме. Полная остановка кровообращения в течение 5—7 мин приводит к многочисленным гистологическим изменениям, включающим рассеянный некроз большого числа нейронов. Возобновление кровообращения через 5—10 мин после его прекращения приводит к гиперемии мозга и последующему повышению внутричерепного давления. Однако вследствие ДВО синдрома, сладжирования клеток крови и увеличения размеров, нейронов и эндотелиальных клеток общий объем мозгового кровотока бывает низким. Регуляция мозгового кровотока через изменения Рсо2 прекращается. Таким образом, повышение внутричерепного давления, как правило, развивающееся через 30—60 мин после возобновления кровообращения, является: следствием увеличения критической массы мозга и снижения мозгового перфузионного давления. При недостаточности мозгового кровообращения (среднее артериальное давление около 50 мм рт. ст.), т. е. при неполной временной ишемии мозга, сохраняется ауторегуляция мозгового кровотока, временно поддерживающая мозговое кровообращение на удовлетворительном уровне при сохраненном сознании. Если среднее артериальное давление продолжительное время: остается на уровне ниже 50 мм рт. ст., то может возникнуть делирий или кома [Safar P., 1983]. При среднем артериальном давлении ниже 30 мм рт. ст. мозговой кровоток составляет не более 20% нормального и выживание нейронов становится сомнительным. Однако депрессия ЦНС (по неврологическим признакам) не коррелирует с ОЦК и СВ. Достаточно хорошая: корреляция прослеживается между депрессией ЦНС и уровнем мозгового перфузионного давления крови, т. е. по разности среднего артериального и внутричерепного давлений. В случае сопутствующей гипоксемии снижение транспорта О2 может оказаться критическим, даже если гипотония умеренная. Таким образом, вторичная гипоксемия (или травма) может сделать продолжительный гиповолемический шок необратимым. В то же время поддержание адекватного мозгового кровообращения существенно увеличивает вероятность выживания при шоке [Kovach A., Sandor P., 1976]. Нормальный мозг более устойчив к гипоксемии, чем к ишемии. Если РаО2 снижается до 30 мм рт. ст. или даже ниже в условиях нормального перфузионного давления, то в мозге развивается лактат-ацидоз. Некроза нейронов в этих условиях не происходит, если не развивается дальнейшее снижение РаО2 или если не присоединяется гипотензия [Safar P., 1983]. Гипоксемия практически всегда имеет место у больного в коматозном состоянии. Она может возникать вследствие аспирации (или какой-либо другой причины перенесенной больным асфиксии), шокового легкого или подавления центральной регуляции дыхания из-за отека мозга. У ряда больных возникает нейрогенный отек легких, природа которого мало изучена. Предположительно нейрогенный отек легких может развиться вследствие массивного выброса катехоламинов, приводящего к переполнению легочного сосудистого русла. Этому способствуют внутричерепная гипертензия, гипоксия мозга и нарушение функции гипоталамуса [Thedore J., Robin E., 1975]. Лечение. Этиологическая неспецифичность коматозного состояния, возникающего в большинстве случаев как результат анатомического нарушения клеточных структур мозга или как следствие глубоких расстройств метаболизма клеток, например гипоксии, обусловливает необходимость синдромного принципа ведения коматозного больного. Предусматривается одновременная или поэтапная коррекция основных соматических расстройств. Бесполезно, например, пытаться медикаментозными средствами бороться с комой, если не устранен СДРВ, определяющий гипоксемию, или гипергликемия при диабетической коме. В связи с этим целесообразно привести примерный перечень лечебных мероприятий общего характера. По-видимому, они должны проводиться в следующей последовательности. 1. Предупреждение обструкции дыхательных путей и обеспечение эффективности дыхания (использование различных положений тела или применение воздуховодов, туалет глотки и трахеи, увлажнение дыхательной смеси и т. д.). 2. Точное определение степени оксигенации крови и оценка эффективности оксигенирующей функции легких. При оценке степени кислородной недостаточности важно установить не столько абсолютный уровень оксигенации артериальной крови, сколько зависимость оксигенации от кислородного режима: если при спонтанном дыхании 100% кислородом Ра02 не превышает 100 мм рт. ст., то больной нуждается в ИВЛ в связи с СДРВ. Для ИВЛ используют смеси О2 (50—60%) с воздухом. Если ИВЛ предполагается как кратковременная мера поддержания оксигенации организма, то можно ограничиться назо- или оротрахеальной интубацией, но при длительной ИВЛ целесообразна трахеостомия. Установление точной причины комы (обследование больного) и последующие лечебные мероприятия, в том числе оперативное вмешательство, целесообразны лишь после того, как обеспечена эффективность дыхания и кровообращения. 3. Мониторирование и поддержание оптимального уровня системного кровообращения как единственная возможность обеспечить адекватный мозговой кровоток. Возможны различные методы мониторирования и ориентировочного обследования: от контроля артериального давления (оптимальное среднее 90— 110 мм рт. ст.) и ЦВД до определения СВ, внутрисердечного давления и ОЦК. Дефицит ОЦК корригируют путем инфузии плазмоэкспандеров, плазмы и гемотрансфузии. Нормоволемические варианты гипотензии требуют лечения дофамином. При гипертоническом кризе показано применение 150—300 мкг клонидина (гемитона). 4. Поддержание нормального водно-электролитного и белкового баланса организма. Важно подчеркнуть, что нарушение содержания электролитов и концентрации протеинов в плазме крови, определяющих осмоляльность внеклеточной среды и КОД плазмы, является предпосылкой отека интерстициального пространства, а затем и набухания клеток мозга. Необходим также контроль уровня шлаков в крови. Накопление мочевины способствует увеличению осмоляльности (но не тоничности) плазмы и интерстициального пространства и усиливает отек мозга. Борьба с расстройствами водно-электролитного баланса может осуществляться с помощью диуретических средств, путем оптимизации водной нагрузки и выбора инфузионных сред, а также применением ультрафильтрации плазмы и гемофильтрации. В ряде случаев расстройства электролитного баланса у больных в коматозном состоянии развиваются стремительно. Иногда это выражается в существенном повышении уровня Na+ в плазме. Мы наблюдали больных, у которых концентрация Na+ плазмы достигала 180—186 ммоль/л при осмоляльности плазмы выше 400 мосмоль/кг. Прирост осмоляльности внеклеточной среды выше двойной концентрации Na+ был обусловлен, как правило, высоким уровнем мочевины и сахара крови, суммарная концентрация которых в ряде случаев составляла 40— 60 ммоль/л. Основные патогенетические механизмы повышения концентрации Na+ в плазме связаны, с одной стороны, с задержкой, Na+ на уровне почек у больных в критическом состоянии, с другой — с перегрузкой организма Na+. При условии ограничения или полного исключения введения натриевых растворов (изотонический раствор хлорида натрия, декстраны в сочетании с Na+, растворы аминокислот, содержащие Na+, раствор Рингера—Локка и др.), введение которых в условиях задержки натрия совершенно обоснованно представляется нецелесообразным, главными источниками поступления Na+ в организм (помимо других, менее значительных) являются растворы оксибутирата натрия и натриевых солей антибиотиков. Как правило, эти источники ускользают от внимания врача и повышение концентрации Na+ в крови нередко вызывает у него недоумение. Между тем больной в состоянии комы, находящийся на ИВЛ, может получить в сутки до 20—40 г оксибутирата натрия и несколько граммов антибиотиков. При нормальной функции почек и нормальном натрийурезе этот избыток Na+ быстро элиминируется. При скрытой почечной недостаточности, вторичном постстрессовом альдостеронизме избыток Na+ в организме задерживается. В последние годы пересматриваются позиции относительна целесообразности традиционного и принятого во всем мире внутривенного введения гидрокарбоната натрия в схеме классической сердечно-легочной реанимации. Н. P. Muster (1987) рекомендует воздерживаться от применения этого препарата, даже если ацидоз документирован. Автор установил, что в тех случаях, когда осмоляльность плазмы выше 350 мосмоль/кг, из числа больных, получивших гидрокарбонат натрия, после пережитой сердечно-легочной реанимации погибает 90%. Вот почему мы настаиваем на применении различных по временным интервалам вариантов мониторирования уровня электролитов плазмы у больных в критическом состоянии, поскольку борьба с отеком мозга и комой невозможна, если развился гиперосмоляльный синдром. У некоторых больных целесообразно контролировать электролиты плазмы крови дважды в сутки и определять экскрецию их в суточной моче. Мы надеемся, что после знакомства с элементами этой проблемы читатель понимает также вредоносный эффект внутривенного введения гипертонических растворов для так называемой борьбы с отеком мозга, столь широко применявшийся в недавние годы. Больной в состоянии комы нуждается прежде всего в нормализации водно-электролитного баланса методами, упомянутыми выше. Лишь в отдельных случаях следует вводить белковые препараты (альбумин, плазма) для повышения КОД. Однако если при этом уровень альбумина и белков крови в целом не повышается (по крайней мере на половину введенной дозы белков), то это значит, что поражение сосудистой стенки в ходе развития критического состояния и полиорганной недостаточности уже привело к нарушению функции удержания белка, в результате чего сосуды стали патологически проницаемы для белков. Это соответственно ведет к усилению интерстициального отека мозга, легких и других органов. В подобных случаях лечение с использованием белковых препаратов целесообразно прекратить. 5. Поддержание нормальной температуры тела. Применяют антипиретики (например, ацетилсалициловую кислоту в дозе 10—20 мг/кг), вазодилататоры (аминазин по 0,2—0,5 мг/кг), поверхностное охлаждение. 6. Седативная терапия. При двигательном возбуждении целесообразно вводить внутривенно бензодиазепины (диазепам, седуксен, валиум) в дозе 0,1—1,0 мг/кг. При судорожном припадке вводят барбитураты (5—10 мг/кг), при экстензорных спазмах — бензодиазепины. Если после введения барбитуратов и бензодиазепинов судороги и спазмы не прекращаются, то применяют миорелаксанты. 7. Синхронизации дыхательной активности больного с аппаратом достигают по обычной методике, предусматривающей гипервентиляцию, последовательное применение бензодиазепинов, оксибутирата натрия, морфина, фентанила, барбитуратов и кураризации.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.118.95 (0.071 с.) |