Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Герпесвирусные инфекции лососевых
Возбудители. Герпесвирусы выделены от лососевых рыб в Северной Америке (HPV и SHV) и Японии (NeVTA, OMV, CSTV и YTV). Выделенные вирусы подразделяют на две группы: североамериканские изоляты (менее патогенные и не обладающие онко-генными свойствами) и японские изоляты (напротив, обладающие большей патогенностью и способностью вызывать папилломы у выживших после заражения рыб). Помимо этого, вирусы двух данных групп различаются между собой в антигенном отношении и по строению генома. Вирионы всех изолятов имеют примерно одинаковую морфологию и размер 150—250 нм. К вирусам чувствительны постоянные линии клеток лососевых RTG-2, RTF-1, KF-1, CHSE-214 и др. Цитопатогенное действие в культуре клеток характеризуется образованием симпластов, в ядрах инфицированных клеток обнаруживают включения. Эпизоотология. HPV был выделен в одном из рыбопитомников США в начале 1970-х годов от производителей радужной форели в связи с наблюдавшейся среди них посленерестовой гибелью. Вирус патогенен для мальков и сеголетков радужной форели в возрасте до 4 мес только при внутрибрюшинном введении, вызывая заболевание и значительную гибель при температуре воды 6—10 °С. Годовики нерки были устойчивы к заболеванию. Японские штаммы вируса, выделенные от симы (OMV), патогенны для молоди лососевых. После заражения месячных мальков вирусом через воду при температуре 10—15 °С нерка оказалась наиболее чувствительной (гибель 100 % рыб). Менее чувствительными были сима и кета (гибель соответственно 87 и 83 % рыб) и еще менее чувствительными — кижуч и радужная форель (гибель соответственно 39 и 29 % рыб). Вирус выделяли из овариальной жидкости производителей и гонад неполовозрелой молоди, в связи с чем предполагается возможность вертикальной передачи инфекции. Клинические признаки и патогенез. У производителей лососевых клинические признаки заболевания не выражены. При искусственном заражении молоди инкубационный период составляет 14—33 дня. У больных сеголетков радужной форели из анального отверстия выделяются тонкие слизистые шнуры. Затем развиваются экзофтальм, увеличение брюшка. Рыба становится вялой, не принимает корм, опускается и лежит на дне. У части рыб отмечают потемнение кожных покровов, анемию жабр, иногда — кровоизлияния в глазное яблоко. Содержание незрелых эритроцитов в периферической крови возрастает до 10—13 %, гематокрит падает до 12 %.
В брюшной полости присутствует большое количество асцит -ной жидкости, внутренние органы бледные, печень пятнистая, пищеварительный тракт свободен от пищевых масс. Аналогичные изменения происходят у молоди лососевых после заражения ее вирусом симы. В опытах на симе, кижуче и кете опухоли появились более чем у 60 % выживших рыб через 130—250 дней после заражения вирусом OMV. Они находились на голове, но в одном случае опухоль была обнаружена в почках. Гистологически поверхностные опухоли не отличались от папиллом, регистрируемых у больных рыб в естественных водоемах. Вирусные частицы не были обнаружены в тканях опухолей при электронно-микроскопическом исследовании, но при первичном культивировании опухолевых клеток вирус был реизолирован. Меры борьбы. Для профилактики герпесвирусных инфекций лососевых рекомендуется обрабатывать оплодотворенную икру иодофорами, а в неблагополучных по заболеванию зонах подвергать подаваемую в бассейны воду ультрафиолетовому облучению.
ВИРУСНЫЕ БОЛЕЗНИ ОСЕТРОВЫХ
За рубежом у осетровых рыб выявлено 10 различных вирусов. Четыре из них — аденовирус (WSAV), иридовирус — (WSIV) и два герпесвируса (WSHV-1 и WSHV-2) у белого осетра (в США) и один иридовирус (RSIV) - у русского осетра (в Бельгии) вызывают тяжело протекающие заболевания у молоди. Возбудители. Вирусы, выделенные от белого осетра в США, являются ДНК-геномными. Наиболее опасными и широко распространенными агентами из четырех считаются иридовирус (WSIV) и герпесвирус-2 (WSHV-2). Герпесвирусы легко выделяются на культурах клеточных линий WSS-2, WSSK-1, WSGO. Иридовирус выделяется на культуре клеток с трудом, аденовирус выделить на клеточных культурах не удается. Иридовирус (RSIV) от русского осетра обнаружен при электронной микроскопии в виде скопления частиц диаметром 283 нм. Они несколько крупнее, чем вирионы WSIV. Эпизоотология. Заболевания развиваются весной, в начале лета и осенью при температуре воды 9—20 °С и осложняются миксо-бактериозом и протозойными инвазиями. Стресс является фактором, провоцирующим вспышки эпизоотии, которые сопровождаются гибелью 80—95 % выращиваемой молоди белого осетра в США. Рыбы старшего возраста не болеют, но являются вирусоносителями. Дикие производители считаются главным источником возбудителей инфекций. Вирусы передаются через воду и возможен вертикальный путь передачи вирусов от производителей потомству.
Заболевание молоди русского осетра, вызванное иридовирусом RSIV, вспыхнуло в одном из хозяйств Бельгии после завоза молоди и икры. Гибель четырехмесячной молоди достигала 50 %. Клинические признаки и патогенез. У больных рыб отмечают анорексию, истощение, угнетение, бледность жабр. Для иридо-вирусного поражения характерно увеличение брюшка и покраснение жучек. Вирус поражает эпидермис жабр и ротоглотки. Гер-песвирус локализуется в эпидермисе различных участков тела, в мышечной стенке, в жабрах. У заболевших рыб наблюдают гиперемию и изъязвления на вентральной части рострума, в области рта и ануса, очаговые скопления слизи на голове и грудных плавниках. При поражении аденовирусом у молоди отмечают истощение, бледность печени, отсутствие корма в кишечнике. Молодь русского осетра, пораженная RS1V, не реагирует на раздражители, отказывается от корма, приобретает бледную окраску тела, плавает в вертикальном положении, теряет равновесие и погибает. В жабрах больных рыб обнаруживают мелкие кровоизлияния. Диагноз. Его ставят на основании клинических и эпизоотических данных и подкрепляют результатами вирусологических исследований. Гистологические исследования позволяют выявить наличие большого числа гипертрофированных базофильных клеток в эпидермисе ротоглотки. Меры борьбы. Они сводятся к созданию оптимальных условий выращивания для рыбы первого года жизни. При отсутствии стрессовых воздействий даже инфицированная молодь белого осетра, но без клинических признаков заболевания выпускается в природные водоемы Северо-Запада США.
ЛИМФОЦИСТИС
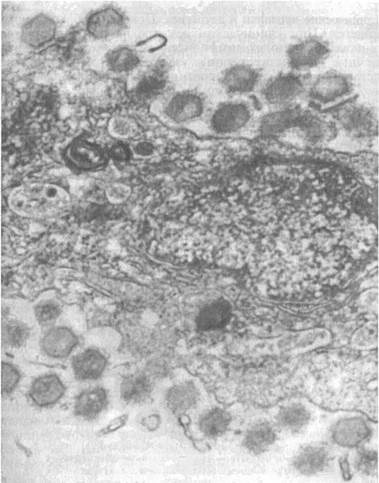
Лимфоцистис (Lymphocystis disease, LD) — вирусная болезнь морских и пресноводных костистых рыб, характеризующаяся гипертрофией соединительнотканных клеток кожи и иногда других тканей. Возбудитель. Возбудитель лимфоцистиса имеет икосаэдри-ческую форму частиц (вирионов). Их диаметр в зависимости от вида рыб колеблется от 200 до 300 нм. Это крупный ДНК-геномный вирус, относящийся к семейству иридовирусов (рис. 14). Вирус репродуцируется в цитоплазме клеток. Его вирионы имеют внешнюю липидосодержащую оболочку. Снаружи на оболочке имеются отростки, в состав которых входят мукополиса-хариды. К вирусу чувствительны постоянные клеточные линии рыб BF-W, BF-2, МСТ и другие, в которых он размножается при температуре 15—25 °С. Вызываемый вирусом цитопатический эффект развивается медленно (до 30 дней) и проявляется в виде увеличения диаметра инфицированных клеток до 50—70 мкм. Вирус лимфоцистиса чувствителен к эфиру и глицерину, кислоте (рН 3,0), но устойчив к замораживанию-оттаиванию и обработке ультразвуком в течение 30—90 с. Быстро инактивируется при 25 °С, но хорошо сохраняется при 4 °С и глубоком замораживании (до минус 70 0С).
Рис. 14. Возбудитель лимфоцистиса
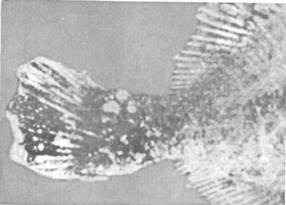
Эпизоотология. Болезнь распространена очень широко и отмечена более чем у 150 видов рыб, из которых представители отрядов окунеобразных и камбалообразных составляют соответственно 75 и 10 %. Она наблюдается в Балтийском, Баренцевом, Чукотском, Беринговом, Японском и Эгейском морях. Заболеваемость лимфоцистисом обычно низкая, но иногда может быть значительной. Так, при исследовании обыкновенного робало (Centropomus undecimalis) размером 12—60 см из оз. Мара-канбо (Венесуэла) заболевание отмечали у 36 % выловленных рыб. В Осло-фьорде он был зарегистрирован летом у 1—10 % особей европейской камбалы (Platichthys flesus), а зимой — у 57 % этих рыб. Клинические признаки и патогенез. Поведение больных рыб не изменяется. При клиническом осмотре на поверхности тела и плавниках пораженных лимфоцистисом рыб можно обнаружить одиночные или множественные узелки (рис. 15). Каждый узелок представляет собой инфицированную вирусом клетку соединительной ткани кожи, диаметр которой увеличился в десятки раз (до 2 мм). Они проступают через покрывающий их эпителий, хорошо видны невооруженным глазом и часто образуют гроздепо-добные скопления, напоминающие ягоды малины. Вокруг них может отмечаться слабая воспалительная реакция. При сильном поражении такие клетки могут покрывать более половины поверхности тела больной рыбы. Иногда их находят также в глазах и внутренних органах. Под световым микроскопом видно, что клетки имеют овальную форму, у них увеличены ядро и ядрышко, по периферии цитоплазмы располагаются включения. Снаружи каждая клетка окружена толстой гиалиновой оболочкой.
Рис. 15. Камбала, пораженная лимфоцистисом
Гибели рыб от лимфоцистиса, как правило, не наблюдают. Гипертрофированные клетки разрушаются, и рыба выздоравливает, но может заболеть вновь. Диагноз. Его ставят на основании клинических, эпизоотологи-ческих данных, электронно-микроскопических и вирусологических исследований. Меры борьбы. Специальных мер борьбы с болезнью нет.
ВИРУСНЫЙ НЕКРОЗ ЭРИТРОЦИТОВ
Вирусный некроз эритроцитов (ВНЭ, Viral erythrocytic necrosis, VEN) — это мягко протекающее заболевание. Возбудитель. Болезнь вызывают несколько иридовирусов, различающихся размерами вирионов у разных хозяев и по этому признаку условно разделенных на три группы: 310—360 нм — у атлантической трески, около 145 нм — у атлантической сельди и 189—205 нм — у тихоокеанских лососей и тихоокеанской сельди. При электронной микроскопии срезов пораженных эритроцитов вирионы обнаруживаются в цитоплазме и имеют вид правильных шести- и пятиугольников, внутри которых заключен электронно-плотный нуклеоид. Выделить вирус ВНЭ от больных рыб не удается.
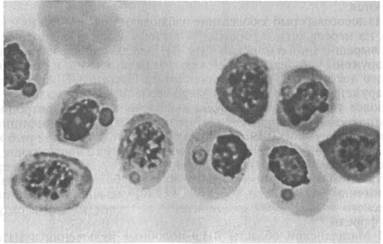
Эпизоотология. Болезнь распространена очень широко и отмечена у нескольких десятков видов рыб, представляющих около 20 семейств морских и анадромных рыб в районах тихоокеанского и атлантического побережий Северной Америки, Гренландии, Великобритании, Португалии и Норвегии, в Средиземном море и в прибрежных водах северной части Японии. Вероятно, на российском Северо-Западе и Дальнем Востоке возбудители ВНЭ также имеются. Из лососевых рыб заболевание наблюдали у океанических и идущих на нерест кеты и горбуши, а также у атлантического лосося при выращивании в морской воде. ВНЭ-включения в эритроцитах обнаружены у производителей кеты, чавычи, кижуча и стального-лового лосося в рыбопитомниках штата Орегон (США). Болезнь обнаружена у черной кефали (Mugil cephalus) в Португалии. Более того, включения были выявлены также в эритроцитах личинок кеты и молоди кижуча, полученных из икры инфицированных производителей. Это показывает, что заражение рыб может происходить на ранних стадиях развития, протекающих в пресной воде, и вероятно — вертикальным путем. При экспериментальном заражении в пресной воде к заболеванию были восприимчивы мальки кеты, горбуши, нерки, чавычи, кижуча, атлантического лосося, а также американской палии, кумжи и радужной форели. В Магаданской области ВНЭ-подобные включения в мазках Крови отмечали у производителей кеты и кижуча, идущих на нерест. Во время передержки производителей на рыбозаводе число рыб-вирусоносителей и доля пораженных эритроцитов резко возрастали. Заболевание наблюдается в разные сезоны года при температуре воды 5 —19 "С, но наиболее тяжело протекает летом. Резервуар инфекции находится в Мировом океане и, помимо естественно больных лососевых, формировать его могут и другие виды рыб, в частности тихоокеанская сельдь. Инкубационный период колеблется от нескольких дней до нескольких недель. Заболеваемость может достигать 100 %. Клинические признаки и патогенез. Главным признаком заболевания является анемия жабр и внутренних органов, иногда наблюдается увеличение селезенки. При экспериментальном заражении отмечали также экзофтальм, петехии на поверхности тела, а в желчном пузыре скопление темно-зеленой желчи. При микроскопии мазков крови в цитоплазме эритроцитов обнаруживаются от одного до (реже) трех на клетку округлых включений размером 0,5—5 мкм (рис. 16). Доля пораженных эритроцитов колеблется от менее 1 до 100 %. Для ВНЭ характерно также повреждение ядер инфицированных эритроцитов — от маргинации хроматина до кариорексиса. При экспериментальном заражении у молоди кеты отмечали резкое снижение содержания зрелых эритроцитов (до полного исчезновения) и увеличение содержания бластных форм клеток, наблюдали моноцитоз, сильно выраженную лейко- и лимфопению. Вирусные включения присутствовали также в эритробластах, макрофагах, гранулоцитах и лимфоцитах. Снижалась или полностью утрачивалась свертываемость крови.
Рис. 16. Эритроциты кеты, пораженные ВЭН
Сам ВНЭ не приводит к ощутимой гибели, однако больная рыба отстает в росте, у нее снижаются адаптационные способности и резистентность организма, в результате чего она обычно погибает от различных стрессовых воздействий (например, дефицита кислорода) или развития вторичных инфекций. Пораженные ВНЭ-включениями производители кеты и кижуча были более ослабленными, чем незараженные, и погибали при передержке от вторичных инфекций. Диагноз. Его ставят на основании клинических, гематологических, патологоанатомических, эпизоотологических данных и результатов электронномикроскопических исследований. Применение краски Гимза окрашивает включения, при ВНЭ — как ацидофильные (эозинофильные). Отдифференцировать два заболевания ВНЭ от возбудителя синдрома эритроцитарных телец включений (СЭТВ) можно и путем окраски мазков акридиновым оранжевым: ДНК-содержащие включения ВНЭ флуоресцируют зеленым светом, РНК-содержащие СЭТВ-включения — красным. Меры борьбы. Они не разработаны. Рекомендуется проводить комплекс рыбоводно-мелиоративных и ветеринарно-санитарных профилактических мероприятий.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 254; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.118.14 (0.023 с.) |