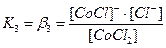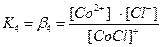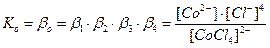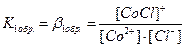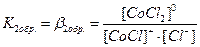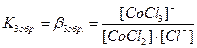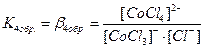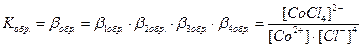Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация комплексных соединений
. В растворах комплексные соединения с внешнесферными ионами практически нацело (как сильные электролиты) диссоциированы по схеме, например: K2[CoCl4] → 2K++[CoCl4]2- [Cu (NH3)4] SO4→[Cu (NH3)4]2++SO42-. Диссоциация с распадом комплексных соединений на внутреннюю и внешнюю сферу называется первичной диссоциацией. Комплексные ионы, а также нейтральные комплексы тоже могут диссоциировать в растворе. Например: [CoCl4]2- ↔ Co2++4Cl- [Cu (NH3)4]2+ ↔ Cu2+ + 4NH3 [Pt(NH3)2Cl2]0 ↔ Pt2+ + 2NH3 + 2Cl- Диссоциация комплексных частиц незначительна (слабые электролиты). Распад в растворе внутренней сферы комплексного соединения на ион-комплексообразователь и лиганды называется вторичной диссоциацией. Такая диссоциация протекает ступенчато: лиганды удаляются из внутренней сферы постепенно, один за другим (точнее, происходит реакция замещения лиганда на молекулы растворителя - воды). [CoCl4]2- ↔ [CoCl3]-+ Cl- [CoCl3]- ↔ [CoCl2]0 + Cl- [CoCl2]0 ↔ [CoCl]+ + Cl- [CoCl]+ ↔ Co2+ + Cl- Как и для всякого обратимого процесса равновесие каждой ступени диссоциации комплексов (или обмена лигандов на молекулы растворителя) характеризуется ступенчатой константой нестойкости комплекса.
Общие (суммарные) константы нестойкости комплексов характеризуют их полную диссоциацию на комплексообразователь и лиганды и равны произведению ступенчатых констант: [CoCl4]2- ↔ Co2+ + 4Cl-
Ступенчатую диссоциацию можно проиллюстрировать примером распада комплексного иона [HgCl4]2 на Hg2+ (как комплексообразователя) и ионы Cl- (как лиганда): [HgCl4]2- ↔ [HgCl3]- + Cl-; K 1(нест.) = 0,10 [HgCl3]- ↔ [HgCl2] + Cl-; K 2(нест.) = 0,07 [HgCl2] ↔ [HgCl]+ + Cl-; K 3(нест.) = 0,31 . 10-7 [HgCl]+ ↔ Hg2+ + Cl-; K 4(нест.) = 0,54 . 10-5 [HgCl4]2- ↔ Hg2+ + 4Cl-; K о(нест.) = K 1(нест.) ∙ K 2(нест.) ∙ K 3(нест.) ∙ K 4(нест.) = 1,17 ∙ 10-15 10.8 Константы образования и прочность комплексов Обратным процессу диссоциации комплекса является процесс его образования. Co2+ + Cl- ↔ [CoCl]+ [CoCl]+ + Cl- ↔ [CoCl2]0 [CoCl2]0 + Cl- ↔ [CoCl3]- [CoCl3]-+ Cl- ↔ [CoCl4]2- Равновесие при комплексообразовании характеризуется с помощью полных (или суммарных) констант образования данного комплекса bi(обр):
Полная константа образования комплекса b n (обр) характеризует устойчивость комплексного соединения и равна произведению ступенчатых констант:
Ступенчатое комплексообразование можно проиллюстрировать примером взаимодействия иона Hg2+ (как комплексообразователя) с ионами Cl- (как лигандом):
Hg2+ + Cl- ↔ [HgCl]+; K 1(обр) = 1,85 . 105 [HgCl]+ + Cl- ↔ [HgCl2]; K 2(обр) = 3,22 . 107 [HgCl2] + Cl- ↔ [HgCl3]-; K 3(обр) = 14,28 [HgCl3]- + Cl- ↔ [HgCl4]2- ; K 4(обр) = 10,00 Hg2+ + 4Cl- - ↔ [HgCl4]2; K обр. = K 1 обр. ∙ K 2обр. ∙ K 3обр. ∙ K 4обр. = 0,85 ∙ 1015 Ступенчатые и общие константы образования и нестойкости комплексов соотносятся друг с другом как обратные величины: β n (обр) = 1 / β n (нест); βn (обр) = 1 / βn (нест), поэтому для сравнения прочности комплексов могут использоваться справочные данные как по значениям констант образования, так и констант нестойкости. Так, константа образования (устойчивости) коплексного иона [HgCl4]2- равна частному деления единицы на константу нестойкости этого же иона: K обр. [HgCl4]2- = 1/ K нест. [HgCl4]2- = 1/(1,17 ∙ 10-15) = 0,85 ∙ 1015 Чем больше значение β n (обр), тем более устойчив комплекс данного состава. Например, сравнивая константы образования катиона диамминсеребра(I) и дицианоаргентат(I)-иона: (1) Ag+ + 2 NH3 ↔ [Ag(NH3)2]+; βо(обр) = 2,5 · 106 (2) Ag+ + 2 CN- ↔ [Ag(CN)2]-; βо(обр) = 1,2 · 1021 сделаем очевидный вывод о большей прочности второго комплекса – аниона [Ag(CN)2]-, поскольку, судя по большему значению константы образования, равновесие в реакции (2) сильнее сдвинуто вправо, чем в (1). Индекс n у константы образования комплекса равен координационному числу центрального атома в том комплексном соединении, которое оценивается. Таким образом, величина b n (обр) связана со ступенчатыми константами образования Ki (обр) соотношением: b n (обр) = K 1(обр) ∙ K 2(обр) ∙ K 3(обр) ∙ … Kn (обр) В растворах КС имеет место первичная и вторичная диссоциация (в расплавах КС происходит их термическая диссоциация). Первичная диссоциация протекает по типу сильных электролитов - практически необратимо: K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4- [Co(NH3)6]Cl3 → [Co(NH3)6]3+ + 3Cl- Первичной диссоциации не подвергаются комплексы без внешней сферы: [Pt(NH3)2Cl2], [Co(NH3)3(NO3)3]. Вторичная диссоциация характеризует диссоциацию самого комплекса. Она протекает в незначительной степени, подчиняется закону действия масс. Этот процесс характеризуют константой диссоциации. Так как величина этой константы фактически определяет прочность комплекса, то ее обычно называют константой нестойкости (K). Вторичная диссоциация протекает по типу слабого электролита - обратимо и ступенчато:
[Ag(NH3)2]+ → [Ag(NH3)]+ + NH3 [Ag(NH3)]+ → Ag+ + NH3 В целях упрощения формы записи обычно записывают суммарное уравнение вторичной диссоциации: [Ag(NH3)2] → Ag+ + 2NH3 Выражение константы нестойкости имеет вид:
Общая константа нестойкости комплекса равна произведению констант диссоциации по всем ступеням: Кнест. = К1нест.·К2нест. Величину, обратную константе нестойкости, называют константой устойчивости или константой образования комплекса. Значения констант нестойкости, приводимые в справочниках, используют для характеристики устойчивости комплексов, нахождения концентраций частиц (комплекса, комплексообразователя, лигандов) в растворе КС, для определения направленности химических реакций с участием комплексных соединений и др. Например, равновесие в реакции: [Ag(NH3)2]Cl + 2KCN = K[Ag(CN)2] + 2KCl + 2NH3 будет смещено вправо, так как Kнест.([Ag(NH3)2]+) = 9,3·10-8, а Kнест.([Ag(CN)2]-) = 8,0·10-22, т.е. второй комплексный ион значительно прочнее первого:
|
||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 15454; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.130.130 (0.009 с.) |