Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Параметрами состояния раствора являются температура, давление и составСтр 1 из 3Следующая ⇒
ОБЩИЕ СВОЙСТВА РАСТВОРОВ Раствор –гомогенная система, состоящая из двух и более компонентов, состав которой может изменяться в некоторых пределах без скачкообразного изменения свойств
Растворы разделяют на твердые, жидкие и газообразные (газовые смеси) Бинарный раствор состоит из двух компонентов: растворителя и растворенного вещества. Параметрами состояния раствора являются температура, давление и состав Способы выражения состава раствора Массовая долякомпонента
Молярная доля: Массовая концентрация Молярная концентрация ( или молярность раствора)
Молярная концентрация эквивалентов (или нормальность раствора) C экв – количество моль эквивалентов растворенного вещества, содержащихся в единице объема раствора, размерность [моль/л] (моль-экв/л):
так как молярная масса эквивалента серной кислоты равна половине ее молярной массы, т. е. один моль Моляльная концентрация (моляльность)
где m – масса растворенного вещества, г; M – молярная масса растворенного вещества, г/моль. Моляльная концентрация относится к 1 кг растворителя; её размерность [моль/кг] Образование раствора
Стадии образования раствора: 1. фазовое превращение, сопровождающееся как увеличением, так и уменьшением энтальпии и энтропии; 2. сольватация, представляющая химическое взаимодействие молекул растворенного вещества и растворителя (в случае растворения в 3. диффузионная стадия, в результате которой частицы растворяемого вещества равномерно распределяются между частицами растворителя, ее вклад в теплоту растворения незначительный
Процесс растворения – самопроизвольный, т. е.
Пересыщенный раствор –неустойчивый (метастабильный) Растворимость данного вещества равна концентрации его насыщенного раствора при определенной температуре.
Растворимость веществ также зависит от природы растворителя ("подобное растворяется в подобном") Растворимость
Растворимость газов в жидкостях Закон Генри (1808 г.): растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью: где Для некоторых растворителей
Понятие об осмосе Осмос – явление самопроизвольного перехода растворителя в раствор (или из раствора с меньшей концентрацией в более концентрированный) через полупроницаемую перегородку
1 – сосуд с раствором 2 – полупроницаемая перегородка (животные ткани или полимер) 3 – сосуд с водой (растворителем)
Гидростатическое избыточное давление, создаваемое раствором, препятствующее диффузии растворителя через полупроницаемую перегородку в раствор, называется осмотическим давлением
• осмотическое давление клеточного сока растений – от • осмотическое давление крови человека – 800 000
Растворы электролитов Теория электролитической диссоциации ( С. Аррениус, 1887 г.) 1. Электролиты – это вещества, которые при растворении или расплавах распадаются на ионы (катионы «+»; анионы «–»); процесс распада на ионы – электролитическая диссоциация
2. Ионы отличаются от нейтральных атомов как по строению, так и по свойствам
к аноду (+)
Электролиты - ионные проводники, ток в которых переносят ионы (проводники второго рода). Различают: жидкие электролиты (водные растворы кислот, оснований, солей); неводные растворы (растворителями в которых как неорганические соединения, например, жидкие аммиак или цианистый водород, так и органические соединения, например, уксусная кислота); расплавы твердых веществ с преимущественно ионным типом химической связи. Электролит состоит из положительно и отрицательно заряженных ионов, при наложении электрического поля движение ионов становится направленным: катионы перемещаются к отрицательному электроду, анионы – к положительному. Проводимость электролитов Диссоциация воды Вода –слабый электролит, (
С недиссоциированных молекул воды: С = const, поскольку
водородный показатель среды гидроксидный показатель среды В нейтральной среде:
В кислотной среде:
В щелочной среде:
Для сильных электролитов вместо «концентрация электролита» и «концентрации ионов электролита» введены понятия «активность электролита где Для 1–1 зарядного сильного электролита типа KA:
Константа равновесия:
Мерой взаимодействия ионных атмосфер является ионная сила раствора электролита:
где Метод расчета среднего ионного коэффициента активности Для бинарного электролита KA:
Для более концентрированных растворов бинарных электролитов:
где I – ионная сила раствора электролита Для очень разбавленных растворов (C
Или в общем виде
где Гидролиз 1 -я ступень гидролиза
2 -я ступень гидролиза:
3. Гидролизу по катиону и аниону подвергаются соли, образованные cлабыми основаниями и слабыми кислотами, например,
В результате гидролиза соли образуются слабые основания и кислоты:
Константа гидролиза:
Раствор соли может иметь кислотную (pH основную (pH > 7), если
Степень гидролиза h есть отношение числа частиц, подвергшихся превращению, к их общему числу, которое можно выразить через отношение концентраций соли:
Связь константы гидролиза, степени гидролиза и концентрации соли (закон разбавления Оствальда):
Если
Если в растворе находится несколько солей, одна из которых подвергается гидролизу по катиону (например, соли
ОБЩИЕ СВОЙСТВА РАСТВОРОВ Раствор –гомогенная система, состоящая из двух и более компонентов, состав которой может изменяться в некоторых пределах без скачкообразного изменения свойств
Растворы разделяют на твердые, жидкие и газообразные (газовые смеси) Бинарный раствор состоит из двух компонентов: растворителя и растворенного вещества. Параметрами состояния раствора являются температура, давление и состав
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-29; просмотров: 443; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.172.146 (0.059 с.) |
 – отношение массы растворенного вещества к массе раствора (безразмерная величина):
– отношение массы растворенного вещества к массе раствора (безразмерная величина):

 – отношение массы растворенного вещества к объему раствора:
– отношение массы растворенного вещества к объему раствора: 
 , размерность[г/л]
, размерность[г/л]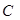 определяется количеством моль растворенного вещества, содержащихся в единице объема раствора; размерность [моль/л]:
определяется количеством моль растворенного вещества, содержащихся в единице объема раствора; размерность [моль/л]: 
 M, например, 2M HCl – в 1 л раствора содержится 2 моль HCl
M, например, 2M HCl – в 1 л раствора содержится 2 моль HCl ,
,  -эквивалентное число
-эквивалентное число «н», например, 2н
«н», например, 2н  – в 1 л раствора содержится 2 моль эквивалентов серной кислоты
– в 1 л раствора содержится 2 моль эквивалентов серной кислоты ,
,  = 2
= 2 содержит два моль эквивалентов кислоты:
содержит два моль эквивалентов кислоты: определяется отношением количества моль растворенного вещества n к массе растворителя
определяется отношением количества моль растворенного вещества n к массе растворителя  :
: ,
, т.е.
т.е.  процесс растворения самопроизвольный при постоянных параметрах (давление, температура, объем
процесс растворения самопроизвольный при постоянных параметрах (давление, температура, объем – гидратация);
– гидратация); 



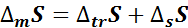
 :
: – раствор ненасыщенный
– раствор ненасыщенный – раствор насыщенный (растворимость предельная при Т=const)
– раствор насыщенный (растворимость предельная при Т=const) Молярная растворимость оценивается количеством моль растворенного вещества в 1 л насыщенного раствора
Молярная растворимость оценивается количеством моль растворенного вещества в 1 л насыщенного раствора  (
(  )
)  , вещество считается нерастворимым в данном растворителе
, вещество считается нерастворимым в данном растворителе  – малораство-римо
– малораство-римо – растворимо
– растворимо в разных растворителях,
в разных растворителях, 


 ,
, – концентрация газа в жидкости,
– концентрация газа в жидкости,  – коэффициент пропорциональности, зависящий от природы газа,
– коэффициент пропорциональности, зависящий от природы газа,  – давление
– давление  ,
,

 ,
,
 .
. - уравнение Вант-Гоффа
- уравнение Вант-Гоффа Па (у болотных растений) до
Па (у болотных растений) до  Па (у степных)
Па (у степных)
 3. В растворе или расплаве ионы движутся хаотически; при пропускании электрического тока: катионы – к катоду (-); анионы –
3. В растворе или расплаве ионы движутся хаотически; при пропускании электрического тока: катионы – к катоду (-); анионы – ):
):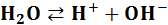 или точнее
или точнее 
 ,
,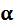 воды очень мала
воды очень мала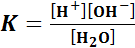 можно заменить ионным произведением воды
можно заменить ионным произведением воды  :
:

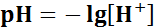 ;
;
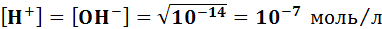 ,
,


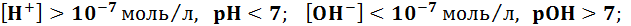


 » и «активности ионов
» и «активности ионов  и
и  »:
»: ;
;  ;
; 
 – средние ионные коэффициенты активности, характеризующие отклонение свойств электролита от идеального состояния
– средние ионные коэффициенты активности, характеризующие отклонение свойств электролита от идеального состояния ,
,

 - молярная концентрация иона;
- молярная концентрация иона;  - заряд иона
- заряд иона сильного электролита с использованием ионной силы (Дебай и Хюккель):
сильного электролита с использованием ионной силы (Дебай и Хюккель):


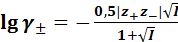


 – заряды ионов, произведение которых взято по модулю,
– заряды ионов, произведение которых взято по модулю, )
) 

 – константа диссоциации слабой кислоты (a – acid, англ, кислота)
– константа диссоциации слабой кислоты (a – acid, англ, кислота)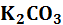 протекает ступенчато через стадию образования кислой соли
протекает ступенчато через стадию образования кислой соли 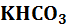 :
: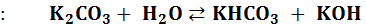





 ,
,  ,
,  ,
,  и др.
и др.

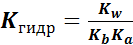
 7), если
7), если  ;
;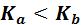 , или нейтральную, если
, или нейтральную, если  , реакцию
, реакцию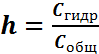
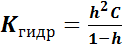
 , то
, то  ;
; 


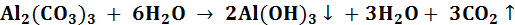

 ,
,  ,
,  ), другая – по аниону (например, соли, содержащие ионы
), другая – по аниону (например, соли, содержащие ионы  ,
,  ), то происходит взаимное усиление гидролиза, и процесс идет до полного разложения солей:
), то происходит взаимное усиление гидролиза, и процесс идет до полного разложения солей: ,
,