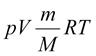Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Властивості газів. Модель ідеального газу.Стр 1 из 5Следующая ⇒
План 1. Властивості газів. Модель ідеального газу. 2. Пароутворення і конденсація. Кипіння. Насичена і ненасичена пара. 3. Вологість повітря. Точка роси. Поверхневий натяг. Капілярність. 4. Явища змочування і капілярності в живій природі. 5. Кристалічні та аморфні тіла. Рідкі кристали.
Література: Шевченко А.Ф. «Основи медичної і біологічної фізики» § 23-26, 39-41, 43-47, 48-51. Є.В. Коршак, О.І. Ляшенко, В.Ф. Савченко § 23-29. Завдання для тематичного контролю. Гельфгат. Методичні рекомендації 1. Застосовувати поняття ідеального газу для характеристики газів. 2. Пояснити процес кипіння на основі МКТ. 3. Значення вологості для живої і неживої природи. 4. Звернути увагу на значення капілярності в живій природі і медицині. 5. Значення і застосування рідких кристалів. Питання для самоконтролю 1. Що називають абсолютною вологістю повітря? Коли вона стає максимально важливою? 2. Що таке точка роси? Коли і чому вона випадає? 3. Як впливає вологість повітря за високих і низьких температур на стан людини? 4. Назвіть 4 основні типи кристалів. 5. Який механізм пружних і пластичних деформацій? 6. На які групи поділяють тверді тіла залежно від їхніх механічних властивостей? Форма контролю: самостійна робота, тести. Більшість оточуючих нас тіл знаходяться в одному з трьох агрегатних станах речовини — твердому, рідкому й газоподібному. У 20-му столітті, коли почали досліджувати мікроскопічну будову тіл, було виявлено структуру цих станів речовини. Молекулярно-кінетична теорія (МКТ) дає можливість зрозуміти, чому речовина може перебувати в газоподібному, рідкому й твердому станах. Природне і штучне утворення кристалів Утворення і ріст кристалів відбувається при переході речовини із газоподібного або рідкого стану у твердий, а також при розпаді твердих розчинів. Цей процес називається кристалізацією. У природі більшість кристалів, мінералів гірських порід утворились при охолодженні земної кори в різних геологічних епохах. Багато мінералів виникли із перенасичених водних розчинів, наприклад, кам’яна сіль NаСІ. Товщина пластів солі кам’яної, які утворилися під час випаровування води із солоних озер, в деяких покладах досягає кількох сотень метрів.
Кристали можуть утворюватися не лише при замерзанні рідини, а й безпосередньо з пари. Прикладом цього є утворення інею та сніжинок з водяних парів повітря, а також кристаликів йоду з парів йоду.Подібно до росту кристалів льоду відбувається ріст багатьох кристалів з розплавленого стану. З розплавів вирощуються монокристали корунду, рубіну, сапфіру.Монокристали багатьох речовин (зокрема солей) можна вирощувати з розчинів (наприклад, випадання кристалів азотнокислого калію з його розчину у воді). Цим методом можна виростити монокристали різних розмірів: за декілька тижнів одержується монокристал сегнетової солі масою до 20 кг. В останній час швидкими темпами розвиваються технології вирощування монокристалів на космічних орбітальних станціях. За умов невагомості і вакууму забезпечуються можливості одержання хімічно чистих кристалів. Рідкі кристали У 1889 році були відкриті рідкі кристали. Це особливий стан окремих органічних речовин, у якому їм притаманні одночасно властивості кристалічного твердого тіла і рідини. Подібно до рідин кристали течуть, набувають форми посудини, у якій знаходяться, утворюють краплі. Подібно до кристалів у них спостерігається анізотропія всіх фізичних властивостей. Рідкі кристали утворені з молекул, поздовжні розміри яких набагато більші за поперечні. Молекули орієнтовані вздовж певного напрямку і можуть бути різного типу. Розрізняють смектичні та нематичні рідкі кристали. У смектичному рідкому кристалі молекули розташовані шарами. Прикладом смектичного рідкого кристалу являється розчин мила в воді: мильний розчин побудований із великої кількості подвійних шарів молекул мила, які розділені шарами води.
В нематичному кристалі впорядкованість розташування молекул заключається у тому, що в певному об’ємі поздовжні осі усіх молекул паралельні, тобто спостерігається орієнтаційне впорядкування молекул уздовж певного напрямку.
Зараз відомо більше 3000 речовин, котрі утворюють рідкі кристали. До котрих належить велика кількість речовин органічного походження, зокрема дезоксирибонуклеїнова кислота та речовина мозку. Рідкі кристали є надзвичайно чутливими до незначних зовнішніх змін, що зумовлює їх широке практичне застосування, особливо в системах обробки та відображення інформації (комп’ютери, ноутбуки, прилади для візуалізації деяких випромінювань). На основі рідких кристалів створюють прилади для визначення коливань температури, індикаторну техніку тощо. План 1. Властивості газів. Модель ідеального газу. 2. Пароутворення і конденсація. Кипіння. Насичена і ненасичена пара. 3. Вологість повітря. Точка роси. Поверхневий натяг. Капілярність. 4. Явища змочування і капілярності в живій природі. 5. Кристалічні та аморфні тіла. Рідкі кристали.
Література: Шевченко А.Ф. «Основи медичної і біологічної фізики» § 23-26, 39-41, 43-47, 48-51. Є.В. Коршак, О.І. Ляшенко, В.Ф. Савченко § 23-29. Завдання для тематичного контролю. Гельфгат. Методичні рекомендації 1. Застосовувати поняття ідеального газу для характеристики газів. 2. Пояснити процес кипіння на основі МКТ. 3. Значення вологості для живої і неживої природи. 4. Звернути увагу на значення капілярності в живій природі і медицині. 5. Значення і застосування рідких кристалів. Питання для самоконтролю 1. Що називають абсолютною вологістю повітря? Коли вона стає максимально важливою? 2. Що таке точка роси? Коли і чому вона випадає? 3. Як впливає вологість повітря за високих і низьких температур на стан людини? 4. Назвіть 4 основні типи кристалів. 5. Який механізм пружних і пластичних деформацій? 6. На які групи поділяють тверді тіла залежно від їхніх механічних властивостей? Форма контролю: самостійна робота, тести. Більшість оточуючих нас тіл знаходяться в одному з трьох агрегатних станах речовини — твердому, рідкому й газоподібному. У 20-му столітті, коли почали досліджувати мікроскопічну будову тіл, було виявлено структуру цих станів речовини. Молекулярно-кінетична теорія (МКТ) дає можливість зрозуміти, чому речовина може перебувати в газоподібному, рідкому й твердому станах. Властивості газів. Модель ідеального газу. Газ (нід. gas, від грец. chaos — хаос) — один із агрегатних станів речовини, для якого характерні великі відстані між частинками (молекулами, атомами, іонами) порівняно з твердим чи рідинним станами, слабка міжмолекулярна взаємодія, невпорядкованість структури, а середня кінетична енергія хаотичного руху частинок набагато більша за енергію взаємодії між ними. Характеристичною властивістю газу є те, що він здатний вільно поширюватися в усьому доступному для нього просторі, рівномірно заповнюючи його. На відміну від рідини та твердого тіла газ не утворює поверхні. Гази легко стискаються, при цьому зменшується середня відстань між молекулами. Молекули з величезними швидкостями — сотні метрів за секунду — рухаються в просторі. Стикаючись, вони відштовхуються одна від одної в різні боки, подібно до більярдних куль. Слабкі сили тяжіння молекул газу не здатні утримати їх одна біля одної. Численні удари молекул об стінки посудини створюють тиск газу.
Газами називають хімічні речовини, які перебувають в газоподібному стані за нормальних умов. У фізичних, термодинамічних та інших дослідженнях до газів відносять також суміші газів, серед яких найбільший інтерес викликає повітря. Повітря складається з кількох газів — азоту, кисню, аргону, діоксиду вуглецю, та інших. Кінетична теорія розглядаючи молекулярну будову і рух молекул, дає уявлення про макроскопічні властивості газів. Починаючи з визначення імпульсу і кінетичної енергії, можна використовуючи закон збереження імпульсу і геометричні залежності зв'язати макроскопічні властивості системи (температуру і тиск) з мікроскопічними властивостями (кінетичною енергію однієї молекули).Кінетична теорія пояснює термодинамічні явища, виходячи з атомістських уявлень. Теорія постулює, що тепло є наслідком хаотичного руху надзвичайно великої кількості мікроскопічних частинок (атомів та молекул).Вона пояснює, як газова система реагує на зовнішні впливи. Наприклад, коли газ нагрівається від абсолютного нуля, коли його частинки (теоретично) абсолютно нерухомі, швидкість частинок зростає із збільшенням його температури. Це призводить до більшого числа зіткнень із стінками ємкості кожну секунду за рахунок вищої швидкості частинок. У міру зростання числа зіткнень (за одиницю часу) зростає вплив на поверхню стінки ємкості, тиск зростає пропорційно. Успішне пояснення багатьох законів термодинаміки, виходячи з положень кінетичної теорії, стало одним із факторів підтвердження атомарної будови речовин у природі. В сучасній фізиці молекулярно-кінетична теорія розглядається як складова частина статистичної механіки. Вчення про Ідеа́льний газ сходить до відкритих в результаті не цілком точних експериментальних досліджень в XVII ─ XIX століттях газових законів Бойля ─ Маріотта, Гей-Люссака і Шарля, а також сформульованому Бенуа Клапейроном на їх основі об'єднаному рівнянню газового стану. В ті часи вважалося, що гази, на відміну від пари, не скраплюються і зберігають свій газоподібний стан у будь-якому температурному діапазоні. Розвиток кріогенної техніки спростував ці уявлення. Проте, газові закони збереглися в термодинаміці і в її технічних застосуваннях як принципово важливі закони ідеальних газів ─ граничних (практично недосяжних) станів реальних газів.
Під ідеальними газами в класичній термодинаміці маються на увазі гіпотетичні (реально не існуючі) гази, що строго підкоряються законам Бойля ─ Маріотта, Гей-Люссака і, відповідно, ─ рівнянню газового стану Клапейрона. (Рівняння Клапейрона також було теоретично виведене при деяких припущеннях на основі молекулярно - кінетичної теорії газів). Ідеальний газ ─ з позициї молекулярно - кінетичної теорії ─ являє собою теоретичну (математичну, фізичну) модель газу, в якій передбачається, що: 1) потенційною енергією взаємодії матеріальних часток, що складають газ, можна знехтувати в порівнянні з їх кінетичною енергією; 2) сумарний обсяг частинок газу дуже малий; 3) між частинками немає далекодіючих сил тяжіння або відштовхування, зіткнення часток між собою і зі стінками посудини абсолютно пружні; 4) час взаємодії між частинками дуже малий в порівнянні із середнім часом між зіткненнями. У розширеній моделі ідеального газу частинки, з якого він складається, мають форму пружних сфер або еліпсоїдів, що дозволяє враховувати енергію не тільки поступального, а й обертально - коливального руху, а також не тільки центральні, а й нецентральні зіткнення частинок. Історія виникнення поняття ідеальний газ безпосередньо пов'язана з успіхами експериментальної фізики, початок яким було покладено в XVII столітті. У 1643 р. Еванджеліста Торрічелліуперше довів, що повітря має вагу (масу), і, спільно з В. Вівіані провів дослід по виміру атмосферного тиску за допомогою запаяної з одного кінця скляної трубки, заповненої ртуттю. Так з'явився на світ перший ртутний барометр. У 1650 р. німецький фізик Отто фон Геріке винайшов вакуумне відкачування і провів в 1654 р. знаменитий експеримент з магдебурзькими півкулями, яким наочно підтвердив існування атмосферного тиску. Інший експеримент здійснив англійський фізик Роберт Бойль, на підставі якого в 1662 р. був сформульований газовий закон, названий згодом законом Бойля ─ Маріотта, аналогічне незалежне дослідження в 1679 р провів французький фізик Эдм Маріотт. У 1802 році французький фізик Гей-Люссак опублікував в пресі закон об'ємів (що так і називається законом Гей-Люссака), Гей-Люссак також встановив, що коефіцієнт об'ємного розширення однаковий для усіх газів, незважаючи на загальноприйняту думку, що різні гази розширюються при нагріванні по-різному. У 1834 році Бенуа Клапейрон об'єднав обидва ці закони в одне рівняння газового стану — рівняння Клапейрона. Експериментальні дослідження фізичних властивостей реальних газів в ті роки були недостатньо точними і проводилися в умовах, що не дуже відрізнялися від нормальних (температура 0 ℃, тиск 760 мм. рт. стовпа). Передбачалося також, що газ, на відміну від пари, є субстанцією, незмінною у будь-яких фізичних умовах. Першого удару за цими уявленнями завдало зріджування хлору в 1823 р. Надалі з'ясувалося, що реальні гази насправді є перегріті пари, досить віддалені від областей конденсації і критичного стану. Будь-який реальний газ може бути перетворений на рідину шляхом конденсації, або шляхом безперервних змін однофазного стану. Таким чином реальні гази являють собою один з агрегатних станів відповідних простих тіл, а точним рівнянням стану газу може бути рівняння стану простого тіла. Не дивлячись на це, газові закони збереглися в термодинаміці та в її технічних застосуваннях як закони ідеальних газів ─ граничних (практично недосяжних) станів реальних газів. Вперше поняття "Ідеальний газ" було введене Р. Клаузіусом.
Розрізняють три типи ідеального газу: · Класичний ідеальний газ або газ Максвелла-Больцмана. · Ідеальний квантовий газ Бозе (складається з бозонів). Див. статистика Бозе-Ейнштейна. · Ідеальний квантовий газ Фермі (складається з ферміонів). Рівн́яння стáну ідеáльного гáзу — формула, що встановлює залежність між тиском, об'ємом іабсолютною температурою класичного ідеального газу. Узагальнює закони Бойля-Маріотта, Гей-Люссака та Шарля. У фізиці частіше використовують наступну форму запису:
Де: · V - об'єм газу, · M - молярна маса газу, · m - маса газу, · p - абсолютний тиск · T - абсолютна температура, · R - універсальна газова стала, {\displaystyle pV={\frac {m}{M}}RT.}2. Пароутворення і конденсація. Кипіння. Насичена і ненасичена пара. Рідини: Рідиною називається фізичне тіло, яке сильно опирається зміні свого об’єму (в протилежність газам) та слабко опирається зміні своєї форми (в протилежність твердим тілам).
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 747; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.174.168 (0.026 с.) |
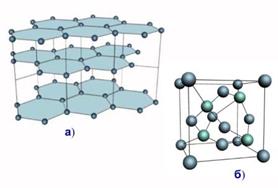 Кристалічні гратки графіту і алмазу .-----------------------------
Кристалічні гратки графіту і алмазу .-----------------------------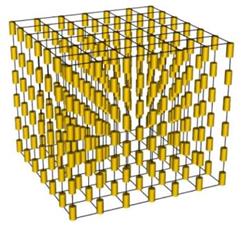 Будова смектичних рідких кристалів
Будова смектичних рідких кристалів 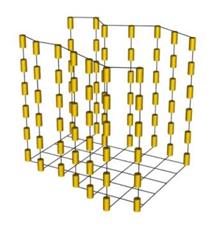 Будова нематичних рідких кристалів
Будова нематичних рідких кристалів