
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модульная единица 2.1. Поверхностные явленияСтр 1 из 4Следующая ⇒
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА ПО КУРСУ
КОЛЛОИДНОЙ ХИМИИ
Тюмень, 2016 г.
МЕТОДИЧЕСКОЕ ПОСОБИЕ РАЗРАБОТАНО: доцентами кафедры, к.х.н. Дарюхиной Е.Н. к.х.н. Медяник Н.П. к.х.н. Гуреевой Н.В.
РЕЦЕНЗЕНТЫ: д.ф.н., профессор Д.Ф. Нохрин д.ф.н., профессор Т.А. Кобелева
УТВЕРЖДЕНО ЦКМС Тюменского государственного медицинского университета «____» _____________ 2016г.
Методическое пособие предназначено для самоподготовки студентов фармацевтического факультета по курсу коллоидной химии. Пособие включает тематические планы лекций и практических занятий, список основной и дополнительной литературы, задания для студентов, примеры решения типовых задач, прописи лабораторных работ, список тем реферативных работ, темы курсовых работ, расчётные формулы по темам, справочные материалы.
ОГЛАВЛЕНИЕ
Перечень компетенций в процессе освоения дисциплины 4 Тематеческий план лекций лекций по коллоидной химии 6 Тематический план лабораторных занятий по курсу коллоидной химии 7 Литература 8 Правила техники безопасности при работе в физико-химической лаборатории 9 Модульная единица 2.1. Поверхностные явления 10 Занятие 2.1.1. 10 Лабораторная работа №1 11 Занятие 2.1.2. 13 Лабораторная работа №2 15 Занятие 2.1.3. 16 Лабораторная работа №3 17 Занятие 2.1.4. 18 Занятие 2.1.5. 19 Модульная единица 2.2. Коллоидное состояние вещества. Дисперсные системы 21 Занятие 2.2.1 21 Лабораторная работа №4 22 Занятие 2.2.2. 24 Лабораторная работа №5 25 Занятие 2.2.3. 27 Лабораторная работа №6 29 Занятие 2.2.4. 30 Лабораторная работа №7 32 Занятие 2.2.5. 33 Лабораторная работа №8 35 Лабораторная работа №9 37 Занятие 2.2.6. 38 Модульная единица 2.3. Высокомолекулярные вещества и свойства их растворов 39 Занятие 2.3.1. 39 Лабораторная работа №10 41 Занятие 2.3.2. 42 Лабораторная работа №11 43 Занятие 2.3.3. 45 Занятие 2.3.4. 46 Основные единицы в системе СИ 46 Основные формулы по теме: «Адсорбция» 47 Основные формулы по теме: «Молекулярно-кинетические свойства коллоидных систем» 48 Основные формулы по теме: «Электрокинетические явления в золях» 48 Основные формулы по теме: «Вязкость растворов ВМВ» 49
Экзаменационные вопросы по курсу физической и коллоидной химии 49
П Р Е Д И С Л О В И Е
Учебно-методическое пособие по курсу коллоидной химии подготовлено с целью методического обеспечения самостоятельной работы студентов 2-го курса фармацевтического факультета. Пособие включает тематические планы лекций и практических занятий, список основной и дополнительной литературы, задания для студентов, примеры решения типовых задач, прописи лабораторных работ, список тем реферативных работ, темы курсовых работ, расчётные формулы по темам, справочные материалы, вопросы к экзамену. В методических указаниях для студентов указаны цель и значение изучаемой темы, указаны теоретические вопросы, которые должны быть изучены студентами при подготовке к занятию, приведены решения основных типов задач, условия задач для домашнего решения. Содержание руководства включает прописи лабораторных работ, с содержанием которых студенты знакомятся при подготовке к занятию. В тексте лабораторной работы имеются вопросы к каждому опыту, а также контрольные вопросы, по которым проводится собеседование при защите отчёта. При подготовке к контрольным работам студент может ознакомиться с примером варианта контрольной работы, которые даны в задании для студентов. В учебно-методическом пособии приведены основные расчётные формулы по темам, что значительно облегчает самостоятельное решение задач студентами. В пособии также приведены основные справочные данные. Завершается учебно-методическое пособие перечнем тем реферативных работ и вопросов к итоговому экзамену по курсу физической и коллоидной химии. Перечень компетенций в процессе освоения дисциплины Общекультурные компетенции: способность и готовность анализировать социально-значимые проблемы и процессы, использовать на практике методы гуманитарных, естественно-научных, медико-биологических и клинических наук в различных видах профессиональной и социальной деятельности (ОК-1); способность и готовность к логическому и аргументированному анализу, к публичной речи, ведению дискуссии и полемики, к редактированию текстов профессионального содержания (ОК-5)
Профессиональные компетенции: способность и готовность применять основные методы, способы и средства получения, хранения, переработки научной и профессиональной информации; получать информацию из различных источников, в том числе с использованием современных компьютерных средств, сетевых технологий, баз данных и знаний (ПК-1) В научно-исследовательской деятельности: способность и готовность изучать научно-медицинскую информацию, отечественный и зарубежный опыт по тематике исследования (ПК-31). способность и готовность к участию в освоении современных теоретических и экспериментальных методов исследования и целью создания новых перспективных средств, в организации работ по практическому использованию и внедрению результатов исследований (ПК-32). способность и готовность проводить анализ лекарственных средств с помощью химических, биологических и физико–химических методов в соответствии с требованиями Государственной фармакопеи (ПК-35) способность и готовность интерпретировать и оценивать результаты анализа лекарственных средств (ПК-36) способность и готовность работать с научной литературой, анализировать информацию, вести поиск (ПК-48)
ТЕМАТИЧЕСКИЙ ПЛАН ЛЕКЦИЙ ПО КОЛЛОИДНОЙ ХИМИИ
Тематический план лабораторных занятий по курсу коллоидной химии для студентов 2 курса фармацевтического факультета
Л И Т Е Р А Т У Р А, рекомендуемая по курсу физической и коллоидной химии для студентов фармацевтического факультета
Основная литература (О.Л.) 1. Н.Н. Мушкамбаров. Физическая и коллоидная химия. – М.: ГЭОТАР-МЕД, 2001 2. М. Гельфман. Коллоидная химия / М. Гельфман, О. Ковалевич, В. Юстратов. – СПб.: Лань, 2004. 3. А.П. Беляев, ред. Физическая и коллоидная химия: М.: Геотар-Медиа, 2010. Дополнительная литература (Д.Л.) 1. К.И. Евстратова, Н.Л. Купина, Е.Е. Малахова. Физическая и коллоидная химия. М.: Высшая школа, 1990. 2. В.Н. Сергеев, Курс коллоидной химии для медицинских вузов: учебное пособие, М.:МИА, 2008. 3. Я. Харитонов. Физическая химия: учебник. М.: ГЭОТАР, 2009
Правила по технике безопасности при работе в физико-химической лаборатории.
1. Перед выполнением каждой лабораторной работы преподаватель обращает внимание студентов на соблюдение техники безопасности при работе с теми реактивами и аппаратурой, которые используются в данной работе. 2. С легколетучими жидкостями, токсичными веществами необходимо работать только в вытяжном шкафу.
3. Во время работы с бензолом, толуолом и другими легковоспламеняющимися веществами необходимо соблюдать особую осторожность. В случае возникновения пожара пламя накрывается влажным одеялом или засыпается песком (но не заливается водой). 4. Отработанные растворы органических растворителей сливаются только в банки для слива. 5. Любой химический сосуд, пробирку следует нагревать постепенно. Открытый конец пробирки должен быть направлен в сторону от себя и работающих рядом студентов. 6. При разбавлении концентрированных кислот, особенно серной, необходимо наливать кислоту в воду, а не наоборот. Нельзя наклоняться над сосудом, в котором нагревается какое- либо вещество. 7. При ожогах кислотами необходимо промыть обожжённое место водой, а затем слабым раствором соды. 8. При ожогах щелочами обожжённое место промывают водой, а затем разбавленным раствором уксусной кислоты. 9. При заполнении пипеток кислотами, щелочами необходимо пользоваться резиновыми грушами. 10. При выполнении лабораторных работ часто пользуются ртутными термометрами, Особую осторожность следует соблюдать при работе с термометрами Бекмана., так как в его резервуарах содержится большое количество ртути. В случае, если ртуть разлилась её немедленно собирают с помощью амальгированной медной пластинки и опускают её в раствор сульфата меди. Запрещается выливать ртуть в канализационные раковины. 11. Все реактивы должны быть снабжены этикеткой с легко читаемой надписью, в противном случае реактивы выбрасываются. 12. Запрещается включать и регулировать электроприборы без предварительного изучения инструкции к ним и разрешения преподавателя. В случае поломки прибора нужно немедленно выключить его из электросети и сообщить об этом преподавателю. 13. По окончании работы студент должен привести в порядок рабочее место, вымыть посуду и сдать рабочее место дежурному. 14. В течение всего занятия за порядок в лаборатории отвечает дежурный, в конце занятия он сдаёт комнату лаборанту кафедры. 15. Лаборатория должна быть оснащена основными средствами пожаротушения: огнетушителем, одеялом, песком, водой, а также должны иметься растворы: соды, уксусной кислоты, перманганата калия. В лаборатории должна находиться аптечка. Порядок оформления отчёта. 1. Дата и номер лабораторной работы. 2. Тема и цель лабораторной работы. 3. Название каждого опыта. 4. Краткая методика выполнения лабораторной работы, расчётные формулы, необходимые таблицы. 5. Расчёты. 6. Результаты наблюдений, ответы на поставленные вопросы, выводы. ЗАНЯТИЕ 2.1.1. ТЕМА: Адсорбция на границах раздела: жидкость-газ, жидкость-жидкость. ЦЕЛЬ ЗАНЯТИЯ: изучив теоретические основы адсорбционных процессов на границах раздела ж/ж и ж/г, научиться экспериментально определять величину поверхностного натяжения, строить изотерму поверхностного натяжения и изотерму адсорбции, определять длину и площадь, занимаемую молекулой ПАВ в насыщенном адсорбционном слое.
ЗНАЧЕНИЕ ИЗУЧАЕМОЙ ТЕМЫ: Изучение физико-химических закономерностей поверхностных явлений является важным для понимания механизма сложных процессов, протекающих в организме в норме и патологии, а также при введении лекарственных веществ или попадании в организме токсинов. Знание закономерностей изменения поверхностного натяжения на границе раздела фаз в биосистемах в норме и при функциональных нарушениях, а также под действием лекарственных и токсических веществ позволяет решать многие биологические и медицинские задачи. Биологическая активность веществ одного гомологического ряда нередко изменяется в соответствии с изменением их поверхностной активности, что имеет большое значение при целенаправленной разработке новых лекарственных средств.
Теоретические вопросы: 1. Поверхностные явления и их значение в фармации. 2. Свободная поверхностная энергия и поверхностное натяжение. 3. Поверхностно-активные и поверхностно-инактивные вещества. 4. Изотерма поверхностного натяжения. 5. Поверхностная активность и её измерение. 6. Адсорбция на границе раздела: жидкость-газ, жидкость-жидкость. Уравнение Гиббса. 7. Определение длины и площади, занимаемой молекулой в насыщенном адсорбционном слое. 8. Правило Дюкло-Траубе. 9. Ориентация молекул в поверхностном слое.
Лабораторная работа: «Построение изотермы поверхностного натяжения и адсорбции олеата натрия». (для построения графика необходима миллиметровая бумага). Обучающие задачи: Задача 1. Вычислить величину адсорбции ПАВ и его поверхностную активность для 0,030 моль/л раствора при 200С, если поверхностное натяжение 0,055 моль/л его раствора в воде равно 42,8´10-3 н/м, а поверхностное натяжение воды при этой температуре равно 72,75´10-3н/м. Решение: уравнение Гиббса для расчёта адсорбции на границе ж/г имеет вид: Г = -С/RT´ds/dС; для приближённых расчётов - ds/dС можно заменить на -Ds / DС, где Ds = s2 - s1, а DС = С2 - С1, тогда: Г = -С/RT´ (s2 - s1) / (С2 – С1). Величина -Ds/DС характеризует поверхностную активность ПАВ, обозначаемую G. Определим поверхностную активность: G = - Ds/DС = - (42,8´ 10-3 – 72,75 ´10-3) / 0,055 – 0 = 0,54 (нм2/кмоль). Определим величину адсорбции: Г=G´С/RT=0,54нм2/кмоль´ 0,030кмоль/м3/8,31´103 Дж/кмоль . К´293К = 6,0 ´10-9кмоль/м2. Адсорбция положительная. Задача 2. Пользуясь правилом Дюкло-Траубе, определить, во сколько раз поверхностная активность гексановой кислоты меньше поверхностной активности нонановой кислоты. Решение: согласно правилу Дюкло-Траубе, поверхностная активность ПАВ на границе раствор-воздух возрастает с увеличением длины углеводородного радикала на каждую –СН2- группу в 3,2 раза. Длина углеводородного радикала нонановой кислоты больше, чем гексановой кислоты на 3 метиленовые группы, следовательно: G нонановой к-ты 3
G гексановой кислоты меньше G нонановой кислоты в 32,8 раза.
Задачи для самостоятельного решения: Задача 1. Определить поверхностную активность и значение адсорбции при 150С для водного раствора ацетона С(СН3)2СО = 0,025 моль/л, если поверхностное натяжение раствора равно 44,7´10-3 н/м, поверхностное натяжение воды при этой температуре 73,49´10-3н/м. Задача 2. Определить площадь, занимаемую одной молекулой в насыщенном адсорбционном слое анилина на поверхности его водного раствора, если предельная адсорбция Гmax = 6,5 ´10-9 кмоль/м2. Задача 3. Вычислить длину (10) и площадь (S0) молекулы изогептанола в насыщенном адсорбционном слое, если Гmax = 6,9´10-7 моль/м2, d = 0,89 г/мл. Задача 4. Определить предельную величину адсорбции гексанола (Гmax), если площадь, приходящаяся на одну молекулу в насыщенном адсорбционном слое, равна 2,5´10-19м2. Одинакова ли толщина насыщенного слоя для гексанола и октанола. Объяснить. Изобразите графически, как ориентируются молекулы гексанола в насыщенном адсорбционном слое на границах раздела: а) вода – воздух; б) вода – бензол. Лабораторная работа №1. ЗАНЯТИЕ 2.1.2. ТЕМА: Адсорбция на границе раздела: твёрдое тело-газ, твёрдое тело-жидкость. ЦЕЛЬ ЗАНЯТИЯ: изучив теоретические закономерности адсорбции веществ на твёрдых адсорбентах, научиться экспериментально определять величину адсорбции на твёрдом адсорбенте. ЗНАЧЕНИЕ ИЗУЧАЕМОЙ ТЕМЫ: адсорбция лекарственных веществ является одной из стадий их метаболизма. В результате адсорбции концентрация лекарственных веществ может быть увеличена на порядок и более, что в соответствии с законами кинетики увеличивает скорость биохимических реакций, особенно ферментативных. Адсорбенты часто используются в рецептуре аптек. Адсорбционные явления могут служить причиной несовместимости в лекарственных формах, чаще всего в порошках, микстурах, взвесях. Адсорбентами, как правило, являются высокодисперсные вещества, нерастворимые и не всасывающиеся в организме человека (уголь, гидроксид алюминия, белая глина, растительные порошки), которые значительно снижают терапевтическую активность лекарств при одновременном их применении с алкалоидами, гликозидами и др. веществами.
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1. Измерение величины адсорбции на границах раздела: твёрдое тело-газ и твёрдое тело-раствор. 2. Факторы, влияющие на величину адсорбции газов и растворённых веществ. 3. Уравнение изотермы адсорбции Лэнгмюра. Основные положения теории мономолекулярной адсорбции Лэнгмюра. Изотерма мономолекулярной адсорбции. 4. Уравнение адсорбции Фрейндлиха. Изотерма адсорбции Фрейндлиха. Применимость уравнения Фрейндлиха. 5. Капиллярная конденсация. 6. Применение адсорбции на границе твёрдое тело-газ, твёрдое тело-раствор для очистки лекарственных веществ, для извлечения действующих веществ из лекарственного сырья.
Лабораторная работа: «Построение изотермы адсорбции йода на активированном угле». (для построения графика необходима миллиметровая бумага). Обучающие задачи. Задача 1. Полистирольный сульфокатионит в Н+ форме в количестве 1г внесли в раствор КС1 с концентрацией 100 моль/м3 объёмом 50 мл и смесь выдержали до равновесного состояния. Константа адсорбционного равновесия К = 2,5. Полная обменная ёмкость катионита 5 моль/кг. Определить равновесную концентрацию ионов калия в ионите. Решение: Количество адсорбируемого вещества (К+) можно определить из уравнения Лэнгмюра и из уравнения Фрейндлиха:
Обозначим равновесную концентрацию ионов калия в растворе через x и составим уравнение:
(корень не действителен) Сравн.=0,08 моль/л. Задача 2. Определить константы в уравнении изотермы адсорбции Лэнгмюра для растворов гексанола на основании следующих экспериментальных данных:
Решение: для нахождения констант преобразуем уравнение Лэнгмюра в уравнение прямой:
В координатах 1/Г – 1/С получаем прямую линию. Отрезок, отсекаемый этой прямой на оси ординат, равен 1/Гmax, а угловой коэффициент 1/ Гmax ´ К. Построим график:
По графику определяем угловой коэффициент: a = 0,9 107; 1/Гmax = 0,1 . 109, следовательно, Гmax =1 10-8 кмоль/м2. К = 1,1 . 10-7. Задача 3: На основании экспериментальных данных, полученных при изучении адсорбции бензойной кислоты углем из её раствора в бензоле при 250С, определить графически константы b и n в уравнении Фрейндлиха.
Решение: для определения коэффициентов в уравнении Фрейндлиха преобразуем его в уравнение прямой линии: 1g х /m = 1g b + 1/n 1g С; Для построения прямой находим 1g С и 1g х/m:
Отрезок, отсекаемый прямой на оси ординат равен 1g b, а тангенс угла наклона – 1/n. 1g b = 0,5; b = 3,16; tg a = 0,31; 1/n = 0,31; n = 3,2.
Задачи для самостоятельного решения. Задача 1. При изучении адсорбции ацетона древесным активированным углем при 200С были получены следующие результаты:
Определить графически постоянные b и n в уравнении изотермы адсорбции Фрейдлиха и рассчитать количество ацетона, адсорбируемое 1г угля при равновесной концентрации ацетона 125 ммоль/л. Задача 2. Анионит, имеющий -СН2SН- ионогенную группу внесли в раствор СаС12 с концентрацией 0,1 моль/л объёмом 75 мл. Масса анионита 1,5 г. Смесь выдержали до состояния адсорбционного равновесия. Константа адсорбционного равновесия К = 2,7. Полная обменная ёмкость анионита 4,4 моль/кг. Определить равновесную концентрацию хлорид-ионов в ионите и величину адсорбции. Задача 3. Вычислить равновесную концентрацию уксусного альдегида, если 10 г активированного древесного угля адсорбирует 25,7 ммоль уксусного альдегида. Константы в уравнении Фрейдлиха: b = 14,2; n = 1,75.
Лабораторная работа №2. Построение изотермы адсорбции йода на активированном угле. Цель работы: определить значения адсорбции йода из растворов различной концентрации на активированном угле, построить изотерму адсорбции и графически определить константы уравнения Фрейндлиха.
ЗАНЯТИЕ 2.1.3. ТЕМА: Адсорбция сильных электролитов. Ионообменная адсорбция. ЦЕЛЬ ЗАНЯТИЯ: изучить закономерности адсорбции сильных электролитов, влияние ряда факторов на адсорбцию ионов из раствора и ознакомиться с хроматографическим методом разделения смесей ионов. ЗНАЧЕНИЕ ИЗУЧАЕМОЙ ТЕМЫ: Адсорбция на твёрдых телах широко применяется в фармацевтической промышленности как стадия технологического процесса при очистке синтетических препаратов, а также используется в фарманализе. Знание влияния различных факторов на величину адсорбции из растворов твёрдыми адсорбентами позволяет регулировать адсорбционные процессы, лежащие как в основе многих технологических операций, так и в основе взаимодействия лекарственных и токсических веществ с системами организма.
Теоретические вопросы. 1. Эквивалентная и избирательная адсорбция сильных электролитов. 2. Правило Панета-Фаянса. 3. Ионообменная адсорбция. 4. Иониты. Классификация ионитов. 5. Применение ионитов в фармации. 6. Основы хроматографии. Роль М.С.Цвета в создании хроматографического метода анализа. 7. Классификация хроматографических методов по технике выполнения и по механизму процесса. 8. Применение хроматографии для получения и анализа лекарственных веществ. 9. Явление смачивания. Инверсия смачивания.
Лабораторная работа. «Хроматография».
Обучающие задачи. Задача 1. Сколько граммов магния останется в растворе, если через колонку с 9 г катионита пропустить 500 мл раствора соли магния с С(1/z) = 0,03 моль/л? Полная динамическая ёмкость катионита 1,20 ммоль/г. Решение: 1. Определим концентрацию ионов магния в исходном растворе: СNi+2 = С(1/z) ´ Vр-ра = 0,03 моль/л ´0,5 л = 0,015 моль или 15 ммоль. 2. 1 грамм катионита поглощает 1,20 ммоль ионов магния, а 9 г поглотят 1,20 ммоль/г ´ 9г = 10,8 ммоль. 3. Рассчитаем оставшуюся концентрацию ионов магния в растворе: 15 ммоль – 10,8 ммоль = 4,2 ммоль. 4. Определим сколько граммов ионов никеля осталось в растворе: 4,2 . 10-3моль´24,3 г/моль=0,10206 г. Задача 2: Определить площадь, занимаемую одной молекулой адсорбтива, если молярная масса адсорбтива 200 г/моль, плотность r = 0,9183 г/мл; толщина адсорбционного слоя 1 = 1,765 . 10-9м. Зная площадь, занимаемую молекулой, и толщину адсорбционного слоя, определите класс и формулу адсорбтива. Решение: рассчитаем максимальное значение адсорбции: из формулы 1 = Гmax ´М /r выразим Гmax: Гmax = 1´r / М = 1,765 . 10-9м ´0,9183 . 103кг/м3 / 200 кг/кмоль = 8,103 . 10-9кмоль/м2. По формуле: S0 = 1 / Гmax ´ NА рассчитаем площадь, занимаемую одной молекулой адсорбтива. S0 = 1 / 8,103 . 10-9кмоль/м2 ´6,02 . 1026кмоль-1 = 2,05 . 10-19м2. Площадь соответствует размеру –СООН-группы, следовательно это кислота. Одна метиленовая группа –СН2- соответствует расстоянию равному 1,43 . 10-10м. Зная молярную массу, легко установить формулу кислоты – это лауриновая кислота С11Н23СООН.
Задачи для самостоятельного решения. Задача 1. При введении 1г активированного угля в 100 мл водного раствора метиленовой сини концентрация красителя меняется от начальной 1 . 10-4ммоль/л до равновесной 6 . 10-5 ммоль/л, а при добавлении 2г угля к такому же исходному раствору равновесная концентрация составила 4 . 10-5ммоль/л. Площадь, занимаемая молекулой красителя на поверхности, равна 1,65 нм2. Рассчитать удельную поверхность угля, считая, что адсорбция описывается уравнением Лэнгмюра. Задача 2. Сульфо-феноло-формальдегидный катионит (КУ-5) в количестве 2 г внесли в раствор хлорида натрия с концентрацией 0,2 моль/л объёмом 100 мл и смесь выдержали до равновесного состояния. Полная обменная ёмкость катионита 2,8 моль/кг. Константа адсорбционного равновесия К = 3,3. Определить равновесную концентрацию натрия в катионите. Лабораторная работа №3. Хроматография. Цель работы: изучить влияние некоторых факторов на адсорбцию из растворов;научиться проводить анализ и разделение сложных смесей с помощью бумажной и колоночной хроматографии и проводить капиллярный анализ смеси красителей.
ЗАНЯТИЕ 2.1.4. ТЕМА: Поверхностные явления. Адсорбционные процессы (семинар). ЦЕЛЬ ЗАНЯТИЯ: закрепить теоретические знания основ физико-химии поверхностных явлений на различных границах раздела фаз.
Теоретические вопросы. 1. Поверхностная энергия Гиббса и поверхностное натяжение. 2. Методы определения поверхностного натяжения. 3. Поверхностная активность и её измерение. Поверхностно-активные, поверхностно-инактивные и поверхностно-неактивные вещества. 4. Правило Дюкло-Траубе. 5. Адсорбция на границе раздела ж/ж, ж/г. Уравнение изотермы адсорбции Гиббса. 6. Ориентация молекул в поверхностном слое. Определение площади, занимаемой молекулой ПАВ в насыщенном адсорбционном слое и максимальной длины молекулы ПАВ. 7. Адсорбция на границах раздела т/г и т/ж. Факторы, влияющие на адсорбцию газов и растворённых веществ. 8. Мономолекулярная адсорбция, уравнение изотермы адсорбции Лэнгмюра. 9. Полимолекулярная адсорбция. 10. Уравнение изотермы адсорбции Фрейндлиха. 11. Абсорбция, хемосорбция, капиллярная конденсация. 12. Адсорбция электролитов. Виды адсорбции сильных электролитов: эквивалентная, избирательная и ионообменная. 13. Правило Панета-Фаянса. Иониты и их классификация. Обменная ёмкость ионитов. Применение ионитов в фармации. 14. Хроматография (М.С.Цвет). Классификация хроматографических методов по технике выполнения и по механизму процесса. Применение хроматографии для получения и анализа лекарственных веществ. Задачи для самостоятельного решения. Задача 1. Определить величину адсорбции (кмоль/м2) для водных растворов изовалериановой кислоты при 150С, исходя из следующих данных:
Поверхностное натяжение воды при 150С равно 73,4.10-3 н/м. Задача 2. Активная поверхность 1г силикагеля составляет 465 м2. Сколько молекул брома поглощается 1 см2 поверхности адсорбента при адсорбции на 10 г силикагеля 5 мг брома? Задача 3. На поверхность воды был нанесен раствор, содержащий 0,0065 г олеиновой кислоты С17Н33СООН в бензоле. После испарения бензола олеиновая кислота равномерно распределилась на поверхности воды. Площадь мономолекулярного слоя кислоты составила 368 см2. Каково поперечное сечение молекулы олеиновой кислоты?
В ходе семинара проводится тестированный контроль.
На занятии заслушиваются рефераты по темам: 1. «ПАВ в фармации» 2. «Жизнь и деятельность М.С.Цвета – основоположника хроматографии».
ЗАНЯТИЕ 2.1.5. ТЕМА: Термодинамика поверхностных явлений (контрольная работа№1). ЦЕЛЬ ЗАНЯТИЯ: Рубежный контроль знаний. Теоретические вопросы. 1. Поверхностная энергия Гиббса и поверхностное натяжение. 2. Поверхностная активность и её измерение. 3. Поверхностно-активные вещества (ПАВ). Строение ПАВ и их свойства. 4. Поверхностная активность и её измерение. Зависимость поверхностной активности ПАВ от длины углеводородного радикала. Правило Дюкло-Траубе. 5. Адсорбция на границе раздела ж/ж, ж/г. Уравнение изотермы адсорбции Гиббса. 6. Определение площади, занимаемой молекулой ПАВ в насыщенном адсорбционном слое и максимальной длины молекулы ПАВ. 7. Уравнение Шишковского. 8. Применение ПАВ в фармации. Требования, предъявляемые к ПАВ. 9. Основные понятия: сорбция, адсорбция, абсорбция, десорбция. 10. Физическая и химическая адсорбция. 11. Адсорбция на границах раздела: т/ж и т/г. Теория мономолекулярной адсорбции Лэнгмюра. Уравнение Лэнгмюра. 12. Полимолекулярная адсорбция. Её основные положения. 13. Уравнение адсорбции Фрейндлиха. Изотерма адсорбции Фрейндлиха. 14. Адсорбция газов. Факторы, влияющие на адсорбцию газов. 15. Капиллярная конденсация. 16. Применение адсорбции на границе раздела т/г и т/ж для очистки лекарственных средств от балластных веществ, для извлечения действующих веществ из растительного сырья. 17. Молекулярная и ионная адсорбция. 18. Классификация адсорбентов. 19. Влияние различных факторов на величину адсорбции: природа среды, теплота смачивания, растворимость, пористость адсорбента, молярная масса, время, температура, концентрация. 20. Влияние природы адсорбента и адсорбтива. Правило Ребиндера. 21. Адсорбция сильных электролитов: эквивалентная, избирательная и обменная. Правило Панета-Фаянса. 22. Иониты. Классификация. Применение в фармации. Обменная ёмкость ионитов. 23. Явление смачивания. Теплота смачивания. Краевой угол смачивания. Инверсия смачивания. 24. Хроматография. Классификация хроматографических методов. Применение хроматографии для получения и анализа лекарственных веществ.
ЗАНЯТИЕ 2.2.1. ТЕМА: Получение и свойства коллоидных растворов. ЦЕЛЬ ЗАНЯТИЯ: ознакомиться с некоторыми методами и особенностями получения коллоидных растворов. Научиться отличать коллоидные и истинные растворы по их молекулярно-кинетическим и оптическим свойствам. ЗНАЧЕНИЕ ИЗУЧАЕМОЙ ТЕМЫ: Некоторые лекарственные формы: протаргол, колларгол, желатиноль, представляют собой коллоидные растворы. В основе технологических процессов получения таких лекарственных форм лежат изучаемые в данной теме общие способы получения коллоидных растворов, а также методы их очистки. Диализ и электродиализ широко используют при различных биохимических исследованиях, в частности, для очистки белковых фракций от примесей низкомолекулярных веществ. По принципу диализатора функционирует аппарат «искусственная почка». Теоретические вопросы.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 499; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.228.40 (0.28 с.) |

 G гексановой к-ты = 3,2 = 32,8 (раза)
G гексановой к-ты = 3,2 = 32,8 (раза)

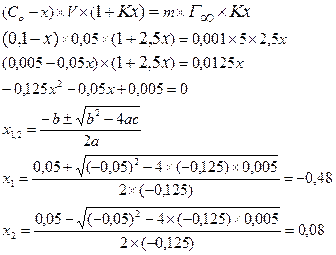


 Строим график в координатах: 1g х/m - 1g С:
Строим график в координатах: 1g х/m - 1g С:


