
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие об энтропии. Понятие об энергии гиббса⇐ ПредыдущаяСтр 14 из 14
Известно, что более устойчивыми системами являются те, которые обладают меньшей энергией. Система стремиться к минимуму энергии. Например, в механике соблюдается принцип стремления к минимуму потенциальной энергии – энергии расположения тела в гравитационном поле Земли. Тело самопроизвольно стремится приблизиться к Земле, при этом его потенциальная энергия уменьшается. Убыль потенциальной энергии не зависит от пути тела, а определяется только начальной и конечной высотой. Таким образом, потенциальная энергия есть мера стремления тела к Земле. Для химических процессов также есть критерий самопроизвольного протекания. Ответить на вопрос, может ли данная реакция протекать самопроизвольно (при данных условиях), можно с использованием величины энергии Гиббса G, которую также называют изобарно-изотермическим потенциалом или просто изобарным потенциалом. Если в процессе химической реакции происходит увеличение G, т.е. если ∆G>0, то самопроизвольное протекание этого процесса невозможно, как невозможно самопроизвольное перемещение тела снизу вверх. Необходимым условием принципиальной осуществимости процесса является неравенство ∆G<0. Тепловой эффект реакции и энергия Гиббса связаны уравнением ∆G = ∆Н - Т∙∆S, где Т – абсолютная температура, а S – энтропия, количественная мера беспорядка в системе. Таким образом, направление самопроизвольного протекания химического процесса определяется двумя факторами: ∆Н и ∆S. Любая система стремится к возрастанию S и к уменьшению Н. Возможность протекания процесса (когда ∆G<0) зависит от того, какой вклад (Н или S) в G окажется больше. 1). При величинах температуры, близких к Т=0 ∆G определяется исключительно величиной и знаком ∆Н. При этом реакции идут в сторону, когда теплота выделяется: ∆Н<0 и ∆G<0. 2). При температурах, близких к комнатной, Т∙∆S << ∆H. Поэтому знак и значение ∆G определяется в основном ∆Н. Следовательно, в обычных условиях более вероятны экзотермические реакции. 3). При высоких температурах (Т>1000 К) |Т∙∆S| > |∆Н| и знак ∆G зависит от знака Т∙∆S, т.е. знака ∆S (Т всегда больше 0). Если ∆S>0, то с увеличе7ием температуры Т∙∆S становится все более отрицательнее, и реакция делается все более вероятной. Если ∆S<0, то Т∙∆S>0 и вероятность реакции с ростом температуры уменьшается. Следовательно, при очень высоких температурах более вероятны реакции, приводящие к увеличению S, т.е. когда число частиц в продуктах реакции больше, чем в исходных веществах.
Для веществ при стандартных условиях составлены таблицы стандартных значений ∆Н0298 и S0298, а также ∆G0298 (∆G рассчитаны для реакций образования соединений из простых веществ). На основании этих данных можно рассчитать тепловые эффекты реакций, энергии связей простых молекул, а также определить принципиальную возможность протекания реакций (пользуясь законом Гесса и следствиями из него).
Химическая кинетика Химическая кинетика – это учение о скорости химической реакции. Скорость химической реакции определяется изменением концентраций реагирующих веществ в единицу времени. Средняя скорость реакции (моль/дм3∙с) вычисляется по формуле: V = (с0 - сτ) / τ, где с0 – концентрация в начальный момент времени, моль/дм3; сτ – концентрация по прошествии времени τ. Скорость химической реакции зависит от многих факторов: - природы реагирующих веществ; - концентрации реагентов; - температуры; - присутствия катализатора; - давления (для газообразных веществ); - степени измельчения (для твердых веществ); - природы среды (для растворов); - интенсивности облучения (для фотохимических, радиационно-химических реакций) и др. Основными факторами, влияющими на скорость реакции, являются первые четыре. 1. Зависимость от природы реагирующих веществ. Например, реакции с одним и тем же веществом – кислородом в зависимости от природы другого вещества протекают с разной скоростью: 2NO + O2 = 2NO2 – протекает при обычных условиях с большой скоростью; 2СO2 + O2 = 2СО2 – при обычных условиях практически не протекает. 2. Влияние концентрации реагирующих веществ. Химическая реакция – это результат столкновения атомов, молекул, ионов (во время их неупорядоченного движения). Чем чаще происходят столкновения, тем выше скорость реакции. Число столкновений, а значит и скорость реакции зависит от концентрации. Концентрации веществ влияют на скорость в соответствии с законом действующих масс (1867 г.):
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степени, равной стехиометрическим коэффициентам в уравнении реакции. Для химической реакции общего вида аА + вВ = сС + dD скорость реакции выражается V = k∙cAа∙сВв, Где k – это константа скорости реакции, физический смысл которой следующий: это такая скорость реакции, когда произведение концентраций реагирующих веществ равно единице (когда концентрации равны 1 моль/дм3). Для сравнения различных реакций обычно сравнивают их константы скорости. Зависимость скорости химической реакции от концентрации называется кинетическим уравнением. В кинетике химические реакции подразделяют по молекулярности и по порядку. Молекулярность реакции определяет число частиц, участвующих в элементарном акте реакции. Реакции могут быть мономолекулярными, бимолекулярными и очень редко – тримолекулярными. Таким образом молекулярность указывает на механизм протекания реакции. Вероятность одновременного столкновения более трех частиц ничтожно мала, поэтому реакции с молекулярностью более 3 не встречаются. Если, согласно уравнению реакции, в столкновении принимают участие большее количество молекул - следовательно это сложная реакция, протекающая многостадийно. Порядок реакции равен сумме показателей степеней концентраций веществ в кинетическом уравнении реакции. Реакции могут быть первого, второго и третьего порядка. Молекулярность и порядок реакции совпадают только для простых реакций. 3. Влияние температуры. С увеличением температуры увеличивается скорость движения частиц вещества, а значит и частота столкновений молекул, т.е. скорость реакции. Установлено (правило Вант-Гоффа), что с увеличением температуры на 10 0 скорость реакции возрастает в 2- 4 раза: kt+10 / kt = γ, где γ – температурный коэффициент скорости реакции. γ = 2 – 4. Такое высокое увеличение скорости с ростом температуры нельзя объяснить возрастанием общего числа столкновений (соударений) молекул. Кроме того, вычислено, что если бы каждое столкновение молекул, происходящее в веществе, приводило бы к акту взаимодействия, то все реакции протекали бы со скоростью взрыва. На самом деле к акту взаимодействия приводят не любые соударения молекул, а только незначительное их число – число эффективных или активных соударений. И с ростом температуры возрастает именно число активных соударений, и этот рост гораздо сильнее, чем рост общего числа соударений. К реакции приводит столкновение «активных» молекул, т.е. обладающих повышенным запасом энергии, достаточным для «расшатывания» химических связей. Молекулы, обладающие этим необходимым запасом энергии, называются активированными молекулами. При нагревании веществ активация молекул происходит благодаря ускорению их поступательного движения и усилению колебательного движения атомов и атомных групп в самой молекуле. Таким образом, чтобы молекулы прореагировали, им нужно преодолеть некоторый энергетический барьер. Для реакции А + В = С молекула вещества С образуется в результате того, что активированные молекулы А и В при столкновении вначале образуют активированный комплекс АВ, внутри которого происходит перераспределение атомов и связей. Энергию, необходимую для возбуждения молекул до энергии активированного комплекса, называют энергией активации Еак ..
Энергетический рельеф реакционных путей для экзотермического (а) и эндотермического (б) процессов представляется следующим образом. а) б)
АВ АВ
А+В А+В ∆Н
∑∆Нисх. ∑∆Нпрод. ∑∆Нисх
Реакционный путь Реакционный путь
Разность между энергией (энтальпией) продуктов реакции и исходных веществ (∆Н) является тепловым эффектом реакции. Взаимосвязь между энергией активации и константой скорости реакции определяется уравнением Аррениуса: k = A∙e-Е/RT, где А – коэффициент, связанный с вероятностью и числом столкновений; Е – энергия активации; Т - абсолютная температура; R – газовая постоянная; k – константа скорости реакции. Из уравнения следует: константа скорости (скорость) возрастает при уменьшении энергии активации. 4. Катализаторы. Путь протекания реакции, а следовательно и Еак. может быть изменен введением в систему катализатора. Катализаторами называются вещества, которые (в очень небольших количествах) влияют на скорость реакции, но сохраняют свой химический состав в процессе промежуточных стадий. Изменение скорости химической реакции под влиянием катализаторов называется катализом. Катализаторы могут быть положительными и отрицательными (отрицательные называются ингибиторами). Отрицательные катализаторы связывают активные промежуточные молекулы и радикалы и препятствуют протеканию реакции по пути с наименьшей Еак.. Положительные катализаторы снижают Еак., что приводит к возрастанию доли реакционных частиц. Катализаторы могут быть гомогенными и гетерогенными. Гомогенные – когда находятся в одном и том же агрегатном состоянии хотя бы с одним из реагентов; гетерогенные – в ином агрегатном состоянии. Гомогенный катализ протекает, чаще всего, с образованием неустойчивых промежуточных продуктов с катализатором. Например, А + В → С - реакция с большой величиной Еак.. В присутствии катализатора К последовательно протекают реакции: А + К → АК, Е’ак. АК + В → С + К, Е”ак..
Если Е’ак. и Е”ак. меньше Еак., то катализатор является положительным. Например: 2SO2 + O2 = 2SO3 – без катализатора реакция практически не идет. 2NO + O2 = 2NO2 – идет легко. SO2 + NO2 = SO3 + NO – тоже легко идет. Следовательно, NO – это катализатор (гомогенный), NO2 – промежуточное соединение. Гетерогенный катализ можно объяснить теорией активированной адсорбции (адсорбция – это свойство вещества поглощать на своей поверхности другие вещества). Наиболее признанной теорией гетерогенного катализа является мультиплетная теория (Баландина). Сущность ее в том, что способность катализатора ускорять реакцию зависит от пространственной структуры реагирующих молекул и от геометрии расположения каталитических активных центров на поверхности катализатора. В качестве активных центров часто выступают просто атомы на поверхности катализатора. Реагирующие молекулы адсорбируются на этих центрах. Необходимо, чтобы геометрическое расположение активных центров соответствовало расположению атомов в катализируемой молекуле. Молекулы адсорбируются на нескольких активных центрах, в результате чего ослабляются химические связи и происходит их перераспределение. Для различных реакций число адсорбционных центров в одном каталитически активном центре может быть 2, 4, 6 и т.д. Такие центры названы дуплетами,…, секстетами, т.е. мультиплетами. Например, обменная реакция АВ + СД = АС + ВД с двумя атомами катализатора К (дуплет):
С – Д С∙∙∙Д С Д
Каталитически активные центры К расположены на таких расстояниях, что в адсорбированных молекулах АВ и СД перераспределяются только химические связи, а положение атомов не изменяется. Вслед за перераспределением связей происходит десорбция молекул АС и ВД. Пример: 2SO2 + O2 = 2SO3 протекает на поверхности твердых катализаторов V2O5 или Pt.
Химическое равновесие
Пределом протекания обратимой реакции является состояние химического равновесия, при котором скорости прямой и обратной реакций становятся равными. Например, обратимой является реакция
Согласно закону действующих масс: скорость прямой реакции V1 = k1∙C(H2)∙C(I2); скорость обратной реакции V2 = k2∙C2(HI). В состоянии химического равновесия V1 = V2. Следовательно, химическое равновесие – это динамическое равновесие, т.к. непрерывно протекают и прямая и обратная реакции, но скорости протекания у них одинаковы. Концентрации реагентов при установившемся равновесии - равновесные концентрации остаются постоянными. Количественной характеристикой состояния равновесия является константа равновесия – К: К = k1/k2 = C2(HI) / C(H2)∙C(I2). Численное значение константы равновесия зависит от природы веществ, от температуры (т.к. скорости прямой и обратной реакций по-разному изменяются при изменении температуры), но не зависит от концентрации, давления, объема. Зная К и исходные концентрации веществ, можно рассчитать равновесные концентрации (т.е. выход).
При неизменных внешних условиях состояние химического равновесия может сохраняться сколь угодно долго. Изменение условий приводит к изменению состояния равновесия, пока установится новое равновесие с новыми равновесными концентрациями. Переход из одного равновесного состояния к другому называется смещением или сдвигом равновесия. Закономерное влияние внешних условий на положение химического равновесия определяется принципом Ле-Шателье. Если на систему, находящуюся в устойчивом равновесии, оказать какое-либо воздействие, то в системе усиливаются те процессы, которые стремятся свести это воздействие к минимуму. В соответствии с принципом Ле-Шателье: - если увеличить концентрацию какого-либо исходного вещества, то усиливается прямая реакция; если увеличить концентрацию какого-либо продукта реакции, то усиливается обратная реакция; - если увеличить температуру, то произойдет сдвиг равновесия в сторону эндотермической реакции; если понизить температуру – в сторону экзотермической реакции; - при изменении давления равновесие смещается только в тех обратимых реакциях, которые сопровождаются изменением объемов газообразных веществ: повышение давления сдвигает равновесие в сторону меньших объемов, а понижение – в сторону больших объемов. Катализаторы не могут сдвинуть равновесие, т.к. катализатор в одинаковой степени влияет и на прямую и на обратную реакции. Однако они способствуют более быстрому наступлению состояния равновесия.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 319; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.102.182 (0.04 с.) |

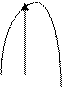
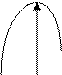

 Еак. Еак. С
Еак. Еак. С





 А – В А∙∙∙В А В
А – В А∙∙∙В А В
 К К ↔ К К ↔ К | | К
К К ↔ К К ↔ К | | К


 H2 + I2 2HI.
H2 + I2 2HI.


