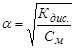Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вещества, которые практически полностью диссоциируют на ионы, относят к сильным электролитам.
Диссоциация электролитов Электролитами называют вещества, растворы или расплавы которых проводят электрический ток. Переносчиками тока в растворах электролитов являются ионы, которые образуются в результате диссоциации растворенного вещества. Электролитической диссоциацией называют распад ионных или полярных соединений на ионы под действием полярных молекул растворителя. По способности к диссоциации все вещества делятся на две группы: к одной относятся такие вещества, которые в растворе оказываются диссоциированы нацело или практически нацело; к другой группе относятся вещества, диссоциирующие частично. Реакции обмена в растворах электролитов
Уравнения реакций обмена обычно записывают в молекулярной и ионно-молекулярной формах. Молекулярная форма уравнения показывает, какие вещества можно выделить из раствора и рассчитать их количества. Ионно-молекулярная форма уравнения позволяет определить возможность превращения и его причины, которые сводятся к образованию малорастворимого либо малодиссоциированного соединения. Такие уравнения позволяют также предсказать принципиальную обратимость или необратимость взаимодействия. В ионных уравнениях формулы веществ записывают в виде ионов или в виде молекул. В виде ионов записывают формулы сильных электролитов. В виде молекул записывают формулы воды, слабых электролитов, малорастворимых солей (↓), формулы газообразных веществ, формулы оксидов металлов и неметаллов.
1) AgNO3 + NaCl → AgCl↓ + NaNO3; Ag+ + NO3- + Na+ + Cl- → AgCl↓ + Na+ + NO3- ; Ag+ + Cl- → AgCl↓.
2) Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑; 2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + H2O + CO2↑; CO32- + 2H+ → H2O + CO2↑.
3) NaOH + HCl → NaCl + H2O; Na+ + OH- + H+ + Cl- → 2Na+ + Cl- + H2O; H+ + OH- → H2O.
4) HgI2 + 2KI → K2[HgI4]; HgI2 + 2K+ + 2I- → 2K+ + [HgI4]2-; HgI2 + 2I- → [HgI4]2-.
Опыт № 3. Движение ионов в электрическом поле На дно U-образной трубки поместите несколько кристалликов перманганата калия, завёрнутых в фильтровальную бумагу. Затем в трубку налейте 1% раствор нитрата калия так, чтобы электроды были погружены в раствор. В оба конца вставьте угольные электроды. Прибор готовят за 5-10 мин. до эксперимента. За это время перманганат успевает раствориться и окрашенный раствор займёт нижнюю часть трубки. Прибор подключают к источнику тока с напряжения 10-12 в. Через несколько минут окрашенные перманганат-ионы смещаются к аноду. Это замечается по перемещению малиновой окраски в ту часть жидкости, в то колено U-образной трубки, где находится анод.
Примечание: Успешное проведение опыта зависит от равномерного окрашивания нижней части раствора перед подведением напряжения к электродам, а также не следует увеличивать напряжение для более быстрого проведения опыта. Увеличение напряжения приводит к перемешиванию раствора и окрашенных слоёв. Объясните наблюдаемое явление? Почему окрашенные перманганат-ионы смещаются к аноду? Напишите уравнение диссоциации перманганата натрия и процессов происходящих на электродах. Диссоциация электролитов Электролитами называют вещества, растворы или расплавы которых проводят электрический ток. Переносчиками тока в растворах электролитов являются ионы, которые образуются в результате диссоциации растворенного вещества. Электролитической диссоциацией называют распад ионных или полярных соединений на ионы под действием полярных молекул растворителя. По способности к диссоциации все вещества делятся на две группы: к одной относятся такие вещества, которые в растворе оказываются диссоциированы нацело или практически нацело; к другой группе относятся вещества, диссоциирующие частично. Вещества, которые практически полностью диссоциируют на ионы, относят к сильным электролитам.
KCl → К+ + Сl- Вещества, диссоциирующие в растворах не полностью, называются слабыми электролитами. В растворах слабых электролитов устанавлbвается динамическое равновесие между недиссоциированными молекулами и ионами:
НСN ↔ Н+ + СN- Это равновесие количественно характеризуется константой равновесия, которая применительно к процессу диссоциации называется константой диссоциации:
Константа диссоциации электролита не зависит от концентрации раствора, но зависит от его температуры, а также от природы растворенного вещества и растворителя. Чем меньше значение константы, тем слабее электролит.
Таким образом, принципиальное отличие двух типов электролитов заключается в необратимости диссоциации сильных электролитов и обратимости диссоциации слабых электролитов. Количественной характеристикой способности электролита распадаться на ионы является степень диссоциации – a. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе. Степень диссоциации электролита в 0,1 н. растворе принимают в качестве критерия для отнесения электролита к группе сильных или слабых электролитов: для сильных электролитов a > 0,3, для слабых электролитов a ≤ 0,03. Применительно к водным растворам сильными электролитами являются: - cильные кислоты: HCI, HBr, НJ, НNO3, H2SO4, HCIO4, HClO3, HMnO4, H2SeO4; - cильные основания: гидроксиды щелочных и щелочноземельных металлов: KОH, NаОН, Ca(OH)2, Ba(OH)2, Sr(OH)2; - большинство растворимых солей. Исключения: Fe(SCN)3, Mg(CN)2, HgCl2, Hg(CN)2 и др.
К слабым электролитам относятся: - слабые кислоты: H2CO3, H2S, H3BO3, HCN, CH3COOH, H2SO3, H3PO4, H2SO3, H2SiO3 и большинство органических веществ; - cлабые основания и амфотерные гидроксиды металлов: Be(OH)2, Mg(OH)2, Fe(OH)2, Zn(OH)2, гидроксид аммония NH4OH, а также органические основания – амины(CH3NH2) и амфолиты(H3N+CH2COO-); - очень слабым электролитом является вода (H2O), a = 2·10-9. В случае электролита АХ, диссоциирующего на ионы А+ и Х-, константа и степень диссоциации связаны соотношением (закон разбавления Оствальда):
См- молярная концентрация электролита, моль/л. Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять, что 1 - a Кдисс = a2СМ, откуда
Последнее соотношение показывает, что при разбавлении раствора, т.е. при уменьшении концентрации электролита (СМ) степень диссоциации электролита возрастает. Константа диссоциации не зависит от концентрации электролита и при постоянной температуре K д, с = const, а степень диссоциации слабого электролита тем больше, чем ниже концентрация, то есть чем больше разбавлен раствор. При введении в равновесный раствор ионов Н+ или А произойдет сдвиг равновесия диссоциации влево в соответствии с принципом Ле-Шателье и установится новое равновесие с другими концентрациями [H+], [А] и [HА]недисс, но с той же K д, с . Константа диссоциации будет меняться только при варьировании температуры. Так как диссоциация эндотермический процесс, т.е. Δ Н дисс>0, то константа диссоциации растет с увеличением температуры.
|
||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 1182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.21.86 (0.012 с.) |
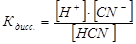 .
.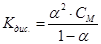 ,
,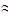 1. Тогда выражение закона разбавления упрощается:
1. Тогда выражение закона разбавления упрощается: