
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Потенциометрическое кислотно–основное титрованиеСтр 1 из 2Следующая ⇒ Потенциометрия
Потенциометрический метод анализа основан на измерении равновесного электродного потенциала и нахождении эависимости между его величиной и концентрацией, точнее, активностью потенциалопределяющего компонента в растворе. Возникновение электродного потенциала связано с электрохимическим процессом, происходящим на границе раздела электрод – раствор. Индикаторный (рабочий) электрод – электрод, потенциал которого зависит от концентрации (активности) определяемого соединения в растворе в соответствии с уравнением Нернста. В качестве индикаторного электрода используют стеклянные, металлические, мембранные электроды. Практически невозможно измерять потенциалы отдельного электрода. Поэтому необходимо составить гальванический элемент (электрохимическую ячейку) из двух полуэлементов с электродами, между которыми возникает разность потенциалов, при этом потенциал одного электрода постоянен и заранее известен. Такие электроды, относительно которых определяют потенциал индикаторного электрода, носят название электродов сравнения. По международному соглашению в качестве стандартного электрода сравнения принят стандартный водородный электрод. Но так как водородный электрод малопригоден в обычных условиях работы (трудоемкость его приготовления), то на практике используют другие электроды сравнения, например, насыщенный каломельный электрод или хлоридсеребряный электрод. Наиболее распространен хлоридсеребряный электрод сравнения, который представляет собой серебряную проволоку с нанесенным хлоридом серебра. Электрод погружают в раствор хлорида калия, который находится в сосуде, связанном солевым мостиком с анализируемым раствором. При работе с хлоридсеребряным электродом необходимо следить за тем, чтобы внутренний сосуд был заполнен насыщенным раствором хлорида калия. Потенциометрические измерения проводят с помощью потенциометров. Большинство применяемых потенциометров рассчитано на измерение рН, поэтому их называют рН–метрами. По назначению потенциометрический метод анализа может быть классифицирован как прямая потенциометрия и как потенциометрическое титрование. Прямая потенциометрия – метод, основанный на измерении точной величины электродного потенциала и нахождению по уравнению Нернста активности потенциалопределяющего иона в растворе. Наиболее важная область применения прямой потенциометрии – ионометрия. Широкое применение в практике аналитической химии нашел другой раздел потенциометрии, известный под названием потенциометрическое титрование. Потенциометрическое титрование – способ определения концентрации определяемого компонента в растворе путем наблюдения за изменением потенциала индикаторного электрода, находящегося в равновесии с определяемым ионом. Анализируемый раствор титруют, измеряя в процессе титрования потенциал электрода, который изменяется с изменением доли прореагировавших веществ, причем наиболее заметно в точке эквивалентности. При потенциометрическом титровании могут быть использованы все типы химических реакций: кислотно–основные, окислительно–восстановительные, осаждения и комплексообразования, которые должны удовлетворять следующим требованиям: – титруемое вещество и титрант должны реагировать между собой в стехиометрическом соотношении; – должен применяться доступный индикаторный электрод; – реакция должна протекать количественно (константа равновесия должна быть большой); – равновесие между реагирующими компонентами и индикаторным электродом должно устанавливаться быстро.
В потенциометрическом титровании в качестве индикатора используют электроды потенциометра, опущенные в титруемый раствор. При этом применяют электроды, чувствительные к титруемым ионам. В процессе титрования изменяется концентрация ионов, что регистрируется на шкале измерительного прибора потенциометра. Записав показания потенциометра в единицах рН или мВ, строят график их зависимости от объема титранта (кривую титрования), определяют точку эквивалентности и объем титранта, израсходованный на титрование.
а) строя зависимость изменения потенциала от объема прибавленного титранта (интегральную кривую титрования) и находя среднюю точку участка, соответствующую вертикальному подъему кривой (рисунок, кривая а); б) рассчитывая изменение потенциала на единицу изменения объема (∆E/∆V), т.е. строя кривую титрования в дифференциальной форме в координатах ∆E/∆V – V. Максимум на такой кривой соответствует точке эквивалентности (рисунок, кривая б); в) определяя точку, когда вторая производная потенциала по объему (∆2E/∆V2) будет равна нулю (рисунок, кривая в) – это более точный способ определения точки эквивалентности.
Ход работы
Потенциометрическое титрование Fe2+ 1. Получите у лаборанта мерную колбу с раствором соли железа(II), доведите до метки дистиллированной водой и хорошо перемешайте. 2. Заполните бюретку стандартным раствором K2Cr2O7. 3. В стакан для титрования пипеткой отмерьте раствор соли Fe2+, погрузите в него платиновый и хлоридсеребряный электроды и ротор магнитной мешалки. 3. Первое титрование ориентировочное. К раствору Fe2+ добавляйте по 1 мл раствора K2Cr2O7 и измеряйте ЭДС после каждого добавления титранта. Результаты занесите в табл. 1. Таблица 1 Результаты ориентировочного титрования раствора Fe2+ дихроматом калия V(Fe2+) = C(1/6K2Cr2O7) =
Постройте кривую титрования и по результатам ориентировочного титрования определите примерное положение скачка титрования и точки эквивалентности. 4. При втором титровании добавьте к аликвоте анализируемого раствора объем титранта, соответствующий началу скачка, а затем проводите титрование, приливая по 0,1 мл титранта и измеряя ЭДС после установления постоянного значения показаний прибора. Результаты измерений занесите в табл. 2. Таблица 2 Результаты точного титрования раствора Fe2+ раствором K2Cr2O7 V(Fe2+) = C(1/6K2Cr2O7) =
5. Постройте дифференциальную кривую титрования, определите V(K2Cr2O7)т.э. и рассчитайте массу Fe3+ в анализируемом растворе.
Вопросы для допуска к выполнению лабораторных работ по потенциометрии
1. Как классифицируются электрохимические методы анализа?
2. На чем основаны потенциометрические методы анализа?
3. Какие функции выполняют индикаторные электроды и какие – электроды сравнения? 4. Устройство стеклянного электрода. 5. Устройство хлорид-серебряного электрода
6. Какие индикаторные электроды могут быть использованы для определения рН?
7. В каких координатах следует строить градуировочный график в методе прямой потенциометрии, чтобы он был линейным?
8. В каких координатах строят кривые потенциометрического титрования? Чем обусловливается выбор координат?
9. Назовите соответствующие пары электродов и приведите примеры потенциометрического титрования с использованием: а) реакций кислотно-основного взаимодействия; б) реакций осаждения; в) реакций окисления-восстановления.
10. Почему невозможно точное определение содержания HCl и CH3COOH в водном растворе при их совместном присутствии методом кислотно-основного титрования? Каким приемом устраняется это препятствие?
11. По каким формулам рассчитывают массы хлороводородной и уксусной кислот при их определении методом потенциометрического кислотно-основного титрования?
12. Почему при титровании ортофосфорной кислоты щелочью на кривой титрования наблюдается только два скачка титрования?
13. Почему при титровании смеси Cl– и I– –ионов раствором нитрата серебра вначале осаждаются I– –ионы, а затем Cl– –ионы?
Потенциометрия
Потенциометрический метод анализа основан на измерении равновесного электродного потенциала и нахождении эависимости между его величиной и концентрацией, точнее, активностью потенциалопределяющего компонента в растворе. Возникновение электродного потенциала связано с электрохимическим процессом, происходящим на границе раздела электрод – раствор. Индикаторный (рабочий) электрод – электрод, потенциал которого зависит от концентрации (активности) определяемого соединения в растворе в соответствии с уравнением Нернста. В качестве индикаторного электрода используют стеклянные, металлические, мембранные электроды. Практически невозможно измерять потенциалы отдельного электрода. Поэтому необходимо составить гальванический элемент (электрохимическую ячейку) из двух полуэлементов с электродами, между которыми возникает разность потенциалов, при этом потенциал одного электрода постоянен и заранее известен. Такие электроды, относительно которых определяют потенциал индикаторного электрода, носят название электродов сравнения. По международному соглашению в качестве стандартного электрода сравнения принят стандартный водородный электрод. Но так как водородный электрод малопригоден в обычных условиях работы (трудоемкость его приготовления), то на практике используют другие электроды сравнения, например, насыщенный каломельный электрод или хлоридсеребряный электрод. Наиболее распространен хлоридсеребряный электрод сравнения, который представляет собой серебряную проволоку с нанесенным хлоридом серебра. Электрод погружают в раствор хлорида калия, который находится в сосуде, связанном солевым мостиком с анализируемым раствором. При работе с хлоридсеребряным электродом необходимо следить за тем, чтобы внутренний сосуд был заполнен насыщенным раствором хлорида калия. Потенциометрические измерения проводят с помощью потенциометров. Большинство применяемых потенциометров рассчитано на измерение рН, поэтому их называют рН–метрами. По назначению потенциометрический метод анализа может быть классифицирован как прямая потенциометрия и как потенциометрическое титрование. Прямая потенциометрия – метод, основанный на измерении точной величины электродного потенциала и нахождению по уравнению Нернста активности потенциалопределяющего иона в растворе. Наиболее важная область применения прямой потенциометрии – ионометрия. Широкое применение в практике аналитической химии нашел другой раздел потенциометрии, известный под названием потенциометрическое титрование. Потенциометрическое титрование – способ определения концентрации определяемого компонента в растворе путем наблюдения за изменением потенциала индикаторного электрода, находящегося в равновесии с определяемым ионом. Анализируемый раствор титруют, измеряя в процессе титрования потенциал электрода, который изменяется с изменением доли прореагировавших веществ, причем наиболее заметно в точке эквивалентности. При потенциометрическом титровании могут быть использованы все типы химических реакций: кислотно–основные, окислительно–восстановительные, осаждения и комплексообразования, которые должны удовлетворять следующим требованиям: – титруемое вещество и титрант должны реагировать между собой в стехиометрическом соотношении; – должен применяться доступный индикаторный электрод; – реакция должна протекать количественно (константа равновесия должна быть большой); – равновесие между реагирующими компонентами и индикаторным электродом должно устанавливаться быстро.
В потенциометрическом титровании в качестве индикатора используют электроды потенциометра, опущенные в титруемый раствор. При этом применяют электроды, чувствительные к титруемым ионам. В процессе титрования изменяется концентрация ионов, что регистрируется на шкале измерительного прибора потенциометра. Записав показания потенциометра в единицах рН или мВ, строят график их зависимости от объема титранта (кривую титрования), определяют точку эквивалентности и объем титранта, израсходованный на титрование.
а) строя зависимость изменения потенциала от объема прибавленного титранта (интегральную кривую титрования) и находя среднюю точку участка, соответствующую вертикальному подъему кривой (рисунок, кривая а); б) рассчитывая изменение потенциала на единицу изменения объема (∆E/∆V), т.е. строя кривую титрования в дифференциальной форме в координатах ∆E/∆V – V. Максимум на такой кривой соответствует точке эквивалентности (рисунок, кривая б); в) определяя точку, когда вторая производная потенциала по объему (∆2E/∆V2) будет равна нулю (рисунок, кривая в) – это более точный способ определения точки эквивалентности.
Потенциометрическое кислотно–основное титрование Кривые потенциометрического кислотно–основного титрования показывают изменение рН раствора в ходе титрования. Форма кривой титрования, положение точки эквивалентности, величина скачка потенциала (рН) на кривой титрования зависят от силы кислоты и основания и состава раствора. Потенциометрическое титрование удобно для определения очень слабых кислот и оснований, когда применение цветных индикаторов, меняющих окраску в интервале двух единиц рН, приводят к значительным ошибкам, а также для определения смесей слабых кислот (оснований) или многоосновных кислот, если соответствующие константы диссоциации компонентов отличаются друг от друга по меньшей мере на четыре порядка. Точное определение сильной кислоты в смеси сильной и слабой кислот возможно, если Ка слабой кислоты меньше или равна 10–5. В качестве индикаторного электрода применяют любой электрод, потенциал которого является функцией концентрации ионов водорода: водородный, хингидронный, сурьмяной, стеклянный. Чаще всего в кислотно–основном титровании в качестве индикаторного электрода используют стеклянный электрод, представляющий собой тонкостенный шарик из специального стекла. Шарик припаян к стеклянной трубке (корпусу электрода). Внутри шарика находится 0,1 моль/л раствор HCl и серебряная проволочка, покрытая хлоридом серебра (хлоридсеребряный электрод), посредством которой электрод присоединяется к измерительному прибору. Стеклянный электрод в паре с электродом сравнения (хлоридсеребряным электродом), погруженные в анализируемый раствор, образуют электрохимическую ячейку. Величина ЭДС в такой ячейке зависит от активности ионов водорода в растворе: E = K – 0,059·lg a (H3O+) = K + 0,059·pH, где К – постоянная, связанная с неоднородностью стеклянной мембраны. Стеклянные электроды хранят в воде или в растворе KCl. Высыхание нарушает стабильную работу электрода и требует предварительного длительного замачивания.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 3694; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.183.14 (0.005 с.) |
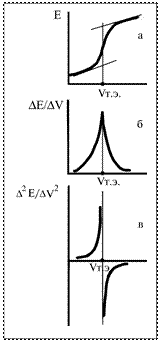 Точку эквивалентности определяют:
Точку эквивалентности определяют:


