Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
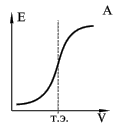
Определение точки эквивалентности
Для точного определения конечной точки титрования необходимо, чтобы на кривой титрования вблизи точки эквивалентности наблюдался перегиб (скачок). Это требование устанавливает пределы как для минимальной определяемой концентрации, так и для минимальной константы равновесия, приемлемой для реакции титрования. Видно, что при уменьшении концентрации скачок становится менее выраженным. Нижний предел концентрации зависит от конкретной реакции и метода определения конечной точки титрования, но проводить титрование при концентрациях ниже 10–4 М уже затруднительно. Для реакций нейтрализации в водных растворах константа равновесия в случае сильной кислоты и сильного основания составляет 1014, а для слабой кислоты и сильного основания – 1014 K a, где K a – константа диссоциации кислоты. По мере уменьшения константы равновесия уменьшается и величина скачка. Чтобы визуальное определение конечной точки титрования было надежным, константа равновесия не должна быть меньше 106.
|
||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 148; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.42.94 (0.003 с.) |