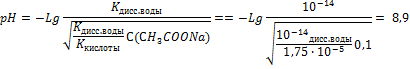Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2: Буферные системы и их роль в организме человека
Дайте краткий ответ на теоретические вопросы: 1. Понятие кислотно-основного состояния и его нарушение: алкалоз, ацидоз 2. Кислотно-основное состояние (кислотно-щелочная реакция) - это исключительно важная постоянная характеристика крови, которая обеспечивает нормальное течение окислительно-восстановительных процессов в организме, ферментативную активность, а также направление и интенсивность всех видов обмена веществ. 3. У здорового человека рН артериальной крови составляет 7,35-7,45, т.е. кровь имеет слабощелочную реакцию. Снижение величины рН свидетельствует о сдвиге реакции крови в кислую сторону, что называется «ацидоз» (рН < 7,35), а увеличение данного показателя свыше 7,45 - о сдвиге реакции крови в щелочную сторону (алкалозе).
2.Механизм действия компонентов буферных систем при поддержании рН. Механизм действия буферной системы рассмотрим на примере аммиачной буферной системы: NН4ОН (NН3 х Н2О) + NН4С1. Гидроксид аммония - слабый электролит, в растворе частично диссоциирует на ионы: NН4ОН <=> NН4+ + ОН- При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы NН4С1 > NН4+ + С1- и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции. Поэтому С (NН4ОН)? С (основания); а С (NН4+)? С (соли). Если в буферном растворе С (NН4ОН) = С (NН4С1), то рН = 14 - рКосн. = 14 + lg 1,8.10-5 = 9,25.
Способность буферных смесей поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами аммиака или гидроксида аммония, а не увеличивать концентрацию ионов Н+ и уменьшать рН раствора. При добавлении щелочи ионы ОН - будут связывать ионы NН4 +, образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора. Буферное действие прекращается, как только одна из составных частей буферного раствора (сопряженное основание или сопряженная кислота) полностью израсходуется. Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью. По мере увеличения концентрации буферного раствора возрастает его способность сопротивляться изменению рН при добавлении кислот или щелочей. Свойство растворов сохранять значение рН в определенных пределах при добавлении небольших количеств кислоты или щелочи называется буферным действием. Растворы, обладающие буферным действием, называются буферными смесями.
Решите задачи: Задача 1 рН буферного раствора, состоящего из 20мл раствора СН3СООН и 40мл раствора СН3СOONa в одинаковой молярной концентрации равен: (рКСН3СООН = 4,75; lg 2 = 0,3) а) 4,45 б) 5,05 + в) 3,75 г) 4,0
Задача № 2 В лаборатории для проведения биохимических экспериментов требуется приготовить 100 мл фосфатного буферного раствора с pH = 7,2. Вопросы: 1.Какой раствор называется буферным? Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов. рН буферных растворов мало изменяется при прибавлении к ним небольших количеств сильного основания или сильной кислоты, а также при разбавлении и концентрировании.
2.Из каких компонентов состоит фосфатная буферная система? В крови ёмкость фосфатной буферной системы невелика (составляет около 2 % общей буферной ёмкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче. Буфер образован неорганическими фосфатами. Роль кислоты в этой системе выполняет однозамещённый фосфат (NaH2PО4), а роль сопряженного основания — двузамещённый фосфат (Na2HPО4). При рН 7,4 соотношение [НРО42-/Н2РО4-] равняется {\displaystyle 10^{pH-pK_{a,orto}^{II}}=1,55} поскольку при температуре 25+273,15K pKa, ортоII=7,21[3], при этом средний заряд аниона ортофосфорной кислоты < q >=((-2)*3+(-1)*2)/5=-1,4 единиц заряда позитрона. Буферные свойства системы при увеличении в крови содержания водородных ионов реализуются за счет их связывания с ионами НРО42- с образованием Н2РО4-: {\displaystyle {\mathsf {H^{+}+HPO_{4}^{2-}\rightarrow H_{2}PO_{4}^{-}}}} а при избытке ионов ОН- — за счет связывания их с ионами Н2РО4-: {\displaystyle {\mathsf {H_{2}PO_{4}^{-}+OH^{-}\rightleftarrows HPO_{4}^{2-}+H_{2}O}}} Фосфатная буферная система крови тесно взаимосвязана с бикарбонатной буферной системой.
3.К какому типу буферных систем относится фосфатный буфер? 4.По какой формуле вычисляется pH фосфатного буферного раствора?
где рКа (Н2РО4-) – отрицательный десятичный логарифм константы диссоциации фосфорной кислоты по второй ступени рКа (Н2РО4- - слабая кислота); с (НРО42-) и с (Н2РО4-) - соответственно концентрации
5.В каких объемных соотношениях надо смешать исходные растворы компонентов фосфатной буферной системы, молярная концентрация которых 0,1 моль/л, чтобы приготовить 100 мл буферного раствора с pH = 7,2, если pKa (H3PO4) = 1,9; pKa (H2PO4-) = 7,2; pKa (HPO42-) = 12,3? Ответьте на тесты: 1. Буферные системы поддерживают постоянство 1. водородного показателя + 2. концентрации ионов водорода 3. концентрации гироксиионов- 4. концентрации катионов металлов 5. концентрации анионов 2. Из двух солей состоит буферная система 1. ацетатная 2. фосфатная + 3. аммиачная 4. бикарбонатная 5. гемоглобиновая 3. Однокомпонентной может быть буферная система 1. белковая + 2. ацетатная 3. фосфатная 4. аммиачная 5. гидрокарбонатная 4. Кислотной буферной системой может быть 1. белковая 2. ацетатная 3. фосфатная 4. аммиачная 5. гидрокарбонатная+
Занятие №3
|
||||||||||||
|
Последнее изменение этой страницы: 2016-12-17; просмотров: 1209; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.66.149 (0.015 с.) |