
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства растворов электролитов
1. Электролиты – это вещества, которые …. 1) увеличивают скорость химических реакций 2) характеризуются отсутствием ионов в растворе 3) в воде и других полярных растворителях, а также при расплавлении, распадаются (диссоциируют) на ионы 4) способны поглощать, адсорбировать другое вещество
2. Наименьшей частицей растворённого вещества в растворах электролитов является …. 1) нейтральный атом 2) молекула 3) ион 4) электрон
3. Процесс распада веществ на ионы под действием полярных молекул растворителя называется …. 1) электролизом 2) гидролизом 3) термической диссоциацией 4) электролитической диссоциацией
4. Электролитической диссоциации подвергаются химические соединения, содержащие …. 1) ковалентные неполярные или ионные связи 2) ковалентные сильно полярные или ионные связи 3) ковалентные неполярные или ковалентные полярные связи 4) любые химические связи
5. Степенью электролитической диссоциации (α) называется отношение …. 1) количества электролита в растворе к объёму раствора 2) числа молекул электролита к числу молекул растворителя 3) числа молей электролита, распавшегося на ионы, к общему числу молей электролита в данном растворе 4) числа гидратированных молекул электролита к объёму раствора
6. Степень диссоциации электролита в растворе при данной температуре зависит от …. 1) давления 2) наличия катализатора 3) природы и концентрации электролита 4) агрегатного состояния электролита
7. Степень ионизации уксусной кислоты уменьшается при добавлении …. 1) NаСl 2) Н2О 3) СН3СООNа 4) КОН
8. При разбавлении раствора степень диссоциации электролита …. 1) увеличивается 2) уменьшается 3) не изменяется 4) изменяется неоднозначно
9. Для слабого электролита АВ закон разбавления Оствальда выражается формулой …. 1) 3) К = (1 + α) · с2АВ 4) К = (1 – α) · сАВ
10. Слабые электролиты …. 1) практически полностью диссоциируют 2) имеют степень диссоциации, близкую к единице 3) диссоциируют в малой степени 4) не диссоциируют
11. Величиной, которая характеризует степень диссоциации электролита и не зависит от его концентрации, является …. 1) рН раствора 2) константа диссоциации 3) ионное произведение воды
4) степень диссоциации
12. Константа диссоциации для процесса
АВ
определяется выражением …. 1) К = [АВ] · [А+] · [В–] 2) 3)
13. Для констант ступенчатой диссоциации ортофосфорной кислоты Н3РО4 соблюдается неравенство …. 1) К1 > К2 < К3 2) К1 < К2 > К3 3) К1 > К2 > К3 4) К1 < К2 < К3
14. Константа диссоциации слабого электролита не зависит от …. 1) концентрации раствора 2) температуры 3) природы электролита 4) природы растворителя
15. Сильными электролитами являются …. 1) хромат калия 2) ацетат натрия 3) уксусная кислота 4) азотистая кислота
16. Для веществ СН3СООН и СН3СООК верно, что …. 1) оба вещества – сильные электролиты 2) оба вещества – слабые электролиты 3) только второе вещество – сильный электролит 4) только первое вещество – сильный электролит
17. Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в …. 1) растворы сахарозы и глюкозы 2) растворы хлорида натрия и уксусной кислоты 3) ацетон и в крахмальный клейстер 4) глицерин и в расплав гидроксида натрия
18. Слабыми электролитами являются …. 1) хлорид натрия и этанол 2) уксусная и сероводородная кислоты 3) нитрат кальция и уксусная кислота 4) хлорид кальция и метанол
19. Концентрация ацетат-ионов наименьшая в 0,1 М растворе …. 1) СН3СООNа 2) СН3СООК 3) СН3СООН 4) СН3СООАg
20. Концентрация ионов NН4+ наименьшая в 0,1 М растворе …. 1) нитрата аммония 2) сульфата аммония 3) хлорида аммония 4) аммиака
21. Ионы водорода образуются при ионизации …. 1) КОН 2) Н2SО4 3) Са(ОН)2 4) FеОНВr
22. Ионы Мn2+ образуются при электролитической диссоциации …. 1) КМnО4 2) МnО2 3) К2МnО4 4) МnSО4
23. Многоосновные кислоты и многокислотные основания диссоциируют …. 1) быстро 2) медленно 3) ступенчато 4) необратимо
24. Электролитическая диссоциация воды описывается уравнением …. 1) Н2О 3) Н2О
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
1. Уравнение 1) скорость диссоциации воды 2) константу (произведение) растворимости
3) константу диссоциации воды 4) ионное произведение воды
2. Ионное произведение воды при 20 0С равно … моль2/л2. 1) 10–7 2) 7 3) 14 4) 10–14
3. Ионному произведению воды соответствует выражение …. 1) [Н+] · [ОН–] = 10–7 2) 3) [Н+] · [ОН–] = 10–14 4) [Н+] = [ОН–] = 10–14
4. Водородный показатель раствора, содержащего 10–5 моль/л ионов Н+, равен …. 1) 10–5 2) 5 3) 10–9 4) 9
5. Водородный показатель раствора, содержащего 10–5 моль/л ионов ОН–, равен …. 1) 10–5 2) 5 3) 10–9 4) 9
6. Наименьший рН имеет раствор с концентрацией ионов водорода, равной … моль/л. 1) 10–2 2) 10–4 3) 10–6 4) 10–8
7. Наибольший рН имеет раствор с концентрацией гидроксид-ионов … моль/л. 1) 10–7 2) 10–4 3) 10–8 4) 10–10
8. Концентрация ионов водорода в растворе, рН которого равен 10, составляет … моль/л. 1) 10–10 2) 10–6 3) 10–4 4) 10–3
9. Значение рОН в растворе, водородный показатель которого 10, равно …. 1) 4 2) 7 3) 1 4) 14
10. Для уменьшения рН на единицу концентрацию ионов водорода в растворе следует …. 1) увеличить в 10 раз 2) уменьшить в 10 раз 3) увеличить в 2 раза 4) уменьшить в 2 раза
11. В растворе уксусной кислоты водородный показатель может быть равен …. 1) 14 2) 10 3) 7 4) 4
12. В растворе гидроксида натрия рН может быть равен …. 1) 2 2) 5 3) 7 4) 12
13. Водородный показатель сантимолярного раствора азотной кислоты (если α = 100 %) равен …. 1) 1 2) 2 3) 3 4) 4
14. Водородный показатель 0,01 М раствора НСl (степень ионизации принять равной 1) равен …. 1) 0 2) 1 3) 2 4) 3
15. В растворе с концентрацией серной кислоты 5 · 10–4 моль/л (если α = 1) рН равен …. 1) 3 2) 4 3) 10 4) 11
16. Водородный показатель 0,05 М раствора Н2SО4 (степень электролитической диссоциации принять равной 100 %) равен …. 1) 1 2) 7 3) 14 4) 2
17. В растворе с концентрацией гидроксида калия 0,01 моль/л (степень электролитической диссоциации принять равной 100 %) рН равен …. 1) 2 2) 0,01 3) 10 4) 12
18. Раствор, в 1 л которого содержится 0,63 г азотной кислоты, имеет рН …. 1) 12 2) 2 3) 3 4) 11
19. В растворе гидроксида стронция, рН которого равен 11, концентрация ионов ОН– составляет … моль/л. 1) 10–3 2) 2 · 10–3 3) 5 · 10–4 4) 10–11
20. В 0,056 М растворе уксусной кислоты (Кд = 1,8 · 10–5 ) рН равен …. 1) 0 2) 1 3) 2 4) 3
21. Водородный показатель воды при 25 0С равен …. 1) 10–14 2) 14 3) 10–7 4) 7
22. Для приготовления 1 л раствора соляной кислоты с рН = 2 необходимо … моль НСl. 1) 2 2) 0,01 3) 0,02 4) 1
23. Вещество, изменяющее свою окраску в зависимости от рН среды, называется …. 1) индикатором 2) электролитом 3) реагентом 4) катализатором
РЕАКЦИИ ИОННОГО ОБМЕНА
1. Уравнение реакции, практически осуществляемой в водном растворе, имеет вид …. 1) СuSО4 + 2КОН = К2SО4 + Сu(ОН)2 2) Fе2(SО4)3 + 6НNО3 = 2Fе(NО3)3 + 3Н2SО4 3) Ва(NО3)2 + 2NаОН = 2NаNО3 + Ва(ОН)2 4) NаNО3 + НСl = NаСl + НNО3
2. В растворе одновременно могут существовать ионы …. 1) Ва2+, NО3–, SО42–, NН4+, Вr– 2) Zn2+, Сl–, Fе2+, Са2+, ОН– 3) Сu2+, Вr–, S2–, Аg+, NО3– 4) Fе2+, SО42–, Nа+, NН4+, NО3–
3. В результате взаимодействия КNО2 с Н2SО4 образуется …. 1) осадок 2) слабое основание 3) слабая кислота 4) газ
4. Реакция между растворами аммиака и хлороводорода относится к … взаимодействию. 1) нуклеофильному 2) кислотно-основному 3) окислительно-восстановительному 4) каталитическому
5. Сумма стехиометрических коэффициентов в полном ионно-молекулярном уравнении реакции ортофосфата калия с хлороводородной (соляной) кислотой равна ….
1) 9 2) 14 3) 17 4) 20
6. Сумма стехиометрических коэффициентов в полном ионно-молекулярном уравнении реакции сульфида железа(II) с хлороводородной кислотой равна …. 1) 9 2) 10 3) 11 4) 12
7. Сумма стехиометрических коэффициентов в сокращённом ионно-молекулярном уравнении реакции карбоната натрия с нитратом кальция равна …. 1) 3 2) 5 3) 7 4) 9
8. Суммы стехиометрических коэффициентов в полном и сокращённом ионно-молекулярных уравнениях реакции гидроксида железа(III) с серной кислотой соответственно равны …. 1) 22 и 16 2) 22 и 8 3) 28 и 18 4) 14 и 10
9. Реакции карбоната бария с соляной кислотой соответствует сокращённое ионно-молекулярное уравнение …. 1) Ва2+ + 2Сl– = ВаСl2 2) Ва2+ + СО32– + 2Н+ + 2Сl– = Ва2+ + СО32– + 2НСl 3) ВаСО3 + 2Н+ = Ва2+ + СО2 + Н2О 4) 2Н+ + СО32– = Н2СО3
10. Сокращённому ионно-молекулярному уравнению 2Н+ + СО32– = СО2 + Н2О соответствует реакция …. 1) азотной кислоты с карбонатом кальция 2) сероводородной кислоты с карбонатом калия 3) хлороводородной кислоты с карбонатом натрия 4) сернистой кислоты с карбонатом лития
11. Ионно-молекулярное уравнение реакции FеСl2 с Н2S имеет вид …. 1) Fе2+ + S2– = FеS 2) Fе2+ + Н2S = FеS + 2Н+ 3) Н2S = S2– + 2Н+ 4) Fе2+ + Н2S = Fе2+ + S2– + 2Н+
12. Сокращённое ионно-молекулярное уравнение Н+ + ОН– = Н2О соответствует реакции …. 1) NаОН + НNО2 = NаNО2 + Н2О 2) Сu(ОН)2 + Н2SО4 = СuSО4 + 2Н2О 3) Ва(ОН)2 + 2НNО3 = Ва(NО3)2 + 2Н2О 4) 2КОН + Н2S = К2S + 2Н2О
13. При составлении молекулярного уравнения реакции по сокращённому ионно-молекулярному уравнению 2Аg+ + СО32– = Аg2СО3 необходимо использовать ионы …. 1) Сl– и Ва2+ 2) NО3– и Са2+ 3) I– и Н+ 4) NО3– и Nа+
14. В сокращённом ионно-молекулярном уравнении реакции СаСО3 с НСl имеется …. 1) 2 иона и 1 вещество в молекулярной форме 2) 3 иона и 3 вещества в молекулярной форме 3) 2 иона и 2 вещества в молекулярной форме 4) 3 иона и 1 вещество в молекулярной форме
15. Левая часть сокращённого ионно-молекулярного уравнения … = Мg2+ + Н2О + СО2 имеет вид …. 1) Мg2+ + НСО3– + Н+ 2) МgСО3 + Н2СО3 3) МgСО3 + 2Н+ 4) Мg2+ + СО32– + 2Н+
ГИДРОЛИЗ СОЛЕЙ
1. Причиной щелочной или кислой реакции растворов многих солей является …. 1) электролитическая диссоциация воды 2) их электролитическая диссоциация 3) гидратирование ионов 4) их гидролиз
2. Гидролизу подвергается …. 1) СН3СООК 2) КСl 3) Са(NО3)2 4) Nа2SО4
3. Реакция водного раствора хлорида аммония ….
1) слабощелочная 2) сильнощелочная 3) кислотная 4) нейтральная
4. Щелочную реакцию имеет водный раствор …. 1) NаI 2) К2SiО3 3) Аl2(SО4)3 4) Nа2SО4
5. Нейтральную среду имеет раствор солей …. 1) RbNО3 2) СsF 3) ВаСl2 4) НСООК
6. Для водных растворов Nа2SО3 и Nа2SiО3 верно, что …. 1) только во втором растворе среда кислая 2) только во втором растворе среда щелочная 3) в обоих растворах среда щелочная 4) в обоих растворах среда кислотная
7. По катиону гидролизуется …. 1) СН3СООК 2) ZnСl2 3) Са(NО3)2 4) К2SО3
8. Гидролизу по аниону подвергается …. 1) К2СО3 2) СuSО4 3) Nа2SО3 4) ВаСl2
9. Одновременно по катиону и аниону гидролизуется …. 1) NН4Сl 2) СН3СООNа 3) КNО2 4) СН3СООNН4
10. Кислая соль образуется при гидролизе …. 1) фторида калия 2) нитрита калия 3) фосфата калия 4) карбоната калия
11. Осно́вная соль образуется при гидролизе …. 1) хлорида аммония 2) ацетата калия 3) нитрата цинка 4) хлорида железа(III)
12. Ступенчатому гидролизу подвергается …. 1) К2SiО3 2) КNО2 3) FеСl2 4) NН4Сl
13. Реакция гидролиза сульфита натрия по первой ступени описывается уравнением …. 1) Nа2SО3 2) Nа2SО3 + 2Н2О 3) Nа+ + Н2О 4) Nа2SО3 + Н2О
14. Реакция гидролиза сульфида натрия по I ступени описывается уравнением…. 1) Nа2S + Н2О 2) Nа2SО3 + Н2О 3) Nа2SО3 + 2Н2О 4) Nа2S + 2Н2О
15. Реакция гидролиза соды по I ступени описывается уравнением …. 1) Nа2СО3 2) Nа2СО3 + 2Н2О 3) Nа+ + Н2О 4) Nа2СО3 + Н2О
16. Продуктами гидролиза FеСl3 по I ступени являются …. 1) Fе и Сl2 2) Fе(ОН)3 и НСl 3) FеОНСl2 и НСl 4) Fе(ОН)2Сl и НСl
17. Реакция гидролиза нитрата цинка по первой ступени описывается уравнением …. 1) Zn(NО3)2 + 2Н2О 2) Zn(NО3)2 + Н2О 3) Zn(NО3)2 4) Zn(NО3)2 + Н2О
18. Реакция гидролиза нитрата меди(II) по I ступени описывается ионно-молекулярным уравнением …. 1) Сu(NО3)2 + Н2О = СuОНNО3 + НNО3 2) Сu(NО3)2 = Сu2+ + 2NО3– 3) Сu2+ + Н2О = СuОН+ + Н+ 4) Сu2+ + NО3– + Н+ + ОН– = СuОН+ + НNО3
19. Уравнение реакции СН3СООNа + Н2О в ионно-молекулярной форме имеет вид …. 1) СН3СОО– + Nа+ + Н2О 2) СН3СОО– + Nа+ + Н2О 3) СН3СОО– + Н2О 4) СН3СОО– + Н2О
20. Правая часть сокращённого ионно-молекулярного уравнения реакции гидролиза ацетата калия имеет вид …. 1) СН3СОО– + Н+ + К+ + ОН– 2) СН3СООН + ОН– 3) СН3СОО– + Н+ + КОН 4) СН3СООН + КОН
21. Правая часть сокращённого ионно-молекулярного уравнения реакции гидролиза хлорида алюминия по первой ступени имеет вид …. 1) Аl(ОН)3 + Н+ 2) АlОН2+ + Н+ 3) Аl(ОН)2+ + Сl– 4) Аl(ОН)3 + Сl–
22. Равновесие реакции гидролиза, описываемой ионно-молекулярным уравнением СО32– + НОН смещается вправо при …. 1) добавлении NаНСО3 2) охлаждении раствора 3) подщелачивании раствора 4) подкислении раствора
23. Степень гидролиза (h) хлорида железа(III) увеличивается при …. 1) повышении температуры 2) повышении концентрации раствора
3) подкислении раствора 4) подщелачивании раствора
24. Степень гидролиза хлорида алюминия уменьшается при добавлении …. 1) гидроксида натрия 2) серной кислоты 3) хлорида натрия 4) воды
25. Водородный показатель (рН) 0,1 М раствора NаСl …. 1) ≈ 7 2) = 0 3) < 7 4) > 7
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 336; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.101.60 (0.146 с.) |
 · сАВ 2) К =
· сАВ 2) К = 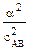
 А+ + В–
А+ + В–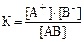
 4) К = [АВ]
4) К = [АВ] = [Н+] · [ОН–] выражает ….
= [Н+] · [ОН–] выражает ….



