
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрический ток в жидкостях.
Жидкости по степени электропроводности делятся на: Электролит Электролитическая диссоциация
Ион Рекомбинация ионов Между процессами электролитической диссоциации и рекомбинации при неизменных условиях устанавливается динамическое равновесие. Степень диссоциации Электропроводимость электролитов Электронная проводимость - также в небольшой мере присутствует в электролитах, но в основном характеризует электропроводимость жидких металлов. Зависимость сопротивления электролита от температуры Поэтому
Применение электролиза 3. Плоский конденсатор заполнили диэлектриком и на пластины подали некоторую разность потенциалов. Энергия конденсатора при этом равна W = 2*10-5 Дж. После того, как конденсатор отключили от источника, диэлектрик вынули из конденсатора. Работа, которую надо было совершить для этого, равна А = 7*10-5 Дж. Найдите диэлектрическую проницаемость диэлектрика. Билет №20
|
|||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 235; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.142.248 (0.006 с.) |

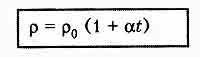 ,
,









